针刺和神经干细胞联合治疗脑瘫幼鼠的效果评价
付 强,祁岩超*,唐纯志,刘振寰,林世坚,唐鸿生
( 1.广州医学院附属肿瘤医院实验中心,广东 广州 510095;2.广州中医药大学针灸推拿学院,广东 广州 510405;3.佛山市南海区妇幼保健院,广东 佛山 528200)
脑性瘫痪(cerebral palsy,CP)是小儿先天性或围产期所发生的脑功能障碍性综合征,是继脊髓灰质炎被控制后近代最常见的儿童致残性疾病[1]。针刺作为中医治疗中的一枝奇葩在治疗小儿脑瘫方面有着不错疗效[2]。但完全治愈率仅5%左右。本实验通过针刺和神经干细胞联合治疗脑瘫幼鼠,以探讨其协同作用对其学习记忆能力和脑内神经再生的疗效,最大限度地改善其学习记忆能力和肢体运动能力。为临床应用提供理论依据。
1 资料与方法
1.1 试剂和仪器
DMEM/F12培养基和B27(GIBCO)公司;碱性成纤维细胞生长因子(basic f broblast growth fact,b FGF)、表皮生长因子(epidermal growth fact,EGF)(GIBCO)。温室一/二抗(自配)。主要仪器有:G6805-1电针治疗仪(中国青岛鑫升实业有限公司),Y迷宫(河南省原阳县振华教育仪器厂),BX50生物组织显微镜(Olympus),免疫荧光显微镜(Olympus)。
1.2 实验动物及分组
清洁级健康新生SD幼鼠40只(体质量>12 g),由广州中医药大学实验动物中心提供。随机选取8只作为正常对照组(正常组);成功模型随机分成以下3组,每组8只:模型组、单纯针刺组、脑瘫+NSC移植治疗组。
1.3 方法
1.3.1 HIBD动物模型制作参照文献[4]用乙醚浅麻醉幼鼠,分离左颈总动脉并结扎(模型组、治疗组),缝合切口后放入37℃恒温水浴容器中恢复2 h,然后密闭容器,以1 L/min的速度通入8%氧气+92%氮气的混合气体,2.5 h后取出,1 h后作行为测定。翻身不能,平衡异常和左旋者视为成功模型,并返回鼠笼中饲养。
1.3.2 针刺部位:参考《实验针灸学》[5],结合人与动物骨类比,选取百会,颞1针,曲池,内关,足三里,涌泉。 方法:以直径0.2 mm,长20 mm的华佗牌针刺针,头部穴位平刺,进针后觉针下沉紧即可,百会、颞1针接G6805-II电针仪,连续波,频率5~10 Hz,以头部轻微抖动为度,约3~5 V,持续10 min。曲池,足三里穴针1分针深左右,电针同上。内关、涌泉速刺微出血,不留针。每天一次,共21 d。
1.3.3 神经干细胞的分离培养及鉴定参照宣爱国等的培养实验方法[6]取新生SD大鼠(<24 h),在无菌条件下分离出海马,制成单细胞悬液,加入含B27、表皮生长因子(EGF)和碱性成纤维细胞生长因子(FGF-2)的DMEM/F12培养基。镜下观察,待原代克隆形成后机械分离成单细胞悬液,按上述条件继续培养。以后每5~7 d分离克隆传代1次,方法同前。神经干细胞鉴定细胞过程:培养的干细胞加入包被POLYL-Lycine的6孔板,PBS洗2次,10 min/次。4%多聚甲醛固定20 min。0.01mPBS洗2次,每次5 min。0.01 mPBS+0.2% tritonx-100穿透30 min。0.3%~0.5%二抗宿主血清(山羊血清)封闭60 min。室温一抗(nestin 1︰500;GFAP 1︰500,Tuj-1 1︰100,O4 1︰200分孔加入6孔板)孵育2 h,或4℃过夜,湿盒保温。0.01 mPBS+0.2% tritonx-100或PBS洗涤3次,每次3 min。室温二抗生物素标记物(或FITC标记山羊抗小鼠)孵育60 min(1︰200)用湿盒保存,此时避光操作。0.01 PBS洗涤3次,每次10 min。用DAPI(一种荧光染料,呈蓝色)或heochst染核10~30 min。0.01 PBS洗涤10 min 1次。用缓冲甘油封片,荧光或共聚焦显微镜观察。
1.3.4 海马组织病理形态学检测(HE染色法)组织经10%中性缓冲福尔马林固定,常规包埋,石蜡切片4 UM,二甲苯两缸脱蜡各6 min,无水乙醇洗脱二甲苯1 min χ2次,95%、90%、85%酒精各1 min,自来水漂洗2 min,蒸馏水浸洗1 min,苏木精染色3~5 min。自来水洗1 min。1%盐酸酒精分化3 s。自来水洗1 min。1%稀氨水返蓝30 s后,镜下控制。自来水洗1 min。伊红染色1 min。自来水冲30 s。85%酒精脱水30 s。90%酒精脱水30 s。95%酒精两次脱水各2 min。无水乙醇两次各2 min。二甲苯三次各2 min。中性树胶封片。普通光镜10×20倍下随机观察每张切片5个不同视野内脑缺血后病理变化情况,并计数正常神经比较低数目,取平均值。
1.3.5 脑皮质神经细胞凋亡检测(TUNEL法)幼鼠脑组织经10%中性福尔马林固定,常规脱水,石蜡包埋,切片厚4μ m。切片经纯二甲苯脱腊二次,每次6分钟。梯度乙醇脱二甲苯各2 min。自来水漂洗、PBS漂洗各3次,每次2 min,切片浸入0.1% Triton×100液室温下处理8 min。流水冲洗2 min,入PBS洗1 min,3次。滴加转换液37℃处理30 min。入PBS洗2 min,3次。BCIP-NBT显色液镜下控制显色约10 min,流水冲洗3 min,入PBS洗2 min,3次。擦去组织周围水分,GVA水溶性封片剂封片,室温晾干。每张切片在10×20倍光镜下随机观察每一组动物同一部位切片,选择5个不重复视野进行观察,并联接图像分析系统,测出每张切片5个不重复视野内全部正常神经细胞及凋亡神经细胞的数目,取其平均值,算出凋亡指数。
1.3.6 细胞移植 将以上培养的NSC神经球吹打成单个细胞,反复清洗后调细胞浓度为1×108,取2 μL,细胞为2×105。在日光灯照射下通过尾静脉注射。隔天1次,共3周。
1.3.7 行为学实验:(1)悬吊实验 使幼鼠前腿抓住一水平的不锈钢棒(直径约5 mm)。离地面高约45 cm,以秒为计算单位,记录幼鼠掉下的时间。时间越短说明肌力越好。(2)斜坡实验,将幼鼠头向下倒置于45℃斜面上,记录幼鼠转为头向上135℃角度的时间,以秒为计算单位,记录时间。时间越短说明随意运动越好。(3)Y迷宫实验电压50 V~60 V,试验前先将幼鼠放入迷宫中适应3~5 min,然后以无规则次序变换安全区。幼鼠受电击后逃到安全区后,灯光继续作用10~15 s。再以幼鼠所在支臂就作为下一次测试的起始位置进行下一次测试。记录幼鼠从打开灯到逃到安全区所需时间。凡幼鼠受电击后10 s内一次性从起步逃到安全区的反应称为“正确反应”,否则为“错误反应”。
1.4 统计学分析
2 结果
2.1 行为学检测
2.1.1 悬吊实验结果(表1)。
表1 悬吊实验结果

表1 悬吊实验结果
注:各组与模型组相比★P<0.01;针刺+NSC组与单纯针刺组相比▲P =0.027<0.01。
实验分组 n 术后24 d正常组 8 59.27±1.58★模型组 8 26.19±13.61单纯针刺组 8 131.2±11.79★针刺+NSC组 8 40.54±10.65★▲
2.1.2 斜坡实验结果(表2)。
表2 各组幼鼠斜坡实验结果 (
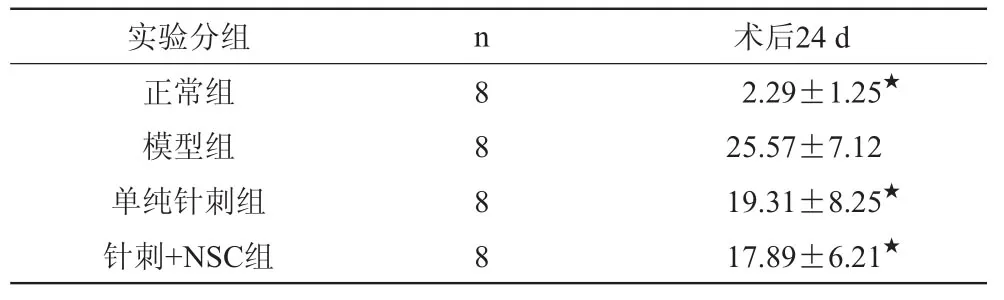
表2 各组幼鼠斜坡实验结果 (
注:各组与模型组相比★P<0.01。
正常组 8 12.29±1.25★模型组 8 25.57±7.12单纯针刺组 8 19.31±8.25★针刺+NSC组 8 17.89±6.21★
2.1.3 Y迷宫实验结果(表3)。实验分组 n 正确次数
表3 各组幼鼠术后24 d Y迷宫试验正确次数 (,秒)

表3 各组幼鼠术后24 d Y迷宫试验正确次数 (,秒)
注:各组与模型组相比★P<0.01;针刺+NSC组与单纯针刺组相比▲P =0.015<0.01。
正常组 8 19.27±1.13★模型组 8 19.15±2.15单纯针刺组 8 13.16±1.32★针刺+NSC组 8 16.26±1.41★▲
2.2 组织学检测
2.2.1 脑内海马组织正常神经细胞数目(表4)。
表4 各组幼鼠海马组织正常神经细胞数目(个/视野)

表4 各组幼鼠海马组织正常神经细胞数目(个/视野)
注:各组与模型组相比★P<0.01;针刺+NSC组与单纯针刺组相比▲P =0.007<0.01。
实验分组 n 正常神经细胞数正常组 8 21.69±1.75★模型组 8 11.37±0.82单纯针刺组 8 15.38±1.26★针刺+NSC组 8 17.15±1.22★▲
2.2.2 脑皮质内神经细胞凋亡指数(见表5)。
注:凋亡指数(apoptosis index, AI)是指每张TUNEL阳性切片中,选取5个阳性细胞数(细胞核中有棕黄色颗粒者)最多的高倍视野,计算其中阳性细胞所占的百分比。
表5 各组幼鼠脑皮质神经细胞凋亡指数(,%)

表5 各组幼鼠脑皮质神经细胞凋亡指数(,%)
注:各组与模型组相比★P<0.01;针刺+NSC组与单纯针刺组相比▲P=0.006<0.01。
实验分组 n 凋亡指数正常组 8 10.89±0.15★模型组 8 17.82±1.13单纯针刺组 8 14.36±2.35★针刺+NSC组 8 11.79±1.43★▲
脑组织涂片:普通光镜10×20倍下随机观察每张脑组织切片病理形态学变化情况:脑组织常规石蜡切片,HE染色后,神经细胞核呈蓝黑色,胞浆呈淡红色。(1)正常组皮层脑细胞结构正常,间质无水肿表现,胞浆丰富,胞核清晰可见,海马锥体细胞2~3层,而且相邻细胞间排列紧密,核仁清晰,细胞核圆而大。(2)模型组可见皮层变薄,部分神经元变性,体积变小,核固缩成三角形或不规则形,核仁消失,胞核与胞浆界限模糊。海马锥体细胞层数减少,排列稀疏,不规则,细胞体积变小,可见核固缩现象。(3)单纯针刺组、针刺+NSC组仍有不同程度的神经细胞变性,但变性神经细胞数量显著减少,零星可见一些损伤细胞,海马锥体细胞层细胞形态、排列基本正常。
3 讨论
针灸治疗脑瘫已经得到国内外学者的共识,但其机制尚不清楚,可能是通过针刺的良性诱导,促进了一系列细胞因子的产生与释放,从而改善了NSC所赖以生存的脑内微环境并进一步促进NSC增殖与定向分化,最终达到修复脑瘫脑损伤的目的[7]。因此,可以认为针刺是促进了脑内源性NSC的增殖和分化。但仅内源性NSC不足以修复损伤的脑组织,外源性神经干细胞移植可解决这一难题,但仍存在较大的局限性,主要是转化为神经干细胞的比率低,疗效欠佳[7]。如果有针刺的干预,可能会使其整合到相应脑区继续发挥作用。随着对小儿脑瘫研究的不断深入,CP的治疗手段逐渐增多。神经干细胞移植治疗小儿脑瘫成为目前的一种新的治疗方向。本研究中我们将祖国传统医学精华-针灸疗法加以改进,用现代神经干细胞技术,移植足量的NSC到SVZ区,即解决了针炙促进SVZ区NSC增殖数量有限的难题。又使外源性NSC转化为神经元的效率尽可能得到提高。最终使脑瘫治疗的有效率和治愈率提高。本实验研究结果证实,针刺和神经干细胞联合移植对脑瘫幼鼠的学习记忆能力、肢体运动能力以及脑组织细胞数量的维持和抑制凋亡均有显著效果。
[1] 王维治.神经病学(第5版)[M].北京:人民卫生出版社,2007:279.
[2] 钟玉涛,李胜吾.针刺治疗小儿脑瘫近况概述[J].吉林中医药, 2010,30(5).
[3] SnyderEY,YoonC,Flax JD,et a1.Muhipotent neural precursors Call differentiate to ward replacement of neurous undergoing targeted apoptotic degeneration in adult mouse neocortex[J].Proc Natl Acad Sci USA,1997,9:I1 663-11 668.
[4] 张 敏,杨万章,吴 芳,等.神经生长因子配合脐血源神经干细胞移植对脑瘫患儿运动功能的影响[J].中国误诊学杂志,2008,8(23):5 596-5 598.
[5] 余曙光,郭 义.实验针灸学[M].上海科技出版社,2009,1,1.
[6] 宣爱国,龙大宏,杨丹迪,等.神经干细胞和脑源性神经营养因子联用对痴呆模型鼠基底前脑p75表达及其学习记忆能力的影响[J].解剖学杂志,2007,30(1):43-45.
[7] 刘 乡,柴铁劬,孙 娟,等.靳三针疗法对窒息脑瘫幼鼠神经干细胞增殖与分化的实验研究[J].广州中医药大学学报,2010:231-235.

