头颅M R、DWI、M RS、术中快速冰冻与脑胶质瘤病理分级对比
赵东晖 李庆军 何建芳 方学文 卢义生
广东东莞市人民医院 1)病理科 2)神经内科 3)放射科 东莞 523000
胶质瘤是中枢神经系统常见肿瘤,约占颅内肿瘤的40%,近年来其发病率呈明显上升趋势。胶质瘤分级对患者手术方式、疗效分析和生存评估有重要的意义。目前采用的方法主要有三种,术前分期只能依赖于影像学初步估计如磁共振T1、T2、磁共振扩散加权成像(diffusion weighted imaging, DWI)、表观弥散系数(apparent diffusion coefficient,ADC)值和磁共振波谱(magnetic resonance spectroscopy,M RS)分析;术中快速冰冻分析;术后免疫组化和特殊染色,后者只能在术后进行,对胶质瘤的术前和术中评估无作用。本文对我院2006-01~2010-12确诊为脑胶质瘤的37例患者进行术前磁共振分析、术中快速冰冻、术后常规染色进行回顾性分析,为胶质瘤术前和术中诊断和分级提供更详实依据。
1 资料和方法
1.1 一般资料 免疫组化确诊为胶质瘤39例,磁共振提示胶质瘤37例,男21例,女16例;年龄18~66岁,平均46.3岁。
1.2 检查方法
1.2.1 MRI:磁共振拟诊胶质瘤患者,术前均常规磁共振T1、T2、DWI、磁共振波谱分析。采用西门子1.5T超导磁共振扫描仪,进行常规T1WI、T2WI轴位、T2WI矢状位及增强的T1WI轴位、矢状位、冠状位扫描,扩散及灌注扫描,再行DWI相同层面扫描。①ADC和rADC值测定:采用单次激发自旋回波-回波平面成像(SE-EPI)序列,获得扩散加权图像并重建表面扩散系数图(ADC图);行常规增强横断、冠状和矢状T1WI扫描。在M RI平扫和增强基础上,将肿瘤最大层面作为MRS定位层面,尽可能包括肿瘤实质部分,测量ADC值,每处病变测量3次,取平均值,尽量避开肿瘤的囊变、坏死、出血的区域,并取相应镜像对侧正常脑实质的ADC值,肿瘤实质与对侧相应部位正常脑组织的ADC值的比值为rADC值。②H1-M RS测定:采用单体素氢质子波谱点分辨波谱(PRESS)序列,TR/TE:1500/135 ms,自动匀场,水抑制,体素20 mm×20 mm×20 mm,激发次数(NEX)为1,成像时间278 s。均对肿瘤实质部分、对侧相应正常区域N-乙酰门冬氨酸(NAA)、胆碱类化合物(Cho)、肌酸(Cr)等化合物进行检测,观察 Cho/Cr、NAA/Cho、NAA/Cr值变化。
1.2.2 快速冰冻方法:①开机预冷:提前开机,将低温恒冷切片机冷台及切片刀冷至-25℃左右。②滴加包埋剂:在改进后的组织包埋托上滴加包埋剂,待冷冻好后修平,将组织平放于修好的平面上,冷冻片刻,修切。③切片:用手术刀片切去组织周围多余的包埋剂。使之成为长方形或正方形,然后开始切片,切片厚度3~5 μ m。④固定:95%乙醇或乙醚酒精混合液(乙醚,95%乙醇等量混合)固定5~10 s。⑤染色:苏木素1~2 min,0.5%盐酸酒精分化1 s,0.25%氨水返蓝,伊红染1 min,95%乙醇3 s,无水乙醇3 s,在烘片机上烤干,封片。
1.2.3 免疫组化方法:①石蜡切片脱蜡至水;②3%H2O2孵育5~10 min,以清除内源性过氧化物酶的活性;③蒸馏水冲洗,PBS浸泡5 min;④滴加适当比例稀释的一抗,37℃孵育1~2 h或4℃过夜;⑤PBS冲洗,2 min×3次;⑥滴加二抗, 37℃孵育20 min,PBS冲洗,2 min×3次;⑦显色剂显色(DAB),以PBS代替一抗作为阴性对照,已知胶质纤维酸性蛋白(GFAP)阳性切片作为阳性对照,自来水充分冲洗、复染、脱水、透明、封片。
1.3 统计学分析 统计学处理使用SPSS 15分析软件,将所得数据每2组样本之间进行 t检验和卡方检验,采用spearman检验进行各组间相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 胶质瘤术前M RI和术中冰冻切片拟诊分级及对比分析 免疫组化确诊为胶质瘤经磁共振提示胶质瘤37例,其中低级别19,高级别18例;术中快速冰冻切片,诊断低级别14例,高级别23例;术后病理证实,其中低级星形细胞瘤(Ⅰ~Ⅱ级)15例,间变型星形细胞瘤(Ⅲ级)8例,胶质母细胞瘤(Ⅳ级)14例;15例1~2级者为低级别组,22例Ⅲ~Ⅳ级者为高级别组。应用常规MR序列分析术前诊断脑胶质瘤分级与病理分级结果的准确率为81.7%,快速冰冻和免疫组化准确率为97.3%,磁共振脑胶质瘤分期和免疫组化病理分级差异无统计学意义(P>0.05)。见表1,图1、2。

表1 常规MR序列术前诊断脑神经胶质瘤分级与病理分级

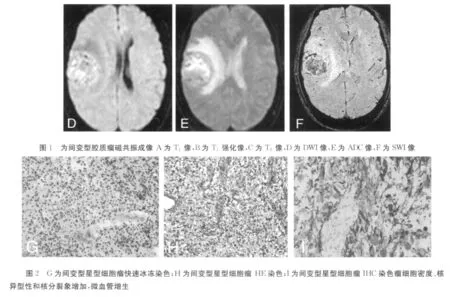
2.2 ADC值分析和MRS值和比值分析 2组ADC值和rADC值见表2;H1-M RS结果见表3;相关性分析显示,ADC和rADC值均与肿瘤级别呈明显负相关(r分别为-0.723、-0.799,P<0.05);NAA/Cho和NAA/Cr与肿瘤级别呈明显负相关(r分别为-0.811、-0.762,P<0.05);Cho/Cr与胶质瘤级别呈正相关(r=0.801,P<0.05)。
表2 不同级别胶质瘤ADC值及rADC值比较(±s)

表2 不同级别胶质瘤ADC值及rADC值比较(±s)
注:高级别与低级别组比较,P<0.05
?
表3 不同级别胶质瘤M RS结果比较(±s)
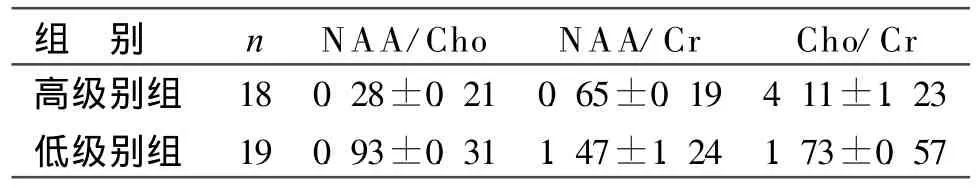
表3 不同级别胶质瘤M RS结果比较(±s)
注:高级别与低级别组比较,P<0.05
?
3 讨论
脑胶质瘤是中枢神经系统最常见的原发性肿瘤,占60%,可发生在中枢神经系统的任何部位,特别是大脑半球,好发于成年人,其组织学特点和生物学行为变化很大,胶质瘤在早期即可沿轴索或白质纤维呈浸润性生长,但与组织学一般没有什么关系,随着恶性程度不断增加,最终发展成胶质母细胞瘤。神经症状与胶质瘤在中枢神经系统内的部位相关,病史的长短,无复发的存活时间长短与肿瘤的生物学行为密切相关。根据WHO神经胶质瘤分级标准,将胶质瘤分为Ⅰ~Ⅳ级,Ⅰ、Ⅱ级属低级别胶质细胞瘤,Ⅲ、Ⅳ级为高级别胶质瘤。弥漫性星形细胞瘤为Ⅱ级胶质瘤,术后平均存活时间约6~8 a,影响病程长短主要是其恶变为胶质母细胞瘤时间。间变型星形细胞瘤是Ⅲ级胶质瘤,起源于低级别星形细胞瘤,弥漫浸润的星形细胞瘤伴灶性或散在间变,增生活跃,具有发展成胶质母细胞瘤的倾向,间变型星形细胞瘤发展成胶质母细胞瘤时间约2 a。胶质母细胞瘤是Ⅳ级胶质瘤,是人类恶性程度最高的肿瘤之一,原发性胶质母细胞瘤的生存期约1 a,因此对胶质瘤术前和术时正确分级,对选择手术方式和判断预后有重要的指导意义。
MR常规成像(T2WI和T1WI增强)因分辨率低等因素影响,只能通过肿瘤占位效应及强化形态和程度等形态学变化来间接反映肿瘤的恶性程度,而难以显示已侵入正常脑组织的肿瘤增生血管,难以对肿瘤周围水肿区和非强化肿瘤实质区进行鉴别,所以不能准确地判断肿瘤的病理分级[1]。
由于肿瘤细胞代替了正常脑组织,肿瘤细胞数量增多和体积增大,都会影响细胞间隙和水分子扩散运动,肿瘤细胞构成和核质比增大则导致ADC值下降。肿瘤细胞构成反映了肿瘤细胞增生、坏死、凋亡,肿瘤增殖越旺盛,恶性程度越高,细胞构成越高。同时肿瘤细胞构成越高,其侵袭及转移性越强,磁共振ADC值越低,因此ADC值有助于良恶性肿瘤的鉴别[2]。为消除绝对ADC值个体差异,我们选rADC作为观察指标,本研究比较了胶质瘤实质区ADC值与肿瘤细胞构成和级别的相关性,二者呈负相关,说明rADC值在一定程度上反映胶质瘤的恶性程度。
MR波谱能够在活体组织中对组织的化学组成和分子运动状态进行检测。不同类型或级别的肿瘤有不同的生长方式及代谢水平,MRS值能够反映颅内病变的组织代谢和生化改变。Oshiro等在脑胶质瘤M RS研究中发现,高级别胶质细胞瘤如胶质母细胞瘤的Cho/Cr值明显高于低度恶性胶质瘤如星形细胞瘤和间变型星形细胞瘤[3]。Zhou等也证实星形细胞肿瘤的Cho/Cr值与肿瘤的恶性程度具有正相关性,总的趋势是Cho/Cr值越高,肿瘤恶性度越高[4]。本研究结果显示,脑胶质瘤患者病变与对侧正常脑组织1H-M RS明显不同,表现为随胶质瘤级别升高NAA逐渐下降,Cho逐渐升高,cr轻度下降;其相应的代谢物比值亦与胶质瘤级别呈显著的相关性,即随胶质瘤级别的升高,NAA/Cho和NAA/Cr值下降,Cho/Cr值升高,二者均有明显相关性,与文献报道相一致[5]。
胶质瘤术前分级诊断对于患者的术前和术后治疗方案的选择有重要价值,磁共振在胶质瘤术前分级有广泛应用前途。磁共振成像在诊断胶质瘤方面特异性高,但磁共振成像在胶质瘤分级中和术中快速冰冻、术后免疫组化相比虽无统计学差异,但仍具有一定的局限性,本研究发现磁共振分级和病理分级准确率约81.7%,两者之间仍有较大差距,与文献报道相一致[6],因此磁共振分级不能代替病理学分析,而快速冰冻和免疫组化准确率为97.3%,两者之间有较高的一致性。
总之,脑胶质瘤的ADC值和代谢产物比值与肿瘤病理级别呈明显相关性,利用ADC值和代谢产物比值可以区分正常脑组织、低级别和高级别脑胶质瘤,但是磁共振分级与快速术中和术后病理分级准确率相对较低,磁共振分级可作为术前分级的重要依据,但不能代替术中和术后病理分级,磁共振分级有待进一步完善,以提高其分级的准确率。
[1] 黄鹤,何宁,张玉东,等.脑神经胶质瘤磁敏感加权成像与病理分级之间的关系[J].肿瘤,2008,28(12):1 077-1 080.
[2] 张妍芬,高思佳,赵立峰,等.脑胶质瘤M R弥散加权成像与病理对照研究[J].现代肿瘤医学,2008,16(6):925-928.
[3] Oshiro S,Tsugu H,Komatsu F,et al.Quantitative assessment of gliomas by proton magnetic resonance spectroscopy [J].Anticancer Res,2007,27(6A):3 757-3 763.
[4] Zhou GF,Wang XY,Gong CG,et al.Value of proton magnetic resonance spectroscopy with two-dimensional chemicalshift imaging in evaluating brain g liomas[J].Nan Fang Yi Ke Da Xue Xue Bao,2008,28(8):1 342-1 314.
[5] 范波,赵勇刚,杨晋生,等.二维氢质子磁共振波谱分析在胶质瘤诊治中的应用价值[J].中国实用神经疾病杂志,2009,12 (1):88-89.
[6] 邹艳,陆正齐弘,杨钦泰,等.MRI灌注和扩散加权成像对脑胶质瘤分级的比较研究[J].中山大学学报(医学版),2010,31 (3):417-421.

