磷酸盐对高效产氢菌种BiohydrogenbacteriumR3sp.nov.发酵产氢性能的影响和调控*
李永峰, 陈 红, 韩 伟, 王占青, 徐菁利
(1.上海工程技术大学化学化工学院,上海201620;2.东北林业大学林学院,黑龙江哈尔滨150040)
石化能源在过去的几个世纪主宰着人类的生活,19世纪70年代的产业革命以来,石化燃料的消费量急剧增长,进入20世纪以后(特别是第二次世界大战以来)石油和天然气的生产与消费持续上升,随着科技的发展和社会生活水平的提高,人们对能源的需求量也与日俱增,据统计世界上最近25年内能源的消耗量相当于过去100年的消耗[1],如今能源的消耗量已成为衡量人们生活水平和文明程度的一个重要标志。
然而过去对石化能源粗放型的使用,造成了现在十分恶劣的环境污染,温室效应和酸雨等环境问题的出现导致了人类生态环境的恶化,并严重的影响到社会经济的可持续发展和人类的生存;同时石化能源的储量越来越少,据估算,以目前的储量和开采程度,石油仅能维持50~80年,煤炭也只能维持200~300年左右[2-3],因此高效、清洁的二次能源的开发已成为全世界研究的热点课题。
氢气作为一种清洁的可再生能源,由于具有燃烧时不放出CO2等温室气体、燃烧热值高、储存运输方便等优势从众多替代能源中脱颖而出[4-5],成为研究重点。氢气的制取有很多种,包括甲烷裂解、水电解、光合法制氢以及发酵法制氢等。厌氧发酵生物制氢技术与传统的制氢方法相比,由于其不依靠光源就能持续进行、不消耗化石能源、产氢率更稳定高效、反应器的设计与运行更简便易操作等众多优点,它的另一个亮点在于厌氧发酵的微生物可以利用高浓度的有机废水和生物质(如复合固体废弃物、阴沟底泥等)作为它的底物,这既可以解决环境问题又能产生洁净能源—氢气[6-7]。
营养是生命活动的起始点,它为一切生命活动提供了必须的物质基础[8]。磷是微生物细胞合成核酸、核蛋白、磷脂及其他含磷化合物的重要元素,几乎所有微生物可将无机磷酸盐作为磷源而直接利用;磷在糖代谢磷酸化过程中起关键性作用,因此在培养基中添加该元素可以促进微生物的生长与发育;同时磷酸盐对于发酵生物制氢系统的稳定运行起着重要的作用,它可以作为缓冲剂来减小细菌培养初期较大的pH值波动。在产氢厌氧消化过程中,挥发性脂肪酸伴随着氢气的产生而产生,如果不定时的从培养基中排出这些有机酸,则会严重的影响着培养液pH值的稳定性,挥发性脂肪酸和碱度之间平衡失调会导致氢气产生的中断,因此必须通过投加碳酸盐或磷酸盐来提高系统的抗酸碱冲击性。
本实验旨在探索研究磷酸盐对纯培养制氢系统氢气生产的影响,从而提高纯菌种发酵产氢的效能,为纯菌种连续流发酵产氢奠定基础。
1 材料与方法
1.1 供试菌种
本实验采用的菌种为本实验室从活性污泥里提取的高效产氢菌种BiohydrogenbacteriumR3sp.nov.[9](菌种鉴定的国际DNA数据库登记号为AF363375),其透射电镜照片如图1所示,Biohydrogenbacterium R3sp.nov.为革兰氏阳性菌,不形成芽孢,杆菌;大小为0.3~0.5 μm×1.5~2.0μm;周生鞭毛,且鞭毛较长;形成的菌落呈现白色或乳白色,20~30d可以长成至直径为1.0~2.5mm,菌落边缘整齐,圆形,光滑,不透明;类脂粒4~6个,异染粒2~3个。
实验时采用LR-HPB培养基[10],其成份如下:葡萄糖20.0 g/L;胰蛋白胨1.0 g/L;蛋白胨3.0 g/L;牛肉膏 2.0 g/L;酵母汁 1.0 g/L;NaCl3.0 g/L;K2HPO41.0 g/L;L-半胱氨酸0.5 g/L;维生素液与微量元素(抗坏血酸0.025 g/L;叶酸0.01 g/L;NiCl2· 6H2O 0.001 g/L;CaCl2·2H2O 0.01 g/L;ZnCl20.02 g/L)10ml;刃天青(0.2%)1ml。

图1 菌株BiohydrogenbacteriumR3sp.nov.的透射电镜照片/20000×Fig.1 TEM images/20000×ofBiohydrogenbacteriumR3sp.nov.
1.2 间歇实验
实验以150ml的锥形瓶作为反应器 (如图2所示),各培养瓶中分别加入100 mL培养液,纯菌种BiohydrogenbacteriumR3sp.nov.接种量为1 mL。将反应瓶放入恒温汽浴振荡器中,温度 (35±1)℃、转速120 r/min下培养48 h,培养液的起始pH值调节为6.0。为保证厌氧条件,整个装瓶、接种过程均在高纯氮吹脱下进行。

图2 间歇反应器装置Fig.2 Experimental apparatus of hydrogen production reactor
本次实验分为两部分,第一部分研究了K2HPO4对BiohydrogenbacteriumR3sp.nov.发酵产氢效能的影响,实验时,对培养基中的K2HPO4浓度从0 mg/L逐步添加到3 mg/L;第二部分研究了由K2HPO4与K2HPO4以1:1比例混合作为缓冲溶液对Biohydrogenbacterium R3sp.nov.发酵产氢效能的影响,PBS的浓度由0.01 mol/L逐步添加至0.3 mol/L。
1.3 测量及分析方法
以OD600nm表示细胞生长量;pH值的测量采用国家标准方法[11];葡萄糖浓度用葡萄糖试剂盒法进行测量;产气量由LM-1型湿式气体流量计测量。
液相末端发酵产物采用GC-122型气相色谱仪、氢火焰检测器;采用上海分析仪器厂生产的GC-122型气相色谱仪,不锈钢柱,柱长2 m(内径5 mm),担体GDX103,60~80目,氢火焰检测器,汽化室200℃,柱温190℃,检测室温度240℃,载气氮气,流速50 ml/min,氢气流速50 ml/min,空气流速500 ml/min。测量时取1 ml被测样品,加入浓度为6 mol/L的HCl 1~2滴,在5000 rpm/min下离心15 min,取上清液2 μl进样检测。氢气、氮气和空气来源分别来自氢气发生器、氮气发生器和空气发生器。
发酵气体的组分采用上海分析仪器厂生产的SC-II型气相色谱仪进行测量,安装热导池检测器,不锈钢柱,柱长与直径2 m×φ5,载体TDX,60-80目,载气氮气,流速70 ml/min,柱温和检测室温度150℃,进样量0.5 ml。
2 结果与讨论
2.1 K2HPO4对Biohydrogenbacterium R3 sp. nov.发酵及生长效能的影响
2.1.1 K2HPO4对 Biohydrogenbacterium R3 sp. nov.产氢的影响
众所周知磷是辅酶Ⅰ、辅酶Ⅱ、辅酶A、辅羧化酶、各种磷酸腺苷等的组分,同时在底物水平磷酸化过程中起着与甘油醛-3-磷酸结合产生1,3-二磷酸甘油酸,随后用于ATP合成的关键性作用。因此在菌种的培养过程中适量的添加磷酸盐,能够显著的提高菌种生长及产氢的能力。
如图3所示,培养基中未添加K2HPO4时的生物气体和氢气产量分别为2736.5 ml/L和996 ml/L,比产氢率为1.13 mol H2/mol葡萄糖,然而当培养基中添加了0.5 g/LK2HPO4时,BiohydrogenbacteriumR3sp.nov.的比产氢率立即开始上升至1.86 mol H2/mol葡萄糖;生物气体产量、氢气产量以及比产氢率都随着培养基中K2HPO4浓度的继续升高而升高,并且在K2HPO4的浓度达到1.5 g/L时达到最大值,分别为4960 ml/L和2107.5 ml/L,氢气含量为42.49%,此时的比产氢率也达到了最大值1.93 mol H2/mol葡萄糖;然而,当K2HPO4浓度达到2.0 g/L时,生物气体和氢气产量急剧减少至3652 ml/L和2036 ml/L,比产氢率也下降至1.2 mol H2/mol葡萄糖;当K2HPO4在3.0 g/L时,生物气体和氢气的产量仅为零。磷酸盐的过量添加不仅对菌种的生长及产氢起不到促进作用,反而干扰了正常的底物水平磷酸化的过程,ATP不能正常的产生,导致菌种缺少能量来源,从而其生长及产氢作用被抑制,甚至使菌种进入衰亡期或直接死亡。

图3 K2HPO4对BiohydrogenbacteriumR3sp.nov.产氢效能的影响Fig.3 Effects of K2HPO4on hydrogen production of BiohydrogenbacteriumR3sp.nov.
2.1.2 K2HPO4对Biohydrogenbacterium R3 sp.nov.生长的影响
如图4所示为K2HPO4对Biohydrogenbacterium R3sp.nov.的OD600nm和葡萄糖利用率的影响。OD600nm随着K2HPO4的添加呈现剧烈的变化,在K2HPO4浓度为0.5 g/L时出现了一次剧烈的下降,这是因为一部分的BiohydrogenbacteriumR3sp.nov.不适应额外的磷酸盐浓度的突然增加而出现了菌种死亡的情况,存活下来的BiohydrogenbacteriumR3sp.nov.菌种依然保持着高效产氢的活性。当培养基中的K2HPO4浓度达到1.0 g/L~2.5 g/L时,OD600nm维持在1.35 g/L~1.6 g/L之间,而 K2HPO4浓度为 3 g/L时的OD600nm由于高浓度磷酸盐抑制现象又下降至0.2 g/L。
BiohydrogenbacteriumR3sp.nov.对葡萄糖的利用率一直保持在95%左右,并没有因为K2HPO4的添加而受到过多的波动,这表明BiohydrogenbacteriumR3 sp.nov.能够几乎完全利用葡萄糖底物作为自身生长、发育及产氢的营养物质。值得注意的是,当K2HPO4浓度为3 g/L时,细胞生长以及产氢能力都急速下降,然而BiohydrogenbacteriumR3sp.nov.对葡萄糖的利用率仅下降至90.82%。这是因为在高浓度的磷酸盐条件下,反应初期的BiohydrogenbacteriumR3sp.nov.能够利用葡萄糖进行生长,但当培养基中的葡萄糖剩余不多时候,在高浓度磷酸盐以及缺乏碳素营养的作用下,BiohydrogenbacteriumR3sp.nov.开始死亡,所以当试验结束的时候会发现当 K2HPO4浓度为 3g/L时,BiohydrogenbacteriumR3sp.nov.的产氢能力几乎为零,OD600nm也低至0.2g/L,但是葡萄糖消耗率依然维持在90%左右。
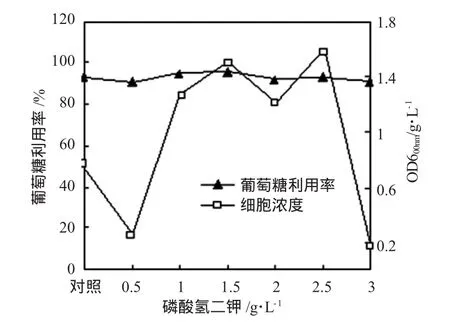
图4 K2HPO4对BiohydrogenbacteriumR3sp.nov.葡萄糖利用率和氢气含量的影响Fig.4 Effects of K2HPO4on glucose consumption ration and H2 content ofBiohydrogenbacteriumR3sp.nov.
2.1.3 K2HPO4对BiohydrogenbacteriumR3 sp.nov.液相末端产物的影响
K2HPO4对BiohydrogenbacteriumR3sp.nov.液相末端产物以及发酵终pH值的影响见图5。BiohydrogenbacteriumR3sp.nov.为乙醇型发酵细菌,乙醇和乙酸为主要液相末端发酵产物,因此反应结束的终pH值保持在3.5~5范围内。当 K2HPO4在浓度为1. 0~2.5 g/L范围内时,乙醇和乙酸的产量相对较高,当K2HPO4浓度为1.5 g/L时,乙醇和乙酸的浓度最高,分别是5613.58 mg/L和2884.84 mg/L;随 K2HPO4浓度的继续升高,乙醇和乙酸的产量急剧下降。液相末端产物中始终以乙醇和乙酸为主,K2HPO4浓度的变化没有改变菌株BiohydrogenbacteriumR3sp.nov.发酵产氢的代谢类型,代谢类型仍属乙醇型发酵。当K2HPO4浓度为0 g/L~2 g/L范围内的终pH值始终保持在3.0~3.5之间,但当K2HPO4浓度超过2.5 g/L时,培养基内的终pH值急剧上升至3.94,然而即使在K2HPO4浓度为3 g/L,BiohydrogenbacteriumR3sp.nov.的产氢量降至0时,培养基的终pH值也仅为4.83,这说明K2HPO4的存在不仅对BiohydrogenbacteriumR3sp.nov.的生长产氢具有良好的促进作用,同时对于培养基内的环境pH值也具有良好的缓冲作用,提高了培养基系统的抗酸碱冲击性,为BiohydrogenbacteriumR3sp. nov.的生长提供了pH值适宜的酸碱环境。
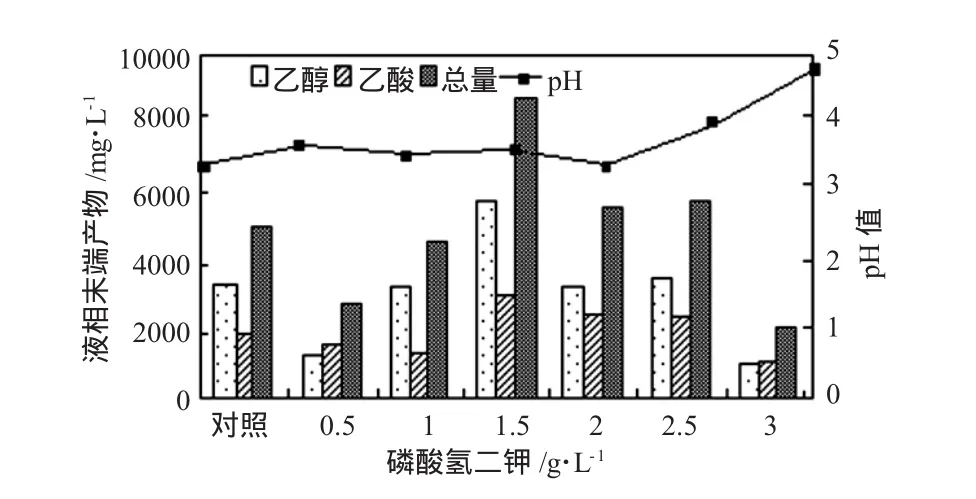
图5 K2HPO4对BiohydrogenbacteriumR3sp.nov.液相末端产物的影响Fig.5 Effects of K2HPO4on the end liquid products of BiohydrogenbacteriumR3sp.nov.
2.2 PBS对Biohydrogenbacterium R3 sp.nov.产氢发酵效能的影响
2.2.1 PBS对Biohydrogenbacterium R3 sp.nov.产氢发酵的影响
由于磷元素通常以1价或2价的磷酸根离子(H2PO4-和HPO42-)的形式参与糖代谢等重要过程,与其他有机物结合形成磷脂、核酸、辅酶和ATP等,因此本实验用KH2PO4和KH2PO4以1:1比例混合制成PBS添加到培养基中,研究其对BiohydrogenbacteriumR3 sp.nov.的产氢与发酵效能的影响。
图6所示磷酸盐的浓度对Biohydrogenbacterium R3sp.nov.产氢效能具有较明显的影响。当培养基中添加了0.01mol PBS之后,BiohydrogenbacteriumR3sp. nov.的产气量及产氢量分别为2960 ml和1256 ml,平均产氢速率也达到了2.3632 mmol H2/g cell·h,并且BiohydrogenbacteriumR3sp.nov.的产氢量及平均产氢速率都随着PBS的浓度持续增加而呈现上升趋势,当PBS浓度达到0.15 mol时,Biohydrogenbacterium R3sp.nov.的生物气体、氢气产量和平均产氢速率分别达到最大值 3860 ml/L、1832.7 mlH2/L和 2.6324 mmol H2/g·cell·h,但是当PBS的浓度继续上升时,BiohydrogenbacteriumR3sp.nov.的产气量及产氢量急剧下降,当PBS浓度为0.2 mol时,Biohydrogenbacterium R3sp.nov.的产气量及产氢量则分别下降为1500 ml和 342.1mlH2/L,而 PBS浓度达到 0.25 mol时,BiohydrogenbacteriumR3sp.nov.几乎不能够产生氢气,产氢量下降至0。磷元素积极参与到BiohydrogenbacteriumR3sp.nov.的发酵代谢循环中,浓度适中的磷酸盐对BiohydrogenbacteriumR3sp.nov.的发酵及产氢效率具有十分明显的促进作用,BiohydrogenbacteriumR3sp.nov.的产氢代谢十分旺盛。
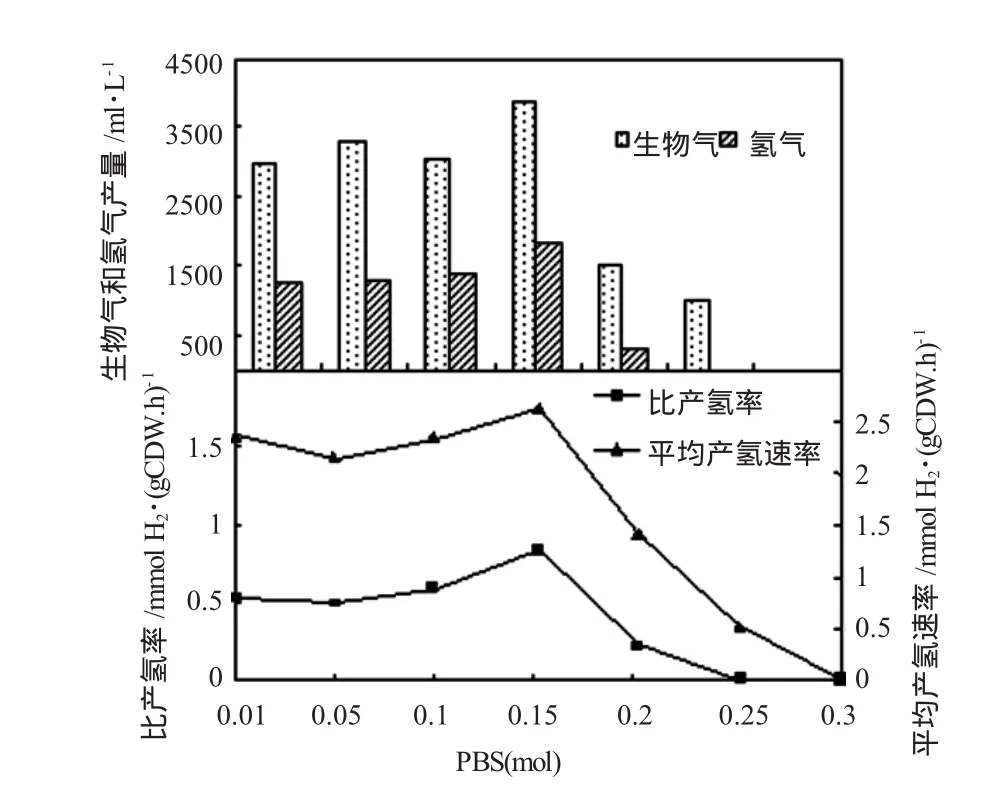
图6 PBS对BiohydrogenbacteriumR3sp.nov.产氢性能的影响Fig.6 Effects of PBS on hydrogen production of BiohydrogenbacteriumR3sp.nov.
PBS对BiohydrogenbacteriumR3sp.nov.的葡萄糖利用率以及细胞生长的影响如图7所示,可以看出,当培养基中添加了PBS之后,BiohydrogenbacteriumR3 sp.nov.的葡萄糖利用率呈现出来剧烈的波动,当磷酸盐缓冲液浓度为0.05 mol时,葡萄糖的利用率最高为98.5%;而当磷酸盐缓冲液浓度高于0.05 mol时,葡萄糖利用率逐渐下降;当磷酸盐缓冲液浓度为0.20 mol时,葡萄糖利用率降到最低值58.2%。当PBS浓度继续增加时,BiohydrogenbacteriumR3sp.nov.的葡萄糖利用率又继续上升,当PBS浓度上升至0.3 mol时,葡萄糖浓度则又上升至66.7%,这与氢气产量的变化趋势正好相反。

图7 磷酸盐缓冲液对BiohydrogenbacteriumR3sp.nov.葡萄糖利用率和OD600nm的影响Fig.7 Effects of PBS on glucose consumption ration and H2content of BiohydrogenbacteriumR3sp.nov.
当培养基中添加了 PBS之后的BiohydrogenbacteriumR3sp.nov.并没有出现生长速度迅速增加的情况,其变化趋势与葡萄糖利用率的变化趋势比较类似,OD600nm在PBS浓度为0.05 mol和0. 25 mol时达到最大值与最小值分别为0.5058 g/L和0.02702 g/L。
2.2.2 PBS对Biohydrogenbacterium R3 sp.nov.液相末端发酵产物的影响
如图8所示,PBS对液相末端产物的影响特征与其对产氢量的影响特征相似。当PBS浓度为0.15 mol时,乙醇和乙酸产量最大,分别为6987.58 mg/L和6148.08 mg/L,此时的产氢量也最高(氢气产量为1832.7 mlH2/L),说明氢气的产生与乙醇相伴而生,间接的证明了乙醇型发酵细菌代谢类型的存在。当PBS浓度继续上升时,乙醇和乙酸的产量迅速降低,当PBS浓度上升至0.3 mol时,乙醇和乙酸浓度分别降低至 0 mg·L-1和 461.87 mg·L-1,此时,由于BiohydrogenbacteriumR3sp.nov.的生长及产氢代谢都十分微弱,而添加了0.3 mol后PBS后的培养基初始pH值为6.0,经过发酵之后的终pH值却上升为6.43,这是因为浓度过高的PBS中,由于磷元素过多,打乱了BiohydrogenbacteriumR3sp.nov.生化反应过程的正常运行,PBS不仅不能对BiohydrogenbacteriumR3sp.nov.起到酸碱调节保持其适宜的pH值生长环境,反而使得菌种BiohydrogenbacteriumR3sp.nov.大量死亡,反应体系的发酵作用几乎停止。

图8 磷酸盐缓冲液对菌株BiohydrogenbacteriumR3sp.nov.液相末端产物的影响Fig.8 Effects of phosphate buffer on end liquid products of BiohydrogenbacteriumR3sp.nov.
3 结论
(1)K2HPO4对BiohydrogenbacteriumR3sp.nov.的生长及产氢效能都具有良好的促进作用,且培养基中的pH值具有良好的维持作用,当K2HPO4浓度为1.5 g/L时,BiohydrogenbacteriumR3sp.nov.的生物气体产量、氢气产量以及产氢率都达到最大,分别为4960 ml/L, 2107.5 ml/L和1.93 mol H2/mol葡萄糖,培养基内的pH值始终维持在3.0~5.0之内,此pH值被认为是乙醇型发酵产氢菌种的适宜pH值。
(2)PBS对BiohydrogenbacteriumR3sp.nov.的生长及产氢效能以及缓冲培养基终pH值同样也具有较良好的促进作用,当PBS浓度达到0.15 mol时,BiohydrogenbacteriumR3sp.nov.的生物气体,氢气产量和平均产氢速率分别达到最大值3860 ml/L,1832.7 mlH2/L和2.6324 mmol H2/g·cell·h。
[1] F A LOPES PINTOMO.Troshina,P.Lindblad.A Brief Look at Three Decades of Research on Cyanobacterial[J].Hydrogen Evolution.Int.J. Hydrogen Energy,2002,27:1209~1215.
[2]鲍德佑.太阳能-氢能系统的发展前景[J].太阳能学报,1995,16(1):114~120.
[3]S DUNN.HYDROGEN Futures:Toward a Sustainable Energy System[J]. Int.J.Hydrogen Energy,2002,27:235~264.
[4]DAS D,VEZIRO,GLU TN.Hydrogenproductionby biological processes:a survey of literature[J].Int J Hydrogen Energy,2001,26: 13~28.
[5]DEBABRATA Das,Advances in biohydrogen production processes:An approach towardscommercialization[J].InternationalJournalof Hydrogen Energy,2009(34):7349~7357.
[6]XUEMEI LIU,NANQI REN,FUNAN SONG,et al.Recent advances in fermentative biohydrogen production[J].Progress in Natural Science, 2008(18):253~258.
[7]NATIONAL ACADEMY OF SCIENCE.The Hydrogen Economy: Opportunities,Costs,Barriers,and R&D Needs[M].Washington,DC: National Academies Press,2004.
[8]周德庆.微生物学教程[M].第二版.高等教育出版社,2002:82~84.
[9]LI YONG-FENG,REN NAN-QI,ZHENG GUO-XIANG,et al.Effects of carbon-nitrogen mass ratio on hydrogen production of fermentative H2-producing bacterium[J].Chemical Engineering(China),2005,33(4): 41~43.
[10]LIN MING,REN NAN-QI,MA XI-PING.et al..Selection and improvement of culture for hydrogen producing bacteria[J].Journal of Harbin Institute ofTechnology,2003,35(4):398~402.
[11]STATEENVIRONMENTALPROTECTIONADMINISTRATION (SEPA).Water and Wastewater Monitoring Analysis Method(Ⅳ)[M]. Beijing:China Environment Science Press,2006:102~210.

