纤维素分解菌的选育及在粪便堆积发酵中最佳生长条件的研究*
吴皓琼, 牛彦波, 曹亚彬, 郭立姝, 殷 博
(黑龙江省科学院微生物研究所,黑龙江哈尔滨150010)
目前对畜禽粪便的处理主要包括物理法、化学法和生物法三大类。生物发酵处理法是近年来国内外研究较多的一种方法。该法具有成本低、发酵产物生物活性强、肥效高、易于推广等特点,同时可达到除臭、灭菌的目的,因而被认为是最有前途的一种畜禽粪便处理方法。在固体发酵畜禽粪便过程中,由于废弃物中含有大量纤维素,因此,加强纤维转化为腐殖质便成为发酵充分腐熟的关键。微生物是产生纤维素酶的主要来源,在发酵的过程中发挥了巨大的作用。细菌、放线菌和霉菌都能够产生纤维素分解酶,常作为接种剂加速粪肥等物料细胞壁和木质素、纤维素水解,促进腐殖化过程。其中分解纤维素的真菌主要有曲霉属(Aspergillus)、木霉属(Trichoderma)、青霉属(Penicillium)和镰刀菌属(Fusarium)的一些种。在发酵过程中,真菌对发酵物料的分解和稳定起着重要作用[1-5]。本研究从采集的畜禽粪便和土样中,对纤维素分解菌进行了筛选,同时对筛选出的纤维素分解菌与解磷巨大芽孢杆菌、细黄链霉菌等组合形成复合菌剂(另文发表)在粪便堆积发酵中最佳生长条件进行研究,旨在筛选出具有高酶活的纤维素分解菌并形成高效复合菌剂,加快纤维素的降解,提高粪肥堆积发酵速度与质量。
1 材料与方法
1.1 材料
省内采集的畜禽粪便和土样共计7个,用于纤维素分解菌的筛选。发酵试验用牛粪取自黑龙江省发酵工程技术中心。经成分分析:牛粪全氮含量为1.18﹪,全磷含量为0.48%,有机质(干基)38.5%,水分75.7%。复合菌剂由筛选出的纤维素分解菌和解磷巨大芽孢杆菌、细黄链霉菌等复合形成,本所生产。
1.2 培养基
羧甲基纤维素培养基:CMC-Na 15g,NH4NO31.0g,酵母膏1.0g,MgSO4·7H2O 0.5 g,KH2PO4·3H2O 1.0g,H2O 1000mL,pH自然,琼脂15g,121℃、30min蒸汽灭菌。
赫奇逊培养基:KH2PO4·3H2O 1.0g,MgSO4·7H2O 0.3g,CaCl20.1g,NaCl 0.1g,FeCl30.01g,NaNO32.5g,H2O 1000 mL,pH 7.0,121℃、30min蒸汽灭菌。
纤维素刚果红培养基:KH2PO4·3H2O 0.5g,MgSO4· 7H2O 0.25g,微晶纤维素1.88g,明胶2g,刚果红0.2g,土壤浸出液100 mL,H2O 900 mL,琼脂15g,pH 6.5,121℃、30min蒸汽灭菌。
纤维素琼脂培养基:(NH4)2NO32g,MgSO4·7H2O 1.0g,CaCO32g,NaCl 1.0g,H2O 1000 mL,琼脂15g,pH 7.0,121℃、30min蒸汽灭菌。
纯化培养基(PDA培养基):马铃薯汁20%,蔗糖20g,琼脂15g,水1000 mL,121℃、30min蒸汽灭菌。
固体曲培养基:无霉变米糠粉、麸皮(过60目筛),加适量无菌水,调节水分至50%左右,pH自然,121℃、60min蒸汽灭菌。
察氏培养基:蔗糖3.0g,NaNO33.0g,MgSO4· 7H2O 0.5g,KCl 0.5g,FeSO4·7H2O 0.01g,K2HPO41.0g,琼脂15.0g,H2O1000 ml,pH自然。
1.3 方法
1.3.1 纤维素分解菌的分离与纯化(初筛)
将样品采用“弹土法”点接于羧甲基纤维素培养基平板上,置28℃培养,挑选出在平板上生长快、透明圈大的培养物;将样品稀释到适宜程度(一般情况下10-1~10-3),吸取1mL稀释液,用纤维素刚果红培养基制成混菌平板,置28℃培养,挑选出在平板上生长快、红色浓郁且水解圈大的培养物;将样品接种于内放滤纸条的赫奇逊培养液中,置28℃培养5~7d,挑选出将滤纸条分解断裂快的培养物。
将挑选出的以上培养物在PDA培养基上多次划线和用稀释平板法筛选出单个菌落,结合镜检,反复多次,直至纯化为单菌株。
1.3.2 不同菌株对滤纸分解能力的测定(复筛)
采用滤纸失重率法:将选出的菌株单株或混合株分别接种于以滤纸为唯一碳源的选择性培养基中,28℃、120r/min摇床培养,观察滤纸的崩解效果,以“+”的多少来表示滤纸崩解程度,“+”越多,说明该菌株的降解效果越强。
用滤纸过滤发酵液,将残留物80℃烘干称重,用减重法计算出滤纸失重率。
计算公式:滤纸失重率S(%)=(A-B)/A× 100%
其中:A-初始滤纸重,gB-残留滤纸重,g。1.3.3不同菌株对羧甲基纤维素分解能力的测定(复筛)
将分离的单个菌株及其混合菌分别点种于羧甲基纤维素培养基平板上,28℃培养3d,测透明圈直径。并计算酶相对活性:
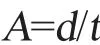
式中:A为相对活性;d为透明圈直径;t为培养时间。
1.3.4 纤维素酶的测定
1.3.4.1 接种与培养
将固体曲培养料121℃、60min蒸汽灭菌,冷却至35℃左右,抢温接种待测菌株悬液。置30℃静止培养,每24h取样测纤维素酶活。
1.3.4.2 粗酶液的制备
称2.0g发酵曲,加蒸馏水20 mL,30℃水浴1h,每15min摇匀一次,3000r/min离心5min,取上清液为粗酶液。
1.3.4.3 纤维素酶活的检测
用3,5二硝基水杨酸(DNS)比色法,测定还原糖含量来确定FPA、CMC、C1三种纤维素酶活。
FPA滤纸酶活的测定:缓冲液2.0 mL,加入1× 6cm新华滤纸一张,50℃预热5min后加入0.5 mL酶液,50℃保温1h,取出加2.5 mLDNS试剂,煮沸5min,冷却后加水5 mL,540nm处测定还原糖。
CMC酶活的测定(内切葡聚糖酶):2.0 mL含5% CMC的缓冲液,50℃预热5min后加0.5 mL酶液,其余操作同FPA酶活的测定。
C1酶活测定:2.0 mL缓冲液中加入50mg脱脂棉,50℃预热5min后加入0.5 mL酶液,50℃保温24h,其余操作同FPA酶活的测定。
酶活单位U:采用国际制单位,即在上述条件下,每分钟产生1μmol葡萄糖的酶量为一个单位。酶活力即扣除参比溶液中还原糖后,每毫升酶液中所含酶活单位的量。
1.3.5 菌株鉴定
参考《伯杰氏系统细菌学手册》、《真菌鉴定手册》进行鉴定。
1.3.6 复合菌剂在粪便堆积发酵中最佳生长条件的研究
以牛粪为实验对象,在实验室模拟条件下,将牛粪自然风干至含水量50%以下,去除大块杂质,磨碎待用,按L9(34)正交设计各因素水平用稻壳粉、2%麦饭石粉、水等调节物料的C/N比以及水分、pH值后,高温灭菌,置于中号医用搪瓷盘中,上覆塑料薄膜保水,28℃±1℃培养,培养2d后,进行翻堆,4d测定活菌数。每处理3次重复,均等取样混合测定各数值。活菌数的测定参见农业部微生物肥料标准NY884-2005进行。正交设计各因素水平见表1。
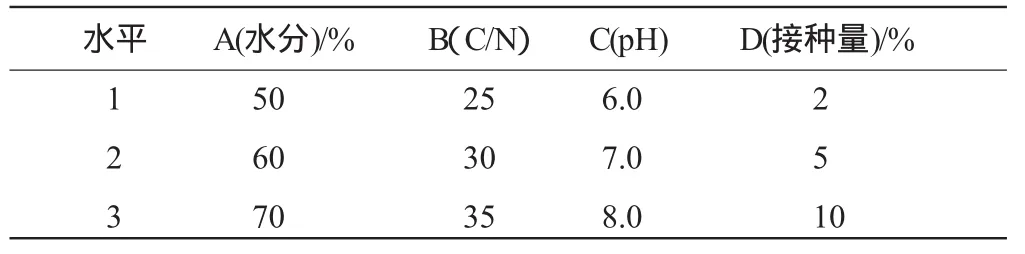
表1 复合菌剂在堆积发酵中最佳生长条件 L9(34)正交设计Table 1 L9(34)optimal growth conditions ofcomplexbacteriumin the compostingfermentation
2 结果与分析
2.1 纤维素分解菌菌种筛选及对滤纸、羧甲基纤维素分解能力的分析
对7种样品进行系统分离,初筛获得约20株菌,通过对菌落形态、生长速度的观察以及分解纤维素能力判定,挑选其中3株用PDA培养基平板进行分离纯化得到单个菌株B1、F1、F2。单个菌株B1、F1、F2以及它们相互混合对滤纸、羧甲基纤维素分解能力见表2、表3。从表2、表3可以看出:各菌株单独培养对滤纸、羧甲基纤维素均有一定的分解效果,但不如混合的效果好,B1、F1、F2混合培养8d时,滤纸失重率达到58.06%、酶相对活性0.93±0.00 cm·d-1,由此说明,3株菌株混合可以增加酶活力,各菌之间有很好的协同效应。
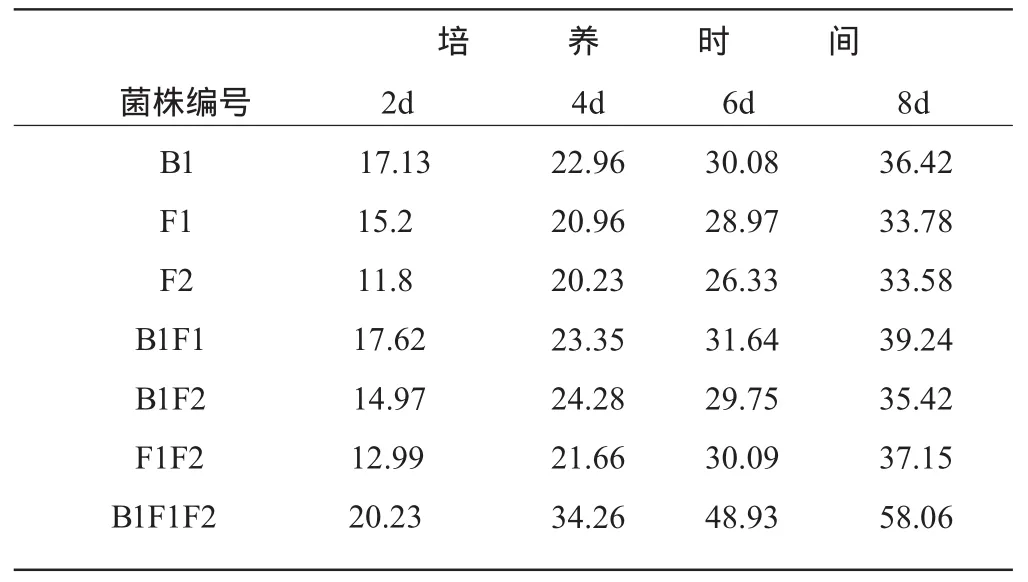
表2 不同培养时间的滤纸失重率/%Table 2 Weight loss offilter paper in different culture time
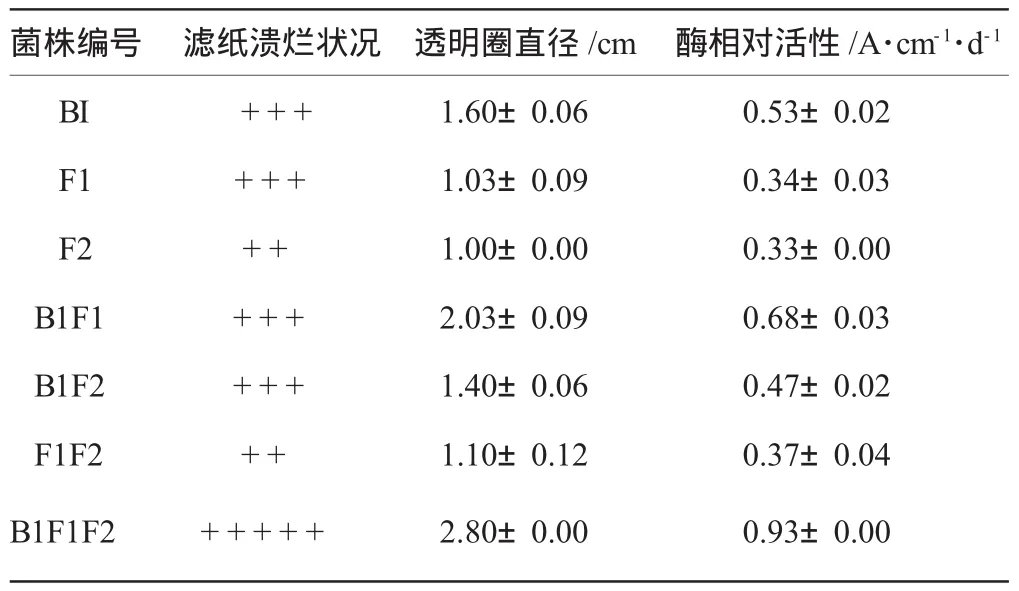
表3 不同菌株的纤维素酶相对活性及对滤纸的分解效果Table 3 The relative activityofcellulose and the decomposition effect of filter paper on different strains
2.2 纤维素分解菌酶活分析
结果见表4。从表4可见:B1、F1、F2菌株在固体曲中,都能很好地生长,随着培养时间的延长,酶活力提高,在培养5~6d时,酶活力达到最高。各菌株的FPA酶活力是B1F1F2>B1>F1>F2;CMC酶是F1>B1F1F2>B1>F2;C1酶是B1>B1F1F2>F1>F2。各菌混合后FPA酶活力显著增加,与各菌对滤纸、羧甲基纤维素分解能力的试验结果相吻合,进一步了证明菌种间的协同增效作用。基于酶活力大小的比较及生产成本的考虑,选择B1、F1菌作为堆肥发酵的试验生产菌。

表4 不同菌株固体曲的纤维素酶活分析 单位:U/mlTable 4 The cellulose activityofthe solid curve ofdifferent strains
2.3 菌株的鉴定
B1、F1菌株生长迅速,在察氏培养基上28℃培养7d,直径7~8cm,菌丝初期为白色,后期呈绿色,产孢丛束区摆列成同心轮纹,培养基背面成无色,培养基颜色不改变。分生孢子从菌丝的侧枝上生出,直立,分枝,小枝对生,顶端不膨大,上生分生孢子团,分生孢子球形,浅色或无色。F2菌株生长迅速,在察氏培养基上28℃培养7d,直径7~8cm,菌丝初期为白色,后期呈青绿色,培养基背面呈无色,培养基颜色不改变。营养菌丝有隔膜,分生孢子梗从菌丝垂直生出,孢梗顶端不膨大,分枝一次,顶端为小梗,分生孢子串成不分枝的链状,单个孢子球形,卵圆形,绿色。
根据各菌株的菌落特征和形态特征,按真菌分类鉴定手册和真菌分类学进行检索,初步认为B1、F1为木霉(Trichoderma),F2为青霉(Penicillium)。
2.4 复合菌剂在粪便堆积发酵中最佳生长条件的研究
以牛粪为研究对象,在实验室模拟条件下,采用L9(34)正交设计,研究物料水分、C/N、起始pH及接种量对复合微生物菌株生长的影响,结果见表5、表6。

表5 沼渣堆积发酵工艺条件的确定Table 5 Determination ofthe conditions ofcompostingfermentation ofbiogas residues
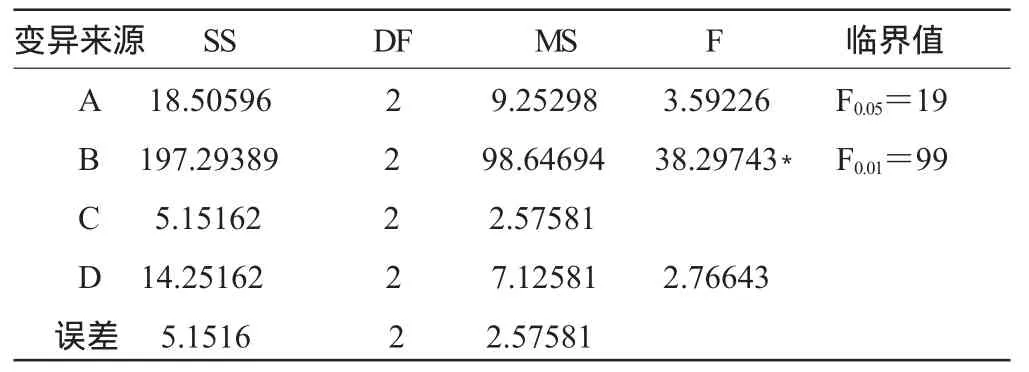
表6 沼渣堆积发酵工艺条件正交试验方差分析(完全随机模型)Table 6 Orthogonal analysis ofvariance on the conditions ofcomposting fermentation ofbiogas residues(completelyrandommodel)
从表5、表6可以看出,对微生物生长的影响各因素按极差大小主次顺序为:B>A>D>C,表明物料的C/N的比例对复合菌剂活菌数(生长)影响最大,物料pH影响最小。FB=38.29743>F0.05=19,达显著水平,表明B因素影响显著,所以对该因素应控制在最优水平上,A、D、C因素对复合菌剂活菌数(生长)对结果影响不大。综合以上分析,得到最佳堆积发酵工艺条件A2B3C1D2,即物料C/N为35、水分60%、接种量5%、pH=8.0。在此工艺条件下,适合菌剂中的微生物 生 长 繁 殖 ,活 菌 数 达 到 40.12×108cfu/g。
[1]蔡建成.堆肥工程与堆肥工厂[M].北京:机械工业出版社,1990.
[2]郭德宪,曹健,鲍宇茹.利用生物技术降解纤维素的研究进展[J].郑州工程学院学报,2001,2(3):82~86.
[3]刘克峰,刘悦秋,雷增普.几种微生物应用于猪粪堆肥中的研究[J].北京农学院学报,2001,16(2):36~41.
[4]赵永勋,张洪全,张跃华.微生物菌剂对有机废弃物发酵作用的研究[J].佳木斯大学学报(自然科学版),2001,19(2):183~186.
[5]杨朝晖,曾光明,蒋晓云,等.城市垃圾堆肥过程中的生物学问题[J].微生物学杂志,2005,25(3):57~61.

