鸭空肠液中全消化酶与主要消化酶体外总消化能力的比较研究
谢木林 赵 峰 张宏福 章世元
(1.扬州大学动物科学与技术学院,扬州 225009;2.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京 100193)
在家禽体外模拟消化过程的研究中,模拟消化液的制备依据与方法一直是该领域技术的核心[1]。由于动物体内消化液中酶的种类较多,而且在饲料底物水解程度的贡献上也相差较大,因此,探讨模拟消化液的制备方法首先需要弄清肠液中主要消化酶的总消化能力,以及其占肠液中所有消化酶总消化能力的权重。以 Boisen为代表的欧美学者在模拟肠液的制备上都是根据一定时间内饲料的水解率达到最大时所需要的最低胰液素(酶)量来确定[2-3]。该方法完全不以动物体内消化液中酶的活性为依据,在其操作规程中,模拟肠液的制备是将一定质量胰液素溶于缓冲液中配制,这导致了不同的实验室间在模拟消化液的酶活性上相差很大。我国学者张子仪等[4-6]在上世纪 80年代通过将猪小肠液冻干然后再加入去离子水还原的方法制备模拟猪肠液。该方法虽然保证了模拟肠液在酶的种类与组成上与体内一致,但不同批次的冻干粉剂在酶活上也有一定差异,仍存在模拟消化液组成难以重现的问题。近年来,本研究组提出了以鸭体内空肠液主要消化酶活性为基础参数,以分离纯化的试剂级淀粉酶、胰蛋白酶、糜蛋白酶、脂肪酶为酶源,根据这 4种消化酶活性相等的原则制备模拟消化液[7]。从设计思路看,该制备方案有望解决模拟消化技术中消化液制备的重现性问题。然而,在该设计方案中,4种主要消化酶的总消化能力占体内肠液所有酶总消化能力的比重是多少?其他一些未知酶是否可以忽略?如果此 4种主要消化酶的总消化能力所占的权重比较高,那么其他未知酶发生变化后对测试结果有多大干扰?弄清这些问题对于模拟消化技术研究中解决模拟消化液的重现性乃至酶的同源性问题都是非常关键的。为此,本研究通过比较鸭肠液中 4种主要消化酶的消化能力与体内肠液消化能力的差异、以及在其他未知酶(除 4种主要消化酶外的统称)不同水平的条件下对测试结果的影响,探讨鸭模拟肠液在消化酶组成上的适宜方案。
1 材料与方法
1.1 饲料原料与饲粮
选择 4种常用饲料原料(玉米、豆粕、棉粕、麸皮)和 4种鸭饲粮(表 1)。采用四分法取样后粉碎,过 40目筛,混合均匀后贮存于样品瓶中,-20℃保存备用。
1.2 鸭肠液的获取
选用健康、体重相近的 18周龄成年公北京鸭60只,在空肠中部安装套管,整个饲养过程均饲喂基础饲粮。术后第 31、33、35天的 09:30—10:30、13:30— 14:30、17:30—18:30用收集瓶在低温条件下(0~4℃)收集空肠食糜,摇匀后全部转入250 m L离心瓶中,于 4℃条件下 1 250×g离心10m in,取上清液,装于 1 000 m L样品瓶中,-20℃保存。共收集 3 000 m L肠液,待整个肠液收集试验结束后,将所有肠液混合均匀,经 200目尼龙滤布过滤后,分成 2份,1份分装到 6个250 m L的样品瓶中,为鸭内源肠液;1份经全自动蛋白质透析纯化系统(型号 PFS-1,自主研制)透析去杂质后,通过冷冻干燥机(LGJ-4,北京亚泰科隆仪器技术有限公司)冻干成粉剂,为鸭肠液干粉剂。
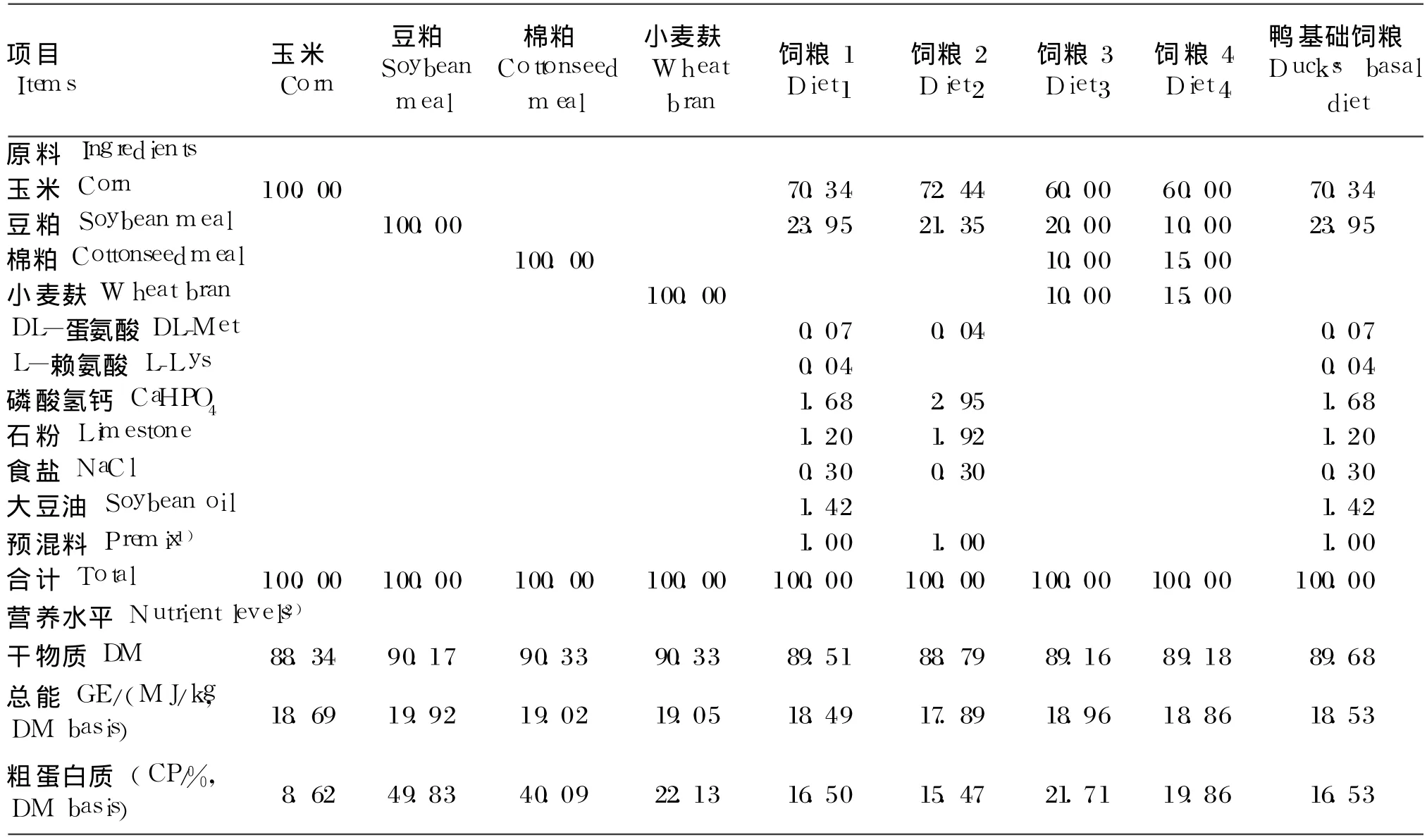
表 1 试验原料、试验饲粮、鸭基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of trial ingredients,trialdiets and ducks'basal diet(air-dry basis) %
1.3 试验设计
鸭内源肠液,酶的组成主要为 4种消化酶(淀粉酶、胰蛋白酶、糜蛋白酶、脂肪酶)和其他酶(除4种主要酶外的酶的统称,含量未知)。采用单因素完全随机设计,根据肠液酶组成设 3个处理,处理间 4种主要酶的活性一致。处理 1为鸭内源肠液,处理 2为鸭肠液干粉剂 +试剂酶,处理 3为试剂酶。每个处理设置 5个重复,每个重复 1根消化管。分别测定各处理下 4种饲料原料和 4种饲粮的干物质和能量消化率。各处理肠液的酶组成见表2。
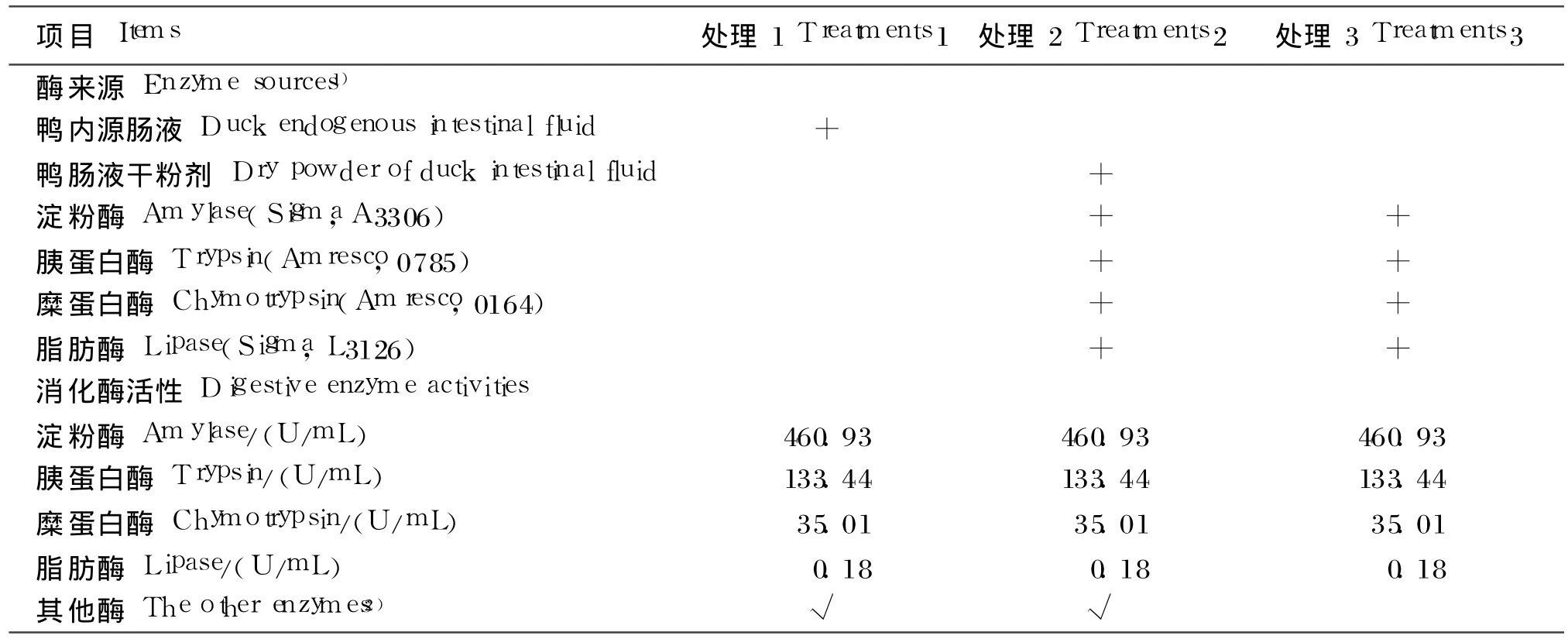
表 2 3种肠液酶组成及活性Tab le 2 Composition and activities of enzyme in the three intestinal fluid
1.4 模拟消化操作过程
称取一定量的样品(豆粕、棉籽粕和饲粮约2.000 0 g,玉米、小麦麸约 1.000 0 g,精确到0.000 2 g)于干净的 10 m L带塞玻璃管中;将透析袋(MD44-14,美国 V iskase公司,截留分子量为 14 000 kD)经脱盐脱硫处理后,洗净装入模拟消化器 (专利号:ZL200920105937.X);然后将称量好的样品无损失的转移到装有透析袋的模拟消化管中,再加入 20m L混匀的肠液;将消化管置于仿生消化系统(SDS-Ⅰ型)中,连接消化管路,点击控制软件的开始试验菜单,只选择小肠模拟消化阶段,设置模拟消化的温度为 42℃,混合强度为180 r/min,缓冲液流速 450 m L/min,小肠消化时间为 15 h,残留液排出时间 2 min,清洗液用量1 200 m L/次,清洗 4次;消化完毕后,取出消化管,将透析袋中未消化的残渣用去离子水小心完全地冲洗到已知绝干重的培养皿中,65℃烘干至无水痕后,再 105℃烘至绝干,称重。
1.5 测定方法
肠液中主要消化酶活性的测定方法如下:α-淀粉酶(EC.3.2.1.1)根据 Dahlqvist[8]方法以可溶性淀粉为底物测定活性;脂肪酶活性使用脂肪酶试剂盒(13258/64186/1,德国 Diasys)测定;胰蛋白酶根据 W irnt[9]方法以对甲苯磺酰 -L-精氨酸乙酯(TAME,T4626,Sigma)为底物进行活性测定;糜蛋白酶根据 W irnt[10]方法以苯甲酰 -L-酪氨酸乙酯(BTEE,B6125,Sigma)为底物进行活性测定。
干物质、能量测定均参照 AOAC[11],能量测定采用氧弹仪(WZT-1TB,长沙奔特仪器有限公司)。
1.6 数据计算与统计分析
模拟消化中饲料原料及饲粮的干物质与能量消化率按以下公式计算:


统计分析采用 SAS 9.0[12]的 MEANS模块对基本统计量进行分析,结果以平均值 ±标准差表示。采用 GLM模块对数据进行方差分析,以 Duncan氏法对不同处理组条件下同一原料和饲粮的干物质及能量消化率进行差异显著性检验。其中统计模型为:
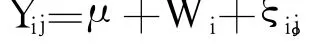
式中:Y为消化率,μ为总体平均数,W为干物质或能量消化率,ξ为随机误差项。
2 结 果
2.1 3种鸭肠液对 4种饲料原料的总消化能力
由表 3可知,对于玉米的消化,处理 1与处理2干物质消化率无显著性差异(P>0.05),且显著地高于处理 3(P<0.05);玉米能量消化率两两处理间均有显著性差异(P<0.05),处理 2>处理1>处理 3。对于豆粕的消化,干物质和能量消化率两两处理间均有显著性差异(P<0.05),处理2>处理 1>处理 3。对于棉粕的消化,处理 2干物质消化率显著高于处理 3(P<0.05),其他各组间差异不显著(P>0.05);处理 2的能量消化率均显著地高于其他处理(P<0.05)。对于小麦麸的消化,两两处理间均呈显著性差异(P<0.05),处理3>处理 2>处理 1。
在 2种模拟肠液处理下,4种饲料原料消化率占内源肠液消化率的权重上(即处理 2或处理 3占处理 1的比例),处理 2的 4种饲料原料的干物质平均消化率为处理 1的 101.76%,其中小麦麸相差最大,为 103.14%,玉米相差最小,为100.09%;4种饲料原料的能量平均消化率为处理1的102.22%,其中小麦麸相差最大,为103.52%,玉米相差最小,为 100.82%。处理 3的 4种饲料原料的干物质平均消化率为处理 1的 99.27%,其中小麦麸相差最大,为 110.85%,豆粕相差最小,为 89.38%;4种饲料原料的能量平均消化率为处理 1的 99.85%,其中小麦麸相差最大,为115.63%;豆粕相差最小,为 86.39%。
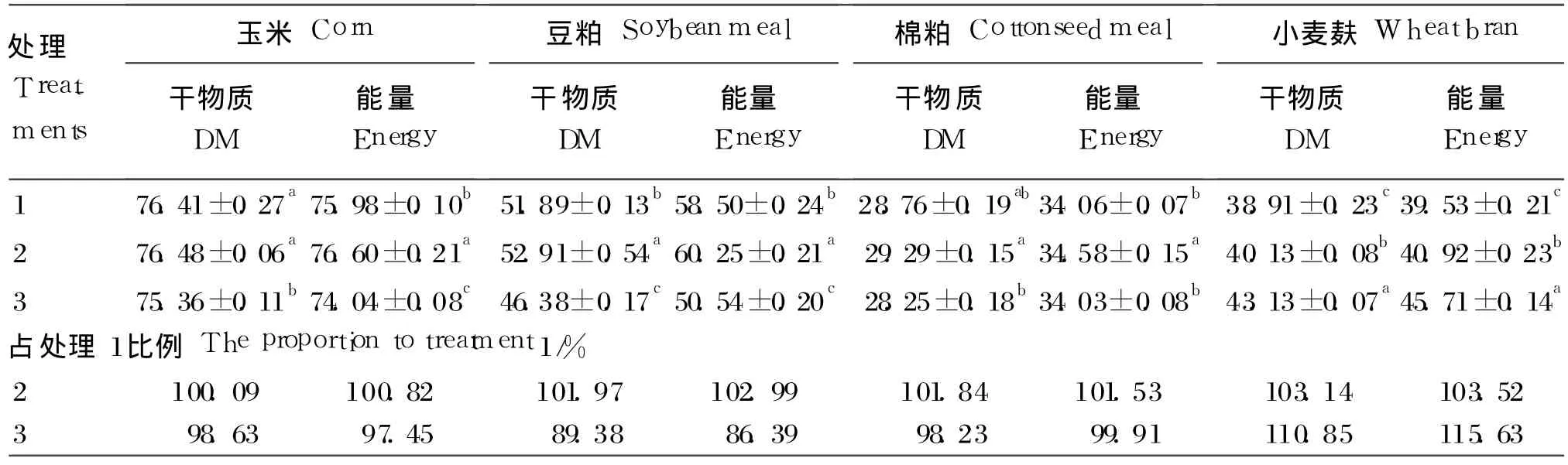
表 3 4种饲料原料在 3种体外肠液中的干物质、能量的消化率Table 3 The digestibility of drym atter and energy of the four feed ingredients in the three intestinal fluid in vitro%
2.2 3种鸭肠液对 4种饲粮的总消化能力
由表 4可知,4种饲粮的干物质消化率两两处理间均呈显著性差异(P<0.05),处理2>处理1>处理 3。处理 2和处理 1对饲粮 4的能量消化率无显著性差异(P>0.05),且都显著高于处理 3(P<0.05),其他 3种饲粮的能量消化率在两两处理间均呈显著性差异(P<0.05),变化与干物质消化率一致,也为:处理 2>处理 1>处理 3。
在 2种模拟肠液处理下,4种饲粮的消化率占内源肠液消化率的权重上(即处理 2或处理 3占处理 1的比例),处理 2对 4种饲粮的干物质平均消化率为处理 1的 101.52%,其中饲粮 3相差最大,为 101.75%,饲粮 4相差最小,为 101.33%;4种饲粮的能量平均消化率为处理 1的 101.28%,其中饲粮 1相差最大,为 102.54%,饲粮 4相差最小,为 100.24%。处理 3对 4种饲粮的干物质平均消化率为处理 1的 96.94%,其中饲粮 4相差最大,为 98.00%,饲粮 1相差最小,为 95.91%;4种饲粮的能量平均消化率为处理 1的 93.94%,其中饲粮 2相差最大,为 95.25%;饲粮 3相差最小,为93.23%。
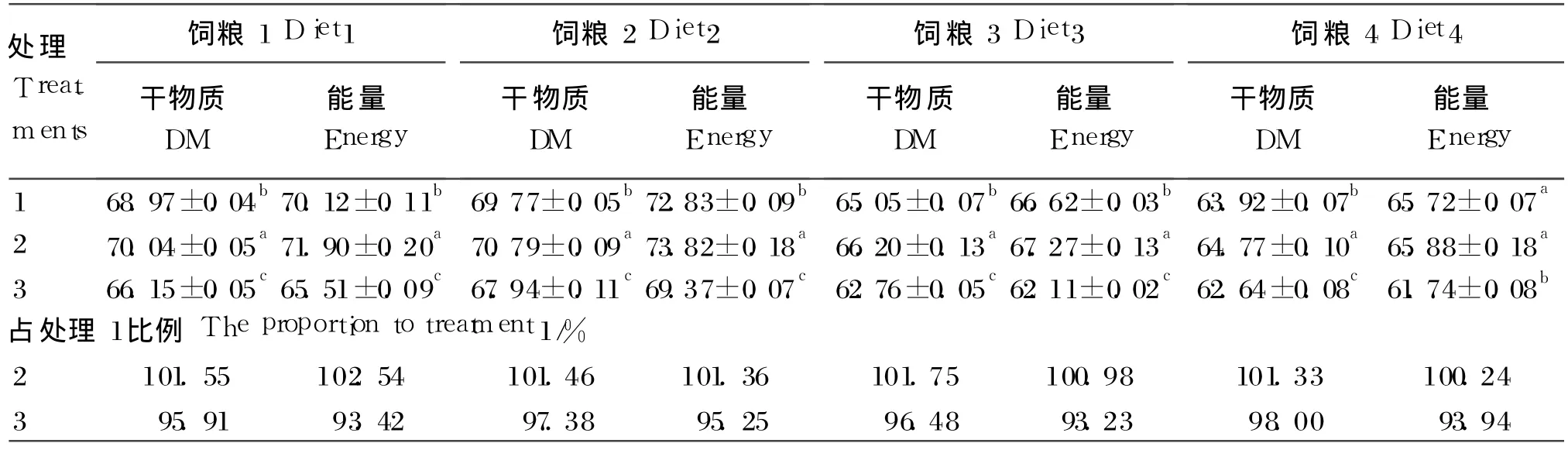
表 4 4种饲粮在 3种体外肠液中的干物质、能量的消化率Table 4 The digestibility of dry matter and energy of the four diets in the three intestinal fluid in vitro %
3 讨 论
3.1 肠液消化酶组成及与饲料养分消化的关系
食糜在小肠中消化所处的主要介质是肠液,其消化酶一部分来源于胰腺分泌的酶原经修饰活化后所形成的各种消化酶,另一部分来源于肠腺的分泌。目前可通过有效方法检测并了解其酶学基本特性的消化酶约 19种[13]。肠液中各种消化酶的组成比例仍鲜见报道,已知的是鸡胰腺中淀粉酶、胰蛋白酶、糜蛋白酶所占比例分别占胰液总蛋白含量的 28.9%、10.0%、20.0%[14]。由此可见,家禽肠道内这 4种消化酶是最为主要的消化酶。从分泌量和水解能力看,鸭空肠液中淀粉酶、胰蛋白酶、糜蛋白酶、脂肪酶的每小时分泌量分别为 7 235.74、1 780.43、811.43、20.30 U,可水解140 g淀粉、19.9 g蛋白质、0.3 g脂肪[15]。从常用饲粮的有机物组成看,淀粉、蛋白质和脂肪 3者含量的总和占有机物总量的 80%~90%或更多,因此,根据以上数据推算,鸭体内这 4种消化酶的分泌及水解活性完全可以水解饲料中绝大多数有机物。本试验条件下,以淀粉酶,胰蛋白酶,糜蛋白酶和脂肪酶组成的模拟消化液对 4种常用饲料原料、4种饲粮的干物质及能量的消化率与内源肠液的相应消化率都存在差异,部分差异达到显著性水平,这可能与本分析测试方法的重复性较高,重复内测定的变异远低于饲料或饲粮间的变异所致[16]。但从 4种消化酶的总消化能力占内源肠液所有酶总消化能力的权重看,饲料原料达到 86%以上,饲粮达到 93%以上。由此可见,基于本体外模拟消化条件下,4种主要消化酶的总消化能力为肠液中全消化酶总消化能力 86%以上,因此,严格控制肠液中 4种最主要消化酶的活性是保证每批模拟肠液总消化能力可保持相对一致的关键。
3.2 鸭模拟肠液制备方案的探讨
在模拟消化技术的研究中,模拟消化液的制备与模拟消化工具的标准化一直是该领域的核心,也是创新的关键点。长期以来,模拟消化液的制备依据与方法一直被学术界所忽视。目前国际上仍普遍采用丹麦学者 Boisen提出的以一定质量百分比浓度的猪胰液素溶液模拟家禽的小肠消化液[2-3]。以此为基础制备的模拟消化液既在酶的来源上与家禽内源酶不同源,也在活性上存在较大差异。为此,本研究组在成功建立了家禽肠道食糜的连续采集方法[14],可大量获得一定纯度的小肠混合酶的基础上,又按同源性与活性接近的原则提出了以鸭小肠液纯化酶粉剂为主体,通过调节 4种主要消化酶的活性与体内肠液的活性一致的原则制备鸭模拟小肠液。从本试验的结果看,4种主要消化酶的总消化能力已占体内肠液所有酶总消化能力 86.39%以上,其他未知酶所代表的水解生物学信息相对较少。由于鸭肠液干粉剂尚含有一部分未知酶,那么与内源肠液相比,未知酶的含量发生变化后对测试结果是否有较大干扰,是这种模拟小肠液制备方法是否可行的关键问题。在本试验中,以鸭肠液干粉剂 +试剂酶制备的模拟小肠液水解 4种饲料原料和 4种饲粮的消化能力为鸭内源肠液的 100.09%~103.52%。这表明,未知酶的水平对测试结果的干扰很少,平均值为1.72%,可以忽略不计。而且这种方法制备的模拟小肠液与鸭体内肠液的消化能力非常接近。
4 结 论
①在鸭空肠液中,淀粉酶,胰蛋白酶,糜蛋白酶和脂肪酶 4种主要酶的消化能力占肠液所有酶消化能力的比例 >86.39%,其中其他未知酶发生改变后对测试结果的干扰为 1.72%。
②以鸭肠液干粉剂为主体,采用试剂酶调节4种主要消化酶活性与内源肠液活性等同制备鸭模拟小肠液,是比较理想的制备方法。
[1] 胡光源.生长猪小肠仿生消化试剂设计依据的研究[D].硕士学位论文.北京:中国农业科学院,2010.
[2] BOISEN S,FERNHDEZ JA.Prediction of the total tract digestibility of energy in feedstuffs and pig diets by in vitro analyses[J].Animal Feed Science Technology,1997,68:277-286.
[3] BOISEN S.A new concept for p ractical feed evaluation system s[M].Aarhus:Aarhus University,2007.
[4] 张子仪,李小亭,张蔚云,等.猪的离体消化实验方法的研究,第四报:猪小肠液所含两种蛋白水解酶活的变异因数及其与离体消化率的关系分析[R]//中国农业科学院北京畜牧兽医研究所科学研究年报.北京:北京畜牧兽医研究所,1983:100-105.
[5] 张子仪,李小亭,张蔚云,等.猪的离体消化实验方法的研究,第八报:用不同工艺所得 PIF测出的离体消化率及其与常法消化率的比较[R]//中国农业科学院北京畜牧兽医研究所科学研究年报.北京:北京畜牧兽医研究所,1984a:122-130.
[6] 张子仪,张蔚云,李文英.猪的离体消化实验方法的研究,第十一报:不同加工条件及不同保存条件下PIF冻干粉效价的变化[R]//中国农业科学院北京畜牧兽医研究所科学研究年报.北京:北京畜牧兽医研究所,1984:144-148.
[7] 郑卫宽.用仿生消化仪测定棉粕真代谢能值的研究[D].硕士学位论文.北京:中国农业科学院,2009.
[8] DAHLQV IST A.A method for the determ ination of amy lase inintestinal content[J].Scandinavian Journal of Clinical and Laboratory Investigation,1962,14:145-151.
[9] W IRNT R.Ty rpsin,measurement with Nα-p-toluenesulfony-L-argininemethyl ester as substrate[M]//BERGMEYER H U.Methods of enzymatic analysis.W einheinm:Verlag Chem ie,1974:1021-1024.
[10] W IRNT R.Chymotrypsin,measurements with N-benzoy l-L-tyrosin methy l ester as substrate[M]//BERGMEYER H U.M ethods of enzymatic analysis.W einheinm:Verlag Chem ie,1974:1009-1012.
[11] Association of O fficial Analy tical Chem ists.Official methods of analysis[M].W ashington,D.C.:AOAC International,2001.
[12] SAS Institute.SAS/STAT user's guide:statistics[CP/CD].Cary,N.C.:SAS Institute Inc.,2003.
[13] MCDONALD P,EDWARDS R A,GREENHALGH J F D,et al.Animal nutrition[M].6th ed.Essex:Pearson Education Linited,2002:165-167.
[14] PUBOLSM H.Ratio of enzymes in the chick pancreas[J].Pou ltry Science,1991,70:337-342.
[15] 赵峰.用酶法评定鸭代谢能的方法学研究[D].博士学位论文.北京:中国农业科学院,2006.
[16] 李辉.单胃动物仿生消化系统(SDS-Ⅰ)测定鸭饲料代谢能值的精度、变异因素及可加性研究[D].硕士学位论文.安徽:安徽农业大学,2010.

