环孢素对大鼠牙龈上皮细胞凋亡及Bcl-2、Caspase-3蛋白表达的影响
刘培红 马肃 陈力
(1.哈尔滨医科大学口腔医院 牙周科;2.哈尔滨医科大学第一临床医学院 科研科,哈尔滨 150001)
环孢素对大鼠牙龈上皮细胞凋亡及Bcl-2、Caspase-3蛋白表达的影响
刘培红1马肃1陈力2
(1.哈尔滨医科大学口腔医院 牙周科;2.哈尔滨医科大学第一临床医学院 科研科,哈尔滨 150001)
目的 观察环孢素(CsP)对大鼠牙龈上皮细胞凋亡活动、凋亡相关蛋白Bcl-2和Caspase-3表达的影响,探讨CsP致牙龈上皮增厚的可能机制。方法 SPF级7周龄雄性Wistar大鼠80只,随机分为实验组和对照组,每组又分为10、20、30、40 d亚组,实验组胃饲含CsP鲜牛奶,对照组胃饲等量鲜牛奶。经心灌注4%多聚甲醛,固定取材,制作下颌第一磨牙颊舌向石蜡切片,原位缺口末端标记(TUNEL)法检测牙龈上皮细胞原位凋亡,免疫组化PV两步法检测Bcl-2和Caspase-3蛋白的表达。利用图像分析系统计算牙龈上皮细胞凋亡率和Caspase-3蛋白阳性细胞表达率,并测量Bcl-2蛋白平均灰度,行完全随机分组两因素析因设计方差分析。结果 实验组大鼠牙龈上皮内细胞凋亡率和Caspase-3蛋白阳性细胞表达率下调,与对照组有显著差异(P<0.05)。实验组大鼠牙龈上皮内Bcl-2蛋白平均灰度上调,与对照组有显著差异(P<0.05)。结论 环孢素导致牙龈上皮增厚可能与干扰线粒体凋亡途径、抑制细胞凋亡有关。
环孢素; 药物性牙龈增生; 细胞凋亡
免疫抑制剂环孢素(Ciclosporin,CsP)可诱导药物性牙龈增生,影响牙周组织健康和美观,但CsP诱导牙龈增生的发病机制尚不十分清楚,尤其是CsP对牙龈上皮组织的影响,结论存在分歧[1]。本实验以大鼠为实验对象,定量分析CsP对大鼠牙龈上皮细胞凋亡活动、凋亡相关蛋白Bcl-2和Caspase-3表达的影响,旨在探讨CsP致大鼠牙龈上皮增厚可能的发病机制。
1 材料和方法
1.1 药物、试剂和仪器
CsP(商品名:新山地明,瑞士诺华制药有限公司)。兔抗鼠Bcl-2、Caspase-3多克隆抗体(武汉博士德有限公司);原位缺口末端标记(TdT-mediated dUT nick endlabeling,TUNEL)法检测试剂盒(美国罗氏公司);PV两步法免疫组织化学检测试剂盒、DAB显色试剂盒(北京中杉金桥生物技术有限公司)。Leica DM2500光学显微镜(德国莱卡公司),Motic Med 6.0数码医学图像分析系统(北京麦克奥迪图像技术有限公司)。
1.2 动物选择、分组和建模
选取由哈尔滨兽医研究所实验动物中心提供的SPF级7周龄雄性Wistar大鼠80只,随机分为实验组和对照组,每组又分为10、20、30、40 d亚组,隔离器饲养,正常食水。实验组胃饲质量浓度为5mg·mL-1的CsP鲜牛奶混浊液,CsP摄入量为每天30mg·kg-1,对照组胃饲不含CsP的等量鲜牛奶。
1.3 取材、TUNEL法及免疫组织化学染色
按实验设计取材、固定、脱钙后,以下颌第一磨牙近中面为包埋面常规方法制作下颌磨牙区牙周牙体联合组织蜡块,4μm厚颊舌向连续切片。选择下颌第一磨牙近远中面中点处组织切片5张,1张行TUNEL法检测牙龈上皮凋亡细胞,2张行Bcl-2和2张行Caspase-3蛋白的PV两步法免疫组织化学染色,操作按试剂盒说明书进行。
1.4 结果判定
TUNEL阳性表达呈棕黄色颗粒,定位于胞核内;Caspase-3蛋白阳性表达呈棕黄色颗粒,定位于胞核内和胞浆内;Bcl-2蛋白阳性表达呈棕褐色颗粒,定位于胞浆内和胞核表面。每张TUNEL和Caspase-3蛋白阳性切片在光镜下(×400倍)随机选取上皮内5个阳性表达最多的视野,每个高倍视野计数100个细胞,取平均值记录凋亡指数(apoptotic index,API)和Caspase-3蛋白阳性细胞表达率。每张Bcl-2蛋白阳性切片在光镜下(×630倍)随机选取上皮内5个阳性表达最多的视野,测定Bcl-2蛋白的平均灰度,取其平均值。
1.5 统计学分析
采用SPSS 13.0统计分析软件包对各组数值进行完全随机分组两因素析因设计资料的方差分析,P< 0.05表示差异有统计学意义。
2 结果
2.1 TUNEL检测结果
TUNEL阳性细胞定位于口腔龈上皮、沟内上皮和结合上皮。实验组大鼠牙龈上皮内API在颊侧和舌侧均显著小于对照组,各实验组间API在颊侧和舌侧均无明显差异(表1)。

表1 颊侧和舌侧数据析因统计分析结果P值Tab 1 P value of bucco-lingual data by analysis of variance of factorial design
2.2 Caspase-3蛋白表达结果
Caspase-3阳性表达定位于口腔龈上皮、沟内上皮和结合上皮,主要表达于颗粒细胞层的细胞核内,少量表达于细胞浆中(图1、2)。实验组大鼠牙龈上皮内Caspase-3蛋白阳性细胞表达率在颊侧和舌侧均显著小于对照组,各实验组间Caspase-3蛋白阳性细胞表达率在颊侧和舌侧均无明显差异(表1)。

图1 对照组大鼠牙龈上皮内Caspase-3蛋白的表达 PV ×400Fig 1 Expression of Caspase-3 in gingival epithelium of the control group PV ×400
2.3 Bcl-2蛋白表达结果
Bcl-2蛋白阳性表达定位于口腔龈上皮棘细胞层胞浆内和胞核表面,主要集中于附着龈近膜龈联合处,颊侧多于舌侧,上皮钉突处密集表达(图3、4)。实验组大鼠牙龈上皮内Bcl-2蛋白的平均灰度在颊侧显著大于对照组,在舌侧无明显差异,各实验组间Bcl-2蛋白的平均灰度在颊侧和舌侧均无明显差异(表1)。
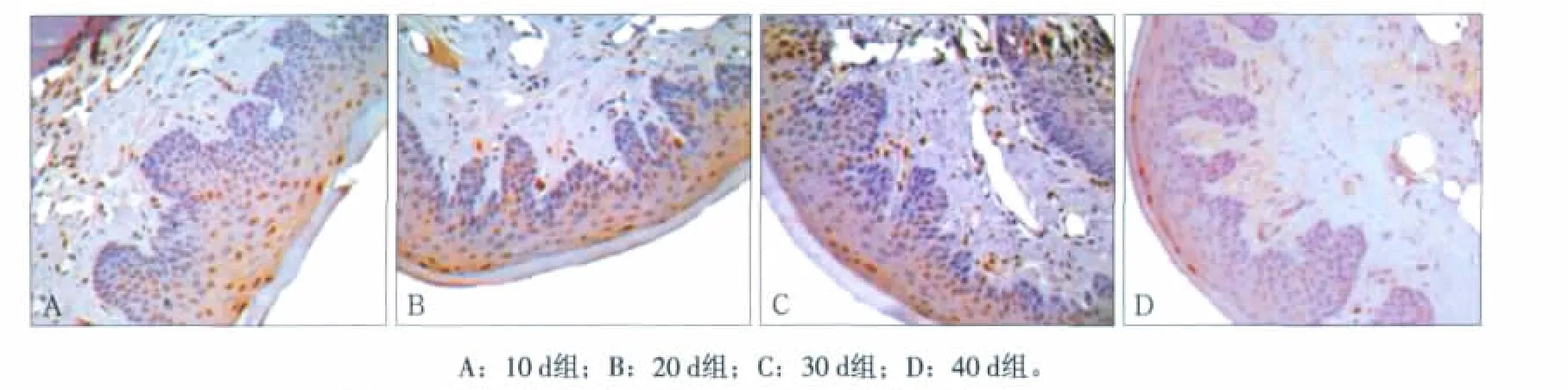
图2 实验组大鼠牙龈上皮内Caspase-3蛋白的表达 PV ×400Fig 2 Expression of Caspase-3 in gingival epithelium of the experimental group PV ×400

图3 对照组大鼠牙龈上皮内Bcl-2蛋白的表达 PV ×630Fig 3 Expression of Bcl-2 in gingival epithelium of the control group PV ×630
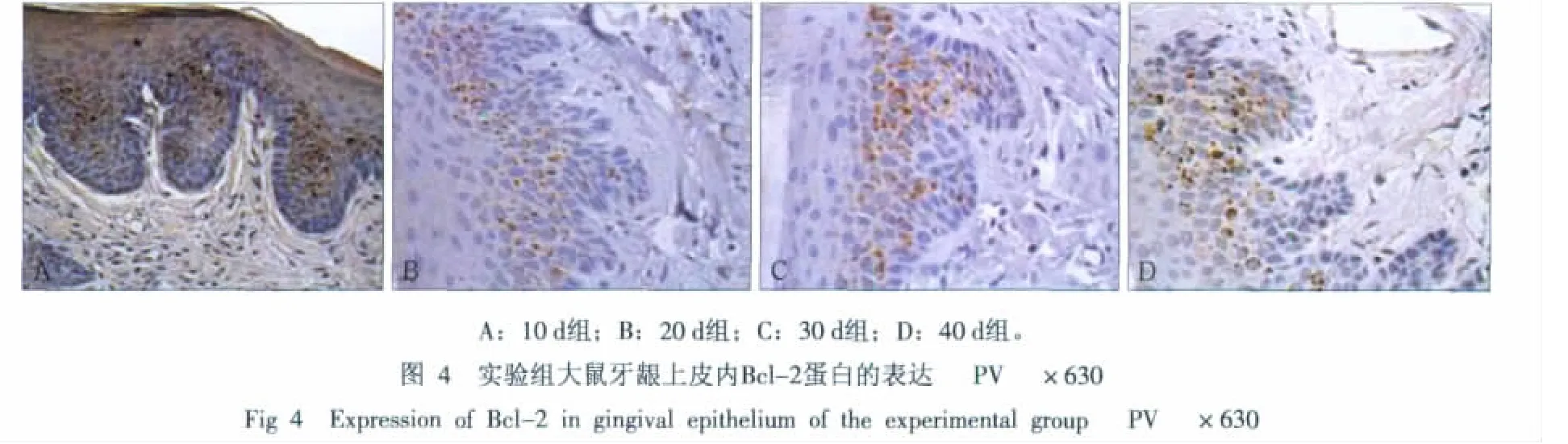
3 讨论
免疫抑制剂、钙通道阻滞剂和抗癫痫药物可导致药物性牙龈增生,其中免疫抑制剂CsP导致牙龈增生的发病率高达30%~50%[1],严重影响牙周组织健康和美观。但是药物性牙龈增生的发病机制尚不清楚,近年来,关于CsP导致牙龈上皮增厚的现象逐渐成为关注热点[2]。
组织增生包括细胞增殖增加和/或细胞凋亡减少,牙龈上皮增厚的发病机理也应如此。Shimizu等[3]以大鼠为实验对象,研究认为硝苯地平诱导的牙龈上皮增生不是角化细胞增殖增加,而是通过细胞凋亡减少而使细胞周期延长所致,他们特别指出细胞周期延长在肉眼可见的增生发生前就已经发生了。相似的,Niimi等[4]指出服用环孢霉素A的肾移植患者牙龈增生不是由于角化细胞增殖,而是由于细胞寿命延长。近来,Buduneli等[5]测定环孢霉素A诱导的牙龈增生细胞的分裂率和凋亡率,指出凋亡减少可能比细胞分裂增加在环孢霉素A诱导的牙龈增生的发病机制中起着更突出的作用。他们的结果暗示牙龈上皮增生不是由于角化细胞增殖率增加,而是由于角化细胞的寿命增加或是经历凋亡细胞的能力改变。本课题组假设这也是引起CsP导致牙龈上皮增厚的生物学基础,故将本实验聚焦于CsP对大鼠牙龈上皮细胞凋亡通路影响的研究。
细胞凋亡是Kerr等于1972年首次提出的一个形态学概念,是指与细胞坏死不同的受基因控制的有序的细胞死亡形式[6],其启动受控于多种因素[7-9]。Bcl-2是膜的整合蛋白,存在于线粒体膜、内质网膜以及核膜上,但主要定位于线粒体膜,其生物学功能为抑制线粒体内促凋亡因子的释放,在线粒体参与的凋亡途径中起调控作用,为重要的细胞凋亡抑制蛋白,常被作为细胞凋亡早期和中期的检测指标[7]。Caspase-3是细胞内的半胱氨酸蛋白酶,是引起细胞凋亡的最终关键执行酶,一旦被细胞凋亡的信号途径激活,能直接降解细胞内的结构蛋白和功能蛋白,使细胞凋亡进入不可逆阶段,常被作为细胞凋亡中期和晚期的检测指标[8]。TUNEL法是运用分子生物学原理结合形态学特征检测细胞内DNA断裂后形成的原位凋亡细胞技术,是细胞凋亡晚期的经典检测方法[9]。
本实验免疫组织化学染色结果显示:与对照组相比较,实验组大鼠牙龈上皮内Bcl-2和Caspase-3蛋白阳性表达范围和表达密度发生明显变化,这种变化具有部位特异性,在颊侧附着龈近膜龈联合处Bcl-2蛋白阳性表达明显增加,Caspase-3蛋白阳性表达明显减少。实验组大鼠牙龈上皮钉突少或无的部位,棘细胞层厚度一般无变化,而颗粒细胞层略增厚,此处Bcl-2蛋白阳性表达少或无,Caspase-3蛋白阳性表达分布不均匀,但比对照组略减少。而在牙龈上皮钉突伸长增宽部位,除颗粒细胞层增厚以外,往往伴有棘细胞层明显增厚现象,这与Wondimu等[10]和Bulut等[11]研究发现相似。此处Bcl-2蛋白阳性表达明显增多,上方颗粒细胞层中Caspase-3阳性表达明显减少。
本实验统计学结果同样表明:与对照组相比较,实验组大鼠牙龈上皮内凋亡相关蛋白Bcl-2蛋白的表达上调,Caspase-3蛋白的表达和细胞凋亡指数下调,各组数值在实验组和对照组间均有显著差异,且颊侧较舌侧差异更为明显,这与本课题组前期实验结果相同[12]。推测:CsP可以通过抑制牙龈上皮细胞凋亡活动而导致大鼠牙龈上皮增厚,并且抑制凋亡的机制可能存在部位差异。CsP可能通过抑制牙龈上皮钉突处Bcl-2蛋白的表达而抑制线粒体凋亡途径,从而使该处牙龈上皮增厚,而牙龈上皮其他部位增厚可能由于启动其他信号而导致Caspase-3蛋白表达发生变化而抑制凋亡。但是CsP对大鼠牙龈上皮部位差异性影响的真正机制尚需深入研究。
[1] 孟焕新.牙周病学[M].3版.北京:人民卫生出版社,2008:145. MENG Huan-xin.Periodontology[M].3rd ed.Beijing:People’s Medical Publishing House,2008:145.
[2] 刘培红,马肃.环孢素诱导牙龈上皮细胞增生的机制[J].国际口腔医学杂志,2009,36(1):81-83.
LIU Pei-hong,MA Su.Pathogenesis of Ciclosporin-induced gingival epithelial hyperplasia[J].Int J Stomatol,2009,36(1):81-83.
[3] Shimizu Y,Kataoka M,Seto H,et al.Nifedipine induces gingival epithelial hyperplasia in rats through inhibition of apoptosis[J].J Periodontol,2002,73(8):861-867.
[4] Niimi A,Tohnai I,Kaneda T,et al.Immunohistochemical analysis of effect of cyclosporin A on gingival epithelium[J].JOral Pathol Med,1990,19(9):397-403.
[5] Buduneli N,Buduneli E,Cinar S,et al.Immunohistochemical evaluation of ki-67 expression and apoptosis in cyclosporin A-induced gingival overgrowth[J].JPeriodontol,2007,78(2):282-289.
[6] Kerr JF,Wyllie AH,Currie AR.Apoptosis:A basic biological phenomenon with wide-ranging implications in tissue kinetics[J]. Br J Cancer,1972,26(4):239-257.
[7] Adams JM,Cory S.The Bcl-2 protein family:Arbiters of cell survival[J].Science,1998,281(5381):1322-1326.
[8] Budihardjo I,Oliver H,Lutter M,et al.Biochemical pathways of caspase activation during apoptosis[J].Annu Rev Cell Dev Biol, 1999,15:269-290.
[9] 詹启敏.分子肿瘤学[M].北京:人民卫生出版社,2005:403-425.
ZHAN Qi-min.Molecular oncology[M].Beijing:People’s Medical Publishing House,2005:403-425.
[10] Wondimu B,Reinholt FP,Modeer T.Sterologic study of cyclosporin A-induced gingival overgrowth in renal transplant patient[J]. Eur J Oral Sci,1995,103(4):199-206.
[11] Bulut S,Uslu H,Ozdemir BH,et al.Analysis of proliferative activity in oral gingival epithelium in immunosuppressive medication induced gingival overgrowth[J].Head Face Med,2006,2:13.
[12]刘培红,马肃,刘薇婷.环孢素对大鼠牙龈组织形态影响的定量分析[J].华西口腔医学杂志,2009,27(6):599-602.
LIU Pei-hong,MA Su,LIU Wei-ting.Quantitative analysis the effect of Ciclosporin on gingival tissue modality of rats[J].West China J Stomatol,2009,27(6):599-602.
(本文编辑 汤亚玲)
Apoptosis and expression of Bcl-2 and Caspase-3 in Ciclosporin-induced gingival overgrow th of rats
LIU Pei-hong1,MA Su1,CHEN Li2.(1.Dept.of Periodontology,College of Stomatology,Harbin Medical University,Harbin150001,China;2.Dept.of Scientific Research,The First Clinical College of Harbin Medical University,Harbin150001,China)
ObjectiveTo observe the effect of Ciclosporin(CsP)on apoptosis and expression of the associated protein Bcl-2,Caspase-3 in gingival epithelium of rats in order to approach the mechanism of CsP-induced gingival epithelium overgrowth.MethodsEighty SPF grade male 7-week-old Wistar rats were random ly divided into experimental group and control group,and each group was divided into 4 subgroups according to the duration of treatment(10, 20,30 and 40 days).The experimental objects were given fresh milk including CsP intragastrically and the control ones were given only fresh milk.After perfusion of 4%paraform for internal fixation,the specimens’bucco-lingual paraffin sections at lower first molar were made.Apoptosis was detected using TdT-mediated dUT nick end labeling(TUNEL)and the expression of Bcl-2 and Caspase-3 using immunohistochemisty of PV.The apoptotic index,positive cell rate of Caspase-3 and average gray scale of Bcl-2 wasmeasured with an image analysis system.Data were analyzed by two-way analysis of variance of factorial design.Results The apoptosis index and positive cell rate of Caspase-3 were downregulated in the experimental group,and were significant difference from the control group(P<0.05).The average gray scale of Bcl-2 was up-regulated in the experimental group,and was significant difference from the control group(P<0.05). Conclusion CsP-induced gingival epithelial overgrowth is likely to associated with interference to the path of mitochondrial apoptosis and inhibition apoptosis.
Ciclosporin; drug-induced gingival overgrowth; cell apoptosis
R 781.3
A
10.3969/j.issn.1000-1182.2011.03.023
1000-1182(2011)03-0310-04
2010-10-27;
2011-02-15
黑龙江省卫生厅科研基金资助项目(2006-009);哈尔滨市科技局优秀学科带头人研究专项基金资助项目(2009RFXXS214)
刘培红(1976—),女,黑龙江人,主治医师,硕士
马肃,Tel:0451-85553988

