侧孢芽孢杆菌2-Q-9菌株外泌抗菌肽的纯化与鉴定
陈武,彭曙光,周清明,黎定军,罗宽
(1.湖南农业大学 a.作物学博士后流动站;b.生物安全科学技术学院,湖南 长沙410128;2.湖南省烟草公司 烟叶处,湖南 长沙410007; 3.中国烟草中南农业试验站,湖南 长沙410128;4.湖南广播电视大学,湖南 长沙 410004)
针对青枯病菌的生物防治主要包括利用无致病力青枯菌预先接种植物和利用芽孢杆菌、假单胞杆菌、链霉菌等与青枯病菌竞争生长位点或抑制青枯病菌的生长。芽孢杆菌具有很强的抗逆和抗菌、防病能力,可分泌种类丰富的抗菌肽、抗生素或抗菌蛋白[1-2]。依据合成途径的不同,可将抗菌肽和抗菌蛋白分为核糖体合成和非核糖体合成两类[3-6],已有一些抗菌肽或抗菌蛋白在农业和食品工业中被广泛应用[7]。
从湖南省茄科作物青枯病发病较重地区的土壤中分离得到1株侧孢芽孢杆菌(Bacillus laterospours)菌株2-Q-9,平板拮抗试验证明,2-Q-9对青枯病菌的3个生理小种均有强烈的抑制作用[8];2005年在湖南省3个烟草青枯病高发区的大田试验结果表明,它对烟草青枯病的防治效果达65%。菌株2-Q-9的发酵培养条件得到优化[9],初步分析了抑菌物质的理化性质[8],研究了它对烟草幼苗根系活力的影响[10]。笔者通过乙醇沉淀、高效液相色谱层析、Tricine-SDS-PAGE凝胶电泳分析及质谱测序等方法,纯化并鉴定了2-Q-9外泌抗菌肽BL2Q9。
1 材料与方法
1.1 材 料
侧孢芽孢杆菌菌株 2-Q-9为湖南农业大学生物安全科学技术学院植物病理研究室筛选保存;青枯病菌菌株PO41为中国农业科学院蔬菜花卉研究所冯兰香研究员惠赠。拮抗菌和青枯病菌菌株的培养及平皿拮抗试验均参照文献[8]方法进行。
1.2 方 法
1.2.1 拮抗菌外泌蛋白质组粗提液的制备
挑取在NB固体培养基划线活化的2-Q-9单菌落,接种于含40 mL NB液体培养基的250 mL 三角瓶中过夜培养.第2天分别取10 mL新鲜培养的菌液接种于2个含 400 mL NB液体培养基的1 L三角瓶中,250 r/min、28 ℃、24 h后离心取上清液。以下操作若非特别注明,均在4 ℃下进行。
1份上清液中加入预冷至0 ℃的无水乙醇至终体积分数为75%,磁力搅拌子缓慢搅拌10 min后,静置40 min。收集所有溶液于13 000 r/m离心10 min,弃上清;沉淀用2 mL 70%乙醇漂洗,再在13 000 r/m离心10 min,吸干上清,待乙醇完全挥发后,用2 mL pH 8.0 的20 m mol/L Tris-HCl溶液溶解,得外泌蛋白粗提溶液,-20 ℃短期保存或真空冷冻干燥后,置-80 ℃长期保存。
另1份上清液中加入硫酸铵直至饱和后静置2 h,其余操作同上。
1) 阴离子交换柱处理。先用50 mmol/L pH8.0的Tris-HCl溶液平衡阴离子交换柱至少5倍柱床体积,当紫外吸收值为0时,取1 mL经乙醇沉淀的蛋白质组粗提液上柱,分别收集各穿透峰;当紫外吸收值恢复到0时用KCl溶液梯度洗脱,KCl梯度区间为0~2 mol/L,梯度为10%。分别收集各浓度梯度下的洗脱峰,取40 μL与青枯病菌拮抗培养,另各取适量穿透峰和洗脱峰经脱盐柱脱盐后, 用SDS- PAGE凝胶电泳检测。
2) 阳离子交换柱处理。用20 mmol/L磷酸缓冲液平衡阳离子交换柱至紫外吸收值为0时待用。将有抑菌活性的穿透峰经脱盐柱脱盐后上已预平衡的阳离子交换柱,每次上样量为1 mL。用KCl梯度洗脱,梯度区间为0~1 mol/L,梯度为10%。收集洗脱峰和穿透峰凝胶电泳检测,同时进行平板拮抗试验。
1.2.2 抗菌肽的分离纯化
抗菌肽的分离纯化使用Amersham Biosciences公司的AKTATMFPLCTM[Monitor UPC-900;Pump P-920;Frac-900]系统。
1.2.3 SDS-PAGE电泳分析
采用常规凝胶电泳分析 2-Q-9的外泌蛋白质组(乙醇粗提液);小分子量多肽的电泳分析使用Tricine-SDS-PAGE[11]。
1.2.4 等电点测定
使用Pharmacia公司pH为9.0~1.0的两性电解质测定抗菌肽等电点。凝胶配制参照文献[12]。
1.2.5 抗菌肽N端Edman降解测序和串联质谱测序
抗菌肽Tricine-SDS-PAGE电泳后,用Bio-Rad半干转膜仪将蛋白条带转至 Bio-Rad测序专用PVDF膜上,送中国军事医学科学院生物医学分析中心测序。
采用对小分子质量蛋白(肽)分辨率更高的Tricine-SDS-PAGE凝胶电泳分离抗菌肽,切取目的条带送北京市生命科学研究所进行串联质谱测序。所得谱图用MASCOT“MS/MS Ion Search”模式在数据库NCBInr内搜索。
2 结果与分析
2.1 拮抗菌外泌抗菌肽抑菌活性
用硫酸铵沉淀的方法,得到拮抗菌外泌蛋白质组粗提液(图 1-1)及上清(图 1-2),分别与青枯病菌拮抗培养,均未观察到抑菌圈。这说明硫酸铵可能破坏了外泌抗菌肽的抑菌活性。乙醇沉淀的蛋白质组粗提液经50 mmol/L Tris-HCl缓冲液重悬后表现出强烈的抑菌活性(图1-3),而上清液无抑菌活性(图 1-4),这说明外泌抗菌肽在 75%的乙醇溶液中被完全沉淀,它的抑菌活性未受到破坏。

图1 两种沉淀方法对抗菌肽活性的影响Fig. 1 Pattern of activity of antibiotic peptide precipitated by (NH4)2SO4 and ethanol
2.2 2-Q-9外泌抗菌肽的相对分子质量
分别收集经过阴离子交换柱的穿透峰和不同浓度KCl洗脱的洗脱峰与青枯病菌平板拮抗培养,发现抑菌活性物质存在于穿透峰,未被阴离子柱吸附,说明该抑菌物质在pH为8.0时带正电荷或不带电荷,其等电点高于或等于8.0。将收集的穿透峰再过阳离子交换柱,在KCl为0.20~0.29 mol/L出现1个洗脱峰,将洗脱峰与青枯病菌拮抗培养,表现出明显抑菌效果。抗菌肽经脱盐柱脱盐并冷冻干燥后用Tricine-SDS-PAGE凝胶电泳分析其组分及相对分子质量,结果表明,该洗脱峰中只含单一的肽,其相对分子质量约为7 800。将该抗菌肽命名为BL2Q9。
BL2Q9在变性凝胶Tricine-SDS-PAGE上为2条带,但在非变性醋酸-PAGE凝胶上为单一条带,推测该抗菌肽可能是由2个亚基组成的二聚体,当SDS存在时抗菌肽变性,解离成2个小肽(图2)。
2.3 抗菌肽BL2Q9的电荷属性
阴离子交换色谱层析时,抗菌肽未能被经pH8.0 的 50 mmol/L Tris-HCl平衡的阴离子柱吸附;在之前的试验中发现,抗菌肽在pH 分别为9.0、10.0和11.1时性质最稳定,对青枯病菌的抑制效果最好[8]。据此推测,抗菌肽的等电点高于8.0,因此选用pH为9.0~11.0的等电聚焦凝胶检测抗菌肽的等电点,结果表明,其等电点为10.2。根据以上结论,推测BL2Q9在生理pH 条件下带正电荷,结合到携带大量负电荷的青枯菌的细胞膜上,形成孔洞或破坏细胞膜的完整性,使细胞内含物外渗,导致青枯病菌菌体死亡,Brodgen总结了这类抗菌肽详细的作用机理[4]。

图2 抗菌肽BL2Q9的凝胶电泳结果Fig. 2 Gel patterns of aantibiotic peptide BL2Q9
2.4 N端Edman降解测序结果
对抗菌肽进行N端Edman降解测序,发现抗菌肽N端封闭,尝试对其进行去封闭化处理,但未获成功。外泌蛋白/肽的末端封闭是生物在进化过程中形成的一种自我保护机制,可以避免外泌蛋白的快速降解。外泌抗菌肽或蛋白N末端修饰的机制非常复杂,已发现200多种可能的末端修饰方式[13]。由于无法准确地判断抗菌肽BL2Q9的N端封闭类型,转而采用串联质谱(MS/MS)分析抗菌肽的氨基酸序列(表 1)。MS/MS 测序结果表明,BL2Q9与pilQ 的前体蛋白及转录抑制蛋白CodY的部分序列相同,Mascot程序给出的分值分别为59和58,与其他 3个蛋白的相似性稍低,分值分别为 57、54和51。对5个匹配氨基酸序列进行分析,发现性质为极性正电荷的氨基酸(K,R和H)明显多于极性负电荷的(D和 E),肽链的整体电荷属性为正电荷,这也与前期的试验结果及预测相符。
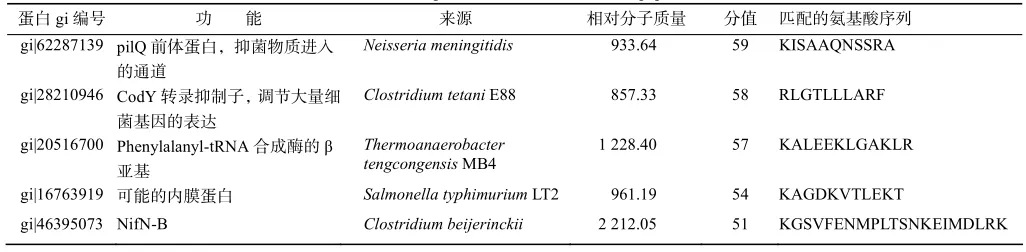
表1 抗菌肽的串联质谱测序Table 1 MS/MS sequence results of antimicrobial peptide BL2Q9
3 讨 论
芽孢杆菌能产生种类丰富的包括抗生素和抗菌肽在内的抗菌物质[14]。抗生素的作用机理主要是破坏代谢过程,其作用靶标多为代谢过程中的酶,容易诱导选择性抗性的产生[15];抗菌肽的主要作用机理是破坏靶标生物的细胞膜,不易产生诱导性抗性[16-17],因而抗菌肽具有更好的开发与利用前景。目前这些多肽或其制剂已被广泛应用于抗真菌、抗病毒、抗阿米巴细胞和抗支原体等生物制药及临床应用[18-19]。通过分离纯化芽孢杆菌的发酵产物,得到了一些拮抗植物病原菌的抗菌蛋白和低分子质量的抗菌多肽,并进行了一些氨基酸序列测定,在此基础上,一些抗菌蛋白或抗菌肽的编码基因已被克隆,为作物抗病基因工程提供了有潜在应用价值的基因资源[20-21]。
笔者发现经乙醇沉淀的 BL2Q9的抑菌活性未受影响,但硫酸铵沉淀的抗菌肽的抑菌活性几乎丧失,推测可能是硫酸铵中痕量的金属离子与BL2Q9互作,破坏了其抑菌能力,或者是因为高浓度的硫酸铵破坏了 BL2Q9的构象。对于微生物分泌至体外的抗菌肽,可以尝试有机溶剂沉淀、硫酸铵沉淀和等电点沉淀等,以选择沉淀效率高、活性损失少的方法。
分离的抗菌肽先后经阴离子和阳离子亲和柱纯化后,利用凝胶电泳鉴定其相对分子质量为7 800,利用等电聚焦电泳确定BL2Q9等电点为10.2. 串联质谱(MS/MS)测序结果表明,肽链中性质为极性正电荷的氨基酸明显多于极性负电荷的,肽链的整体电荷属性为正电荷。与数据库中的蛋白质比对结果表明,BL2Q9与已知抗菌肽的序列相似性较低,可能为一种新的抗菌肽。目前已经报道的被分离鉴定的抗菌肽有1 628种,通过对已知抗菌肽的比对分析(http://aps.unmc.edu/AP/),发现抗菌肽之间的序列相似性很低。对于决定抗菌肽活性的关键因子又有新的假设被提出,即抗菌肽的抑菌活性并非由其特定的氨基酸序列决定,而是由其氨基酸组成及理化特性所决定[22],这一假说对抗菌肽研究有现实的指导价值。
笔者将根据MS/MS测序的结果设计PCR简并引物,以克隆该抗菌肽的编码基因并分析其调控机理,为对拮抗菌2-Q-9进行遗传改良并利用BL2Q9的编码基因进行抗病分子育种奠定基础。
[1] Robert E W,Daniel S C.Peptide antibiotics [J]. Antimicrobial Agents and Chemotherapy,1999 (6): 1317-1323.
[2] Kleinkauf H,Von Dǒhren H.A nonribosomal system of peptide biosynthesis[J].Eur J Biochem,1996(2):335-351.
[3] Cockeril F R.Genetic methods for accessing antimicrobial resistance[J].Antimicrobial Agents and Chemotherapy,1999(2):199-212.
[4] Brodgen K A.Antimicrobial peptides:Pore formers or metabolic inhibitors in bacteria?[J].Nature Microbiology,2005(3):238-250.
[5] Asaka O,Shoda M.Biocontrol ofRhizoctonia solanidamping-off of tomato withBacillus subtilisRB14 [J].Appl Environ Microbiol,1996,62(11):4081-4085.
[6] Heinzmann S,Entian K D,Stein T.EngineeringBacillus subtilisATCC 6633 for improved production of the lantibiotic subtilin[J].Appl Microbiol Biotechnol,2006,69:532-536.
[7] Keymanesh K,Soltani S,Sardari S.Application of antimicrobial peptides in agriculture and food industry [J].World Microbiol Biotechnol,2009,25:933-944.
[8] 黎定军,陈武,罗宽.侧孢芽孢杆菌2-Q-9外泌抑制物质性质[J].湖南农业大学学报:自然科学版,2007,33(4):471-474.
[9] 张竹青,罗宽,高必达.烟草青枯病生防细菌发酵培养条件研究[J].湖南农业大学学报:自然科学版,1999,25(2):143-146.
[10] 陈武,何命军,易建华,等.三株拮抗菌对烟草幼苗根系活力的影响[J].湖南农业科学,2005(4):26-27.
[11] Schǎgger H,Von Jagow G.Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separateion of proteins in the range from 1 to 100 kDa[J].Analytical Chemistry,1987,166(2):368-379.
[12] 汪家政,范明.蛋白质技术手册[K].北京:科学出版社,2000:124-144.
[13] 坎普 R M.蛋白质结构分析:制备、 鉴定与微量测序[M].施蕴渝,饶子和,陈常庆,等译.北京:科学出版社,2000:113-120.
[14] 罗楚平,陈志谊,刘永锋,等.利用基因工程改良枯草芽孢杆菌[J].江苏农业学报,2008,24(2):204-209.
[15] Hancock R,Sahl H G.Antimicrobial and host-defense peptides as new anti-infective therapeutic strategies [J].Nature Biotechnology,2006,24:1551-1557.
[16] Sang Y M,Blecha F.Aantimicrobial peptides and bacteriocins alternatives to traditional antibiotics [J]. Animal Health Research Reviews,2008,9(2):227-235.
[17] 马歇根 M T,马丁克 J M,帕克 J.微生物生物学[M].11版.李明春,杨文博主译.北京:科学出版社,2009:1015-1035.
[18] Koczulla A R,Bals R.Antimicrobial peptides:Current status and therapeutic poteintial[J].Drugs,2003,63(4):389-406.
[19] Jerold G Y,Romanowski E G.A review of antimicrobial peptides and their therapeutic potential as anti-infective drugs[J].Current Eye Research,2005,30(7):505-515.
[20] Agarwal S,Mishra N K,Bhatnagar S,et al.PemK toxin ofBacillus anthracisis a ribonuclease,an insight into its active site,structure,and function[J].Biological Chemistry,2010,285:7254-7270.
[21] Guerra P T,Valadez-Lira J A,Alcocer-Gonzalez J M,et al.Detection of genes encoding antimicrobial peptides in Mexican strains ofTrichoplusianiH exposed toBacillus thuringiensis[J].Invertebr Pathol,2008,98(2):218-227.
[22] Wimley W C.Describing the mechanism of antimicrobial peptide action with the interfacial activity model[J].Chem Biol,2010,5(10):905-917.
英文编辑:易来宾

