云南药用野生稻BIBAC文库的构建及分析
侯思名, 张薇, 翟书华, 岑晓江, 黄兴奇 程在全*
(1.云南省农业科学院 生物技术与种质资源研究所,云南 昆明650205; 2.昆明学院 生命科学与技术系,云南 昆明650214;3.云南大学 生命科学学院,云南 昆明 650091)
药用野生稻(Oryza officinalisWatt.)是原产中国的3种特有的珍稀野生稻种质资源之一,主要分布于云南、广东、广西、海南等地,蕴含着栽培稻中所没有的重要基因和丰富的遗传多样性。野生稻种类多、遗传资源丰富、抗逆性较强,是栽培稻遗传改良和重要基因克隆的基础[1-2];而栽培稻种内遗传基础狭窄,受现有亲本遗传基础的限制,长期反复使用类似或相同的亲本,使很多改良品种具有相同或相似的遗传来源,容易造成遗传上的单一性。
药用野生稻属CC基因组型(染色体数2n=24),与栽培稻AA基因组型差异较大。通过传统的有性杂交方式转移药用野生稻的优良性状和基因,主要存在杂交不亲和、杂交不育等生殖障碍及重组频率低、不易存活等问题。构建药用野生稻的基因组大分子文库,开展大片段转化,可为野生稻优良基因的发掘和利用提供新的技术手段。
构建基因组DNA大分子文库是基因克隆和基因组研究的基础。新基因的克隆通常需要对候选克隆进行基因功能互补试验,用第 2代载体 YAC、BAC 和 PAC 等构建基因组文库进行目的基因的筛选,在获得候选克隆后,要进行亚克隆,对每个亚克隆逐一进行基因功能互补试验,不仅工作量大,而且有遗漏目的基因的缺陷[3-5]。第 3代新型载体双元细菌人工染色体(BIBAC)和 TAC (transformation- competentartificial hromosome),不仅能作为大片段基因组文库的载体,而且能通过根癌农杆菌介导将克隆片段直接导入植物基因组进行功能互补试验,效率比较高。
云南药用野生稻起源于云南,植株具有高度的可塑性,抗病能力强,稻米品质优良。笔者以云南药用野生稻为材料,构建了云南药用野生稻基因组BIBAC文库,使文库中的药用野生稻部分基因组及一些性状(包括一些抗病基因)直接进入水稻获得一批转基因植株,用以分析和分离药用野生稻优良性状和基因,以期为拓宽栽培稻的遗传基础服务。
1 材料与方法
1.1 材 料
药用野生稻为孟定类型,来源于云南耿马孟定遮甸亚热带雨林区,种植于云南省农业生物技术重点实验室温室。
CIAP碱性磷酸酶、T4DNA ligase为Fermentas产品;NotI购自宝生物公司;其他限制性内切酶购自Fermentas公司。分子量标准Lambda Ladder PEG Marker(N0340S)购自新西兰BioLabas公司。农杆菌C0R308、大肠杆菌DH10B为云南省农业科学院生物所保存。克隆载体BIBAC2由美国Cornell大学赠送。
1.2 方 法
取幼穗期幼嫩叶片提取药用野生稻基因组DNA。
1.2.1 药用野生稻目标大片段的获得
参照文献[6]的方法,有改动。
1.2.2 基因组DNA琼脂糖块的制备
参照文献[6]的方法,有改动。
1.2.3 琼脂糖块最佳部分酶切条件的摸索
主要考虑限制性内切酶的用量和酶切时间。分别用不同的酶浓度和不同的酶切时间进行酶切预试验。
取上述琼脂糖块6个,每个琼脂糖块被切成均等的8小片,放入酶切平衡液中平衡后,转到1.5 mL离心管中,每管放入16小片,加入150 μL的酶切消化液消化。
按照 1.0、2.0、5.0、12.0、15.0、30.0 u 的酶浓度单位加限制性内切酶BamHI。混匀后冰上放置2 h,37 ℃,分别酶切15、20 、25 、30 、60 min。反应完毕后立即加入 1/10体积的 0.5 mol/L的EDTA(pH 8.0)终止反应。
用脉冲电泳分析酶切效果,选择部分酶切后DNA片段大小集中在60~200 kb时的酶切浓度为最佳条件。
1.2.4 大片段DNA的部分酶切和目标片段的回收
按照摸索的条件,用限制性内切酶大量酶切包埋于琼脂糖块中的基因组DNA。脉冲电泳回收透析袋中的DNA。
1.2.5 BIBAC2载体质粒的大量提取与纯化
BIBAC2载体质粒按碱裂解法提取。先用CsCl-EtBr梯度平衡离心法纯化闭环DNA质粒,再用PEG沉淀法进行第2次纯化。BamHI完全酶切,酶切后用CIAP碱性磷酸酶去除磷酸。定量后等份分装,贮存于-20 ℃备用。
1.2.6 连 接
取回收的大片段DNA与BIBAC2载体进行连接,载体与大片段在60 ℃下温浴10 min,室温冷却15 min后,再加入T4DNA ligase。连接体系10 μL。连接产物脱盐、浓缩。
1.2.7 电激转化和阳性菌落的保存
用大肠杆菌DH10B感受态细胞电激转化,涂布于含50 mg/mL的卡那霉素和5%蔗糖的LB平板中,37 ℃,12~18 h。挑取阳性克隆于384孔板中,-80 ℃保存。
1.2.8 BIBAC文库的分析鉴定
1) 鉴定插入片段大小。从平板中随机挑取 50个白色克隆,分别接种到1 mL 含50 mg/mL卡那霉素和5%蔗糖的LB培养基中,37 ℃培养过夜,用碱裂解法提取质粒。提取的质粒用NotI进行酶切,37 ℃下,2~4 h,或过夜。65 ℃水浴10 min分离黏性末端。酶切片段用脉冲电泳分离,EB染色后,紫外灯下检测插入的DNA片段的大小。
2) 检测BIBAC克隆的稳定性。随机挑选出2个阳性克隆,分别接种到含50 mg/mL卡那霉素和5%蔗糖的LB培养基中,37 ℃连续继代培养5 d,用碱裂解法分别提取第0代和第100代BIBAC克隆的质粒DNA。把第0代和第100代质粒电转到农杆菌COR308中,28 ℃连续继代培养10 d,再用碱裂解法分别提取第0代和第100代BIBAC2克隆的质粒 DNA。所有第 0代和第 100代的质粒都用BamHI 和HindIII进行酶切,利用脉冲电泳检测BIBAC克隆中外源DNA在大肠杆菌和农杆菌继代培养中的稳定性。
2 结果与分析
2.1 药用野生稻基因组DNA琼脂糖块的检测
脉冲电泳检测提取的基因组DNA。从图1的结果看,所提取的基因组DNA滞后于分子量标准中最高条带291.0 kb,表明DNA的相对分子质量很大。出现一整齐条带,且无降解现象,表明 DNA的质量相对较好,能满足后续试验的要求。

图1 药用野生稻基因组DNA的检测图谱Fig.1 Patterns of genome DNA of Oryza officinalis
2.2 大片段DNA的部分酶切检测
药用野生稻基因组DNA用BamHI在不同浓度和不同时间下进行酶切,随着酶浓度的增大和酶切时间的延长,酶切后得到的片段越小。图2显示的是不同酶切时间和酶切浓度下的酶切电泳图谱。其中1~4和5~8各为一组,酶切时间分别为30和25 min,泳道1和5的酶切浓度为1.0 U,2和6的酶切浓度为2.0 U,3和6的酶切浓度为5.0 U,4和8的酶切浓度为12.0 U。从图中可看出,25 min 1.0 U时的酶切结果与预期的片段相近。
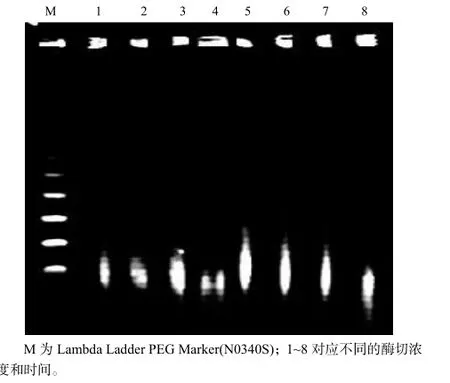
图2 大片段DNA部分酶切图谱Fig.2 Patterns of partial digestion genome DNA
2.3 BⅠBAC质粒酶切检测验证
质粒经过提取与纯化后,分别用BamHI、SalI、EcoRI酶切检测BIBAC载体的完整性。图3结果表明,载体结构完整,经过处理的载体可以用于后续的文库构建。
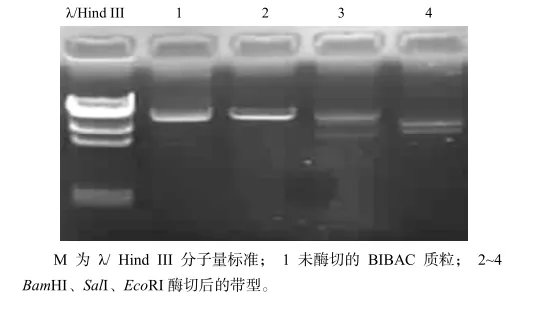
图3 BⅠBAC载体质粒酶切验证Fig.3 Ⅰdentification of BⅠBAC vector
2.4 BⅠBAC克隆中插入片断大小的鉴定
从LB平板中随机挑取50个菌落,碱裂解法提取质粒后进行酶切鉴定,脉冲电泳估算插入片段的大小和检测空载率。图4是药用野生稻BIBAC文库插入片段的分布情况,从图中可以看出,酶切片段大小以50~100 bp居多,在20~50 bp也集中了一定数量的酶切片段,与预期的用于构建文库的酶切片段大小接近。
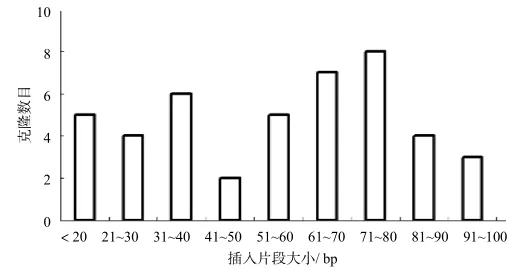
图4 BⅠBAC文库插入片段的分布Fig.4 Size distribution of insert fragments in BⅠBAC library
2.5 BⅠBAC克隆的稳定性检测
比较2个随机克隆在大肠杆菌和农杆菌中的第0代和第100代的质粒的酶切图谱,结果显示,各代中没有发现任何变化(图5,图6),表明药用野生稻基因组DNA可以在BIBAC克隆中稳定存在。
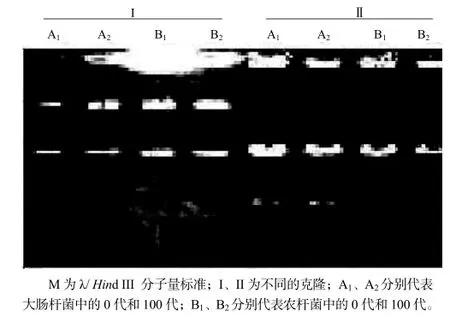
图5 BⅠBAC克隆的BamHⅠ酶切检测Fig.5 Stability detection of BⅠBAC clones digested with BamHⅠ
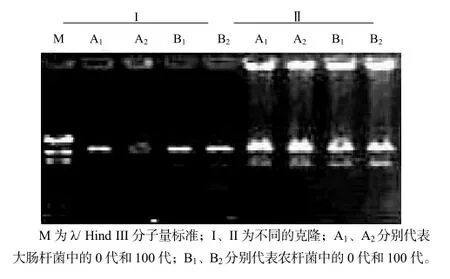
图6 BⅠBAC克隆的Hind Ⅲ酶切检测Fig.6 Stability detection of BⅠBAC clones digested with Hind Ⅲ
3 讨 论
本研究所构建的云南药用野生稻BIBAC文库,总克隆数为53 760个,保存在140块384孔板中,至少覆盖了5.86倍药用野生稻基因组。
载体制备直接影响到文库的构建,只有高质量的载体才可能有高效率的连接和高质量的文库[7]。大量粗提的载体会含有部分的细菌基因组DNA和线性化的质粒DNA,通常采用CsCl-EtBr梯度平衡超离心法纯化,可以得到高纯度的超螺旋闭环质粒DNA,最终获得较高的连接效率和较低的空载率[8-13]。另外,在载体酶切后进行脱磷处理,也可减少或避免空载体出现。本试验过程中大量粗提的载体质粒单独使用CsCl-EtBr梯度平衡离心法纯化后,总有1段较小片段的DNA混杂其中,经过连接后转化效率不高,但在使用CsCl-EtBr梯度平衡离心法纯化,辅助以PEG沉淀法纯化载体质粒后,小片段杂质部分就不复存在了。说明以上两种方法联合使用比单一用CsCl-EtBr梯度平衡离心法纯化更能得到较好的质粒载体,而且载体的连接效率高,每微升载体连接后可获得3 000~4 000左右的克隆。
载体的酶切程度和去磷酸化处理的把握也很重要,载体的酶切要彻底但不能过度,酶切不彻底或过度都不能获得较高的连接效率。另外,在对DNA的酶切过程中,笔者使用了较低浓度的限制性内切酶但用了稍长的时间酶切,实际效果好于较高的酶浓度以较短时间的酶切。本试验中,获得基因组DNA后没有进行脱盐,但在酶切成大片段后进行连接前脱盐,同样得到了较好的连接效果。
[1] Hamilton C M,Frar Y A,XU Y,et al.Construction of tomato genomic DNA libraries in a binary BAC (BIBAC) vector[J].Plant J,1999,18:232-229.
[2] 秦学毅,朱汝财,唐健淮,等.药用野生稻对褐飞虱抗性基因的遗传分析及利用研究[J].遗传资源学报,2007,8(1):41-45.
[3] Liu Y G,Whittier R F.Rapid preparation of megabase plant DNA from nuclei in agarose plugs and microbeads [J].Nucleic Acids Res,1994,22(11):2168-2169.
[4] Osoeqawa K,Woon PY,Zhao B,et al.An improved approach for construction of bacterial artificial chromosome libraries[J].Genomics,1998,52(1):1-8.
[5] 何瑞锋,丁毅.交变脉冲电场凝胶电泳与植物大分子DNA的制备[J].植物学通报,1999(1):87-89.
[6] Carol M Hamilton.A binary-BAC system for plant transformation with high molecular weight DNA[J]. Gene,1997,200:107-116.
[7] 方玉达,刘耀光,吴豪,等.小麦-簇毛麦6VS/6AL易位系可转化人工染色体(TAC)文库的构建[J].生物工程学报,2000,16(4):433-436.
[8] Chang Y-L,Henriquez X,Preuss D,et al.A plant-transformation-competent BIBAC library from theArabidopsis thalianaLandsberg ecotype for functional and comparative genomics[J].Theor Appl Genet,2003, 106:269-276.
[9] Meksem K,Zobrist K,Ruben E,et al.Two large-insert soybean genomic libraries constructed in a binary vector:Applications in chromosome walking and genome wide physical mapping[J].Theor Appl Genet,2000,101:747-755.
[10] Xu Y-H,Zhu Y-Y,Zhou H-C,et al.Identification of a 98 kb DNA segment containing the riceEuigene controlling uppermost internode elongation,and construction of a TAC transgene sublibrary[J].Mol Gen Genomics,2004, 272:149-155.
[11] He Ruifeng,Wang Yuanyuan,Shi Zhenying,et al.Construction of a genomic library of wild rice andAgrobacterium-mediated transformation of large insert DNA linked to BPH resistance locus[J].Gene,2003,321:121-132.
[12] 徐粤宇,周玉雷,宋琳琳,等.多枝赖草基因组可转化人工染色体(TAC)文库的构建和鉴定[J].中国科学:C辑,2008,38(4):328-336.
[13] Steven R Larson,Chantel Scheuring,Parminder Kaur,et al.BAC library development for allotetraploid Leymus (Triticeae) wildryes enable comparative genetic analysis of lax-barrenstalk1 orthogene sequences and growth habit QTLs[J].Plant Science,2009,177:427-438.
英文编辑:易来宾

