短时受精并即刻脱颗粒细胞对 IVF-ET治疗周期的影响
刁 英 杨智敏 谭兵兵 葛 斌 杨名慧
遵义医学院第一附属医院生殖中心(563003)
与传统体外受精(精卵孵育过夜)不同,短时受精是将精卵共同孵育 2~4h后,即将卵移出受精滴的一种受精方式,对其常规应用目前仍存在疑义:①短时受精是否会影响受精率与妊娠率;②短时受精并即刻脱颗粒细胞是否增加多原核 PN率等。本研究以在本中心接受体外受精 -胚胎移植(IVF-ET)治疗的患者 271例 316个周期为研究对象,探讨上述问题。
1 资料与方法
1.1 研究对象
将 2005年 12月 ~2009年 6月在本中心接受
IVF-ET治疗的患者271例 316个周期,随机分成 3组:①短时受精并即刻脱颗粒细胞组(A组,精卵孵育 2h并即刻脱颗粒细胞)92例 110周期,患者年龄30.8±5.1岁,获卵 10.8±3.5个;②短时受精并次日晨脱颗粒细胞组(B组,精卵孵育 2h并受精后 18~19h脱颗粒细胞)89例,108个周期,患者年龄30.1±4.9岁,获卵 11.1±4.0个;③传统受精组(C组,精卵孵育过夜)90例,98个周期,患者年龄 31.2±4.5岁,获卵 10.5±3.8个。以上数据经统计学分析,3组间差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 控制性超促排卵及取卵 根据患者年龄、卵巢储备情况选择不同的方案。①长方案:采用本中心常规超排卵方案[1],当有 1个卵泡直径≥18mm,或 2个以上卵泡直径≥17mm时,当晚 9时注射人绒毛膜促性腺激素(hCG)5 000~10 000U,36h后在B超引导下阴道取卵。②短方案:在月经周期第 2天采用短效曲普瑞林(达必佳)0.1mg降调节,第 3天用卵泡刺激素(FSH)/人绝经促性腺激素(HMG)启动 ,根据患者年龄、卵巢储备情况,选择不同启动剂量,常规启动剂量为 150~225U,根据卵泡生长情况适时调整药量。注射 hCG时间与取卵同长方案。
1.2.2 精液准备 手淫法取精于一次性无菌广口杯中,根据精液当日情况用密度梯度离心和(或)上游法[2]洗精,置 37℃,5%CO2培养箱中备用。
1.2.3 受精及脱颗粒细胞时间和胚胎培养 取卵4~6h后,按精卵(20 000~50 000):1比例混合法受精。A组:精卵共同孵育 2h后,即脱去卵周围全部颗粒细胞,将卵转移至新鲜的已平衡过的受精培养液中;B组:精卵共孵育 2h后,将卵连同周围颗粒细胞转移至新鲜已平衡过的受精培养液中,第 2天(精卵共同孵育 18~19h)去掉卵周围的颗粒细胞;C组:精卵共同孵育过夜(精卵共同孵育 18~19h),第2天去掉卵周围颗粒细胞。3组卵均于受精 18~19h后转入卵裂培养基中,在倒置显微镜下观察受精情况。受精卵继续培养 48h,观察胚胎发育情况,然后选择优质胚胎进行移植。第 3日评价胚胎质量根据参考文献[3]的标准进行。胚胎达 6细胞以上,Ⅰ ~Ⅱ级胚胎为优质胚胎。
1.2.4 胚胎选择与移植后处理 取卵后第 3天进行胚胎移植。患者年龄 <35岁,移植 2个胚胎;年龄 >35岁,或≥2个治疗周期,移植 3个胚胎。移植后予黄体酮或 hCG支持黄体。移植后 2周测尿hCG,阳性者为生化妊娠。移植后 5周,B超检查见孕囊及胚芽即诊断为临床妊娠。
1.3 统计学方法
3组计量资料采用方差分析,计数资料采用 χ2检验。
2 结果
2.1 受精率、多精受精率、卵裂率和优质胚胎率的比较
A组 110个周期共获卵 1 188个;B组 108个周期,共获卵 1 198个;C组 98个周期,共获卵 1 029个。3组相比较,受精率、多精受精率、卵裂率差异无统计学意义(P>0.05)。优质胚胎率 A组、B组均高于 C组(P<0.01),A组与 B组相比差异无统计学意义(P>0.05),见表 1。
2.2 临床妊娠率、胚胎种植率、流产率的比较
A组和 B组的临床妊娠率、胚胎种植率均显著高于 C组(P<0.05,P<0.01),A组与 B组比较差异无统计学意义(P>0.05)。流产率各组间差异无统计学意义(P>0.05),见表 1。
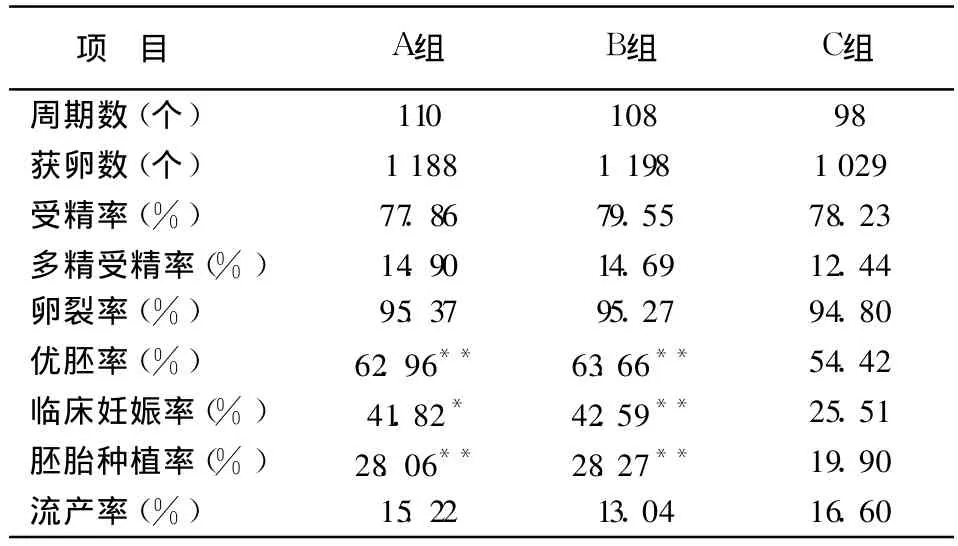
表 1 3组 IVF-ET各项数据比较
2.3 3组分娩结局
3组出生婴儿男女性别比例、单胎出生体重及多胎出生体重比较差异均无统计学意义(P>0.05),见表 2。3组均未见畸形新生儿出生,亦无围生期死亡病例。
3 讨论
目前,IVF-ET是治疗不育症最有效的方法之一,但成功率尚不尽如人意。与体内受精时到达受精部位的精子数量有限(几条 ~几百条不等)不同,体外受精时将卵子暴露于较高浓度的精子中(20 000~50 000)长达十多个小时,是否会对卵及其随后的胚胎发育产生不良影响?基于此点考虑,1996年 Gianaroli等[4]在前人 Austin[5]及 Yanagimachi[6]等动物实验的基础上,首次将精卵孵育时间缩短至 1h,取得了较好的结果。之后又有 Kattera等[7]及 Bungum等[8]等证实了这一结果。本研究结果亦显示:短时受精无论是即时脱颗粒细胞组还是次日晨脱颗粒细胞组,其受精率、卵裂率、流产率与传统受精组比较,差异均无统计学意义,而优质胚胎率、临床妊娠率、胚胎种植率高于后者,究其原因可能有以下几点:①体内受精时精卵相互作用和受精发生在性交后 20min内。Gianaroli等[9]发现:在体外,精子 4h就可以到达卵母细胞的皮质,相互激活,刺激卵母细胞排出第 2极体,形成雌雄原核。Bungum等[8]将受精时间缩短到极致(仅 30s),发现与传统受精比较受精率无明显差异;而李涛等[10]采用精卵孵育 10min的超短时受精,也获得了 65.6%的正常受精率。本研究结果进一步证明:精卵孵育 2h完全能够满足受精所需时间。②传统受精组卵子与高密度精子长时间作用,精子代谢产物堆积,加之脱落的颗粒细胞及死精子等均会消耗培养液的能量,使卵处于一个营养不良的环境中。另外,颗粒细胞、精子代谢产生的活性氧化物(ROS)可造成不饱和脂肪酸发生过氧化反应,影响卵质膜的流动性,导致卵质膜硬度的变化,这一变化可能影响细胞分裂和损伤细胞功能[4,9]。而且来源于精子的乳酸盐和 ROS不但对精卵作用产生负面影响,同时也影响透明带的硬度与厚度[11],从而影响胚胎的孵育与着床,最终影响到 IVF-ET的结局。

表 2 3组分娩结局比较
短时受精并即刻脱颗粒细胞与传统受精方式比较,除了可以提高优质胚胎率、临床妊娠率和胚胎种植率外,还有以下优点:①受精 2h脱颗粒细胞后,可以清楚地看见卵是否排出第 1极体,卵周间隙的大小及卵胞浆有无空泡等,从而可以反馈指导临床注射 hCG的时机是否合适。与此同时笔者还发现:一些取卵当日(受精后 2h)脱颗粒细胞时为 MⅠ或 GⅤ的卵,次晨可长成 MⅡ(或 MⅠ)的卵却多不受精,从而解释了以前受精后 18~19h观察,部分 MⅡ期卵子未受精的原因之一是因为受精当时卵不成熟。即在短时受精并即刻脱颗粒细胞过程中,可以观察到卵不成熟或过成熟对受精率和多精受精率的影响。②由于短时受精并即刻脱颗粒细胞后还可以观察到第 2极体的排出,从而可明确是否需行早期补救 ICSI治疗,以避免完全受精失败的发生。短时受精并即刻脱颗粒细胞及早期补救 ICSI的使用,将ICSI的指征限定在了无精子症(采用附睾/睾丸精子)、100%圆头精子和严重卵子异常等情况,因而进一步严格控制了 ICSI治疗的适应证[12]。
有学者提出:在受精早期脱颗粒细胞的机械操作是否会增加多精受精[13],为此本研究将患者分成了短时受精 2h后即刻脱颗粒细胞与短时受精 2h后,18~19h脱颗粒细胞两组,分别与传统受精组进行比较观察,结果发现 3组多精受精率没有差异。可能原因如下:①笔者采用的是直径为 135~140μm的拨卵针,该针管口光滑,弹性较大,大小适宜,仅需几次轻柔地吹吸就能很快脱尽颗粒细胞,对卵的影响较小,估计还不至达到引起卵受精异常的程度。②多精受精最主要的原因还在于精子数量过多和受精卵子本身的质量问题(不成熟或过成熟)[14,15],质量好的卵经此操作可能不受影响,而质量差的卵虽经如此轻柔的操作仍可能出现异常受精,但也借此淘汰了质量不好的卵形成的胚胎。故笔者认为:只要超排卵方案得当,卵质量好,所加精子密度不过高,短时受精并即刻脱颗粒细胞并不会显著增加多精受精率;反之,即使不做短时受精并即刻脱颗粒细胞,多精受精率同样不会低,这在年龄较大或卵募集较多的患者中尤为明显[16,17]。
综上所述,笔者认为:短时受精并即刻脱颗粒细胞与传统受精方式比较,不失为一种有益的改进,且可以帮助临床判断注射 hCG的时机是否合适,还使早期补救 ICSI技术成为可能,使 ICSI治疗的适应证被进一步严格控制。本中心开展此项工作 4年多来,临床妊娠流产率与传统组比较并未增多,亦无畸形新生儿出生,出生男女婴儿性别比例,单胎、多胎新生儿出生体重与传统组比较亦无差异,故认为此项技术安全有效,值得临床应用。
1 刁英,杨智敏,谭兵兵,等.短时受精在体外受精 -胚胎移植治疗周期中的应用价值[J].中国妇幼保健,2010,25(15):2104-2106.
2 刁英,杨智敏,谭兵兵.密度梯度离心法加上游法处理精液对精子运动参数及形态学的影响[J].新医学,2008,39(9):598-600.
3 庄广伦.现代辅助生育技术[M].北京:人民卫生出版社,2005:240-241.
4 Gianaroli L,MagliMC,FerrarettiAP,et al.Reducing the time of sperm-oocyte interaction in human in-vitro fertilization improves the implantation rate[J].Hum Reprod,1996,11(1):166-171.
5 Austin CR.Observationson the penetration of thesperm into themammalian egg[J].Sci Res,1951,4(8):581-596.
6 YanagimachiR.In vitrocapacitation ofhamster spermatozoaby follicular fluid[J].Reprod Fertil,1969,18(2):275-286.
7 Kattera S,Chen C.Short conincubation of gametes in in vitro fertilization improves implantation and pregnancy rates:a prospective,randomized,controlled study[J].Fertil Steril,2003,80(4):1017-1021.
8 Bungum M,Bungum L,Humaidan PA.Prospective study,using sibling oocytes,examing the effect of 30 seconds versus 90minutesgamete co-incubation in IVF[J].Hum Reprod,2006,21(2):518-523.
9 Gianaroli L,Fiorentino A,Magli MC,et al.Prolonged sperm-oocyte exposure and high sperm concentration affect human embryo viability and pregnancy rate[J].Hum Reprod,1996,11(11):2507-2511.
10 李涛,任姿,张敏芳,等.超短时受精对人类配子体外多精受精发生率的影响[J].中山大学学报(医学版),2007,28(3s):67-69.
11 Dim feld M,Shiloh H,Bider D,et al.A prospective randomized controlled study of the effect of short coincubation ofgametes during insem ination on zona pellucida thickness[J].Gynecol Endocrinol,2003,17(2):397-403.
12 孙海翔.早期补救 ICSI的安全性和应用价值[J].生殖医学杂志,2009,18(3):195-197.
13 张微,宋成,成金泉,等.卵子受精早期现象的初步探讨[J].生殖医学杂志,2009,18(3):197-202.
14 Flaherty SP,Payne D,Swann NJ,et al.Assessment of fertilization failure and abnormal fertilization after intracytoplasmic sperm injection(ICSI)[J].Reprod Fertil Dev,1995,7(2):197-210.
15 庄广伦.现代辅助生育技术[M].北京:人民卫生出版社,2005:237-237.
16 黄学锋,张巍.人类体外受精中的异常受精[J].生殖医学杂志,2009,18(3):184-186.
17 刘德一,Gordon Baker HW.IVF过程受精失败的预测[J].生殖医学杂志,2009,18(3):202-205.

