芦丁对耐力训练大鼠免疫和抗氧化功能的影响
汶 希,潘华山,冯毅翀,刘 刚
(广州中医药大学体育健康学院,广东 广州510006)
运动与免疫之间的相互关系研究一直受到许多学者的广泛重视.研究结果表明,适量运动可以促进淋巴细胞的功能,提高机体免疫能力.流行病学调查显示,长时间或大强度运动可能会造成运动员对疾病的易感性增加,并且在疾病潜伏期训练或比赛还会加重发病症状[1].优秀运动员、教练员及队医也从实践经验中体会到,频繁比赛和高强度的训练会使运动员抵抗力下降,容易感染疾病,从而影响他们的运动能力,甚至中断和退出训练、比赛.因而,探讨改善或调节运动后免疫功能的干预措施具有重要现实意义.
芦丁 (rutin)分子式为C27H30O16,又称芸香苷 (rutinoside)、维生素P、紫槲皮苷,是槲皮素的3-O-芸香糖苷,化学式见图1,为一来源很广的黄酮类化合物广泛存在于自然界中[2],几乎所有的芸香科和石楠科植物均含有芦丁.芸香科的芸香草、豆科的槐、蓼科的荞麦、金丝桃科的红旱莲、鼠李科的光枝勾儿茶等植物含量较为丰富.芦丁具有多种生理活性,药用价值很高.常用于防治脑溢血、高血压、视网膜出血、紫癜、急性出血性肾炎、慢性气管炎、血管脆性增加、血管渗透压异常等病症,同时还可预防和治疗糖尿病及高脂血症,芦丁除能降低血脂、抗血小板聚集、抑制血管内皮因子的释放外,还能抑制基因突变,诱导肿瘤细胞凋亡,促进早幼粒细胞分化,提高小鼠淋巴细胞转化率[3].芦丁对免疫系统调节作用的研究报道甚少[4],体内氧化还原反应关系密切的肝细胞功能的影响也一直未得以阐明.为了深入探讨芦丁的免疫调节作用,本实验通过建立大鼠耐力训练模型来观察不同剂量的芦丁对机体免疫功能的影响,并从特异性免疫和非特异性免疫方面进行了研究,为改善耐力训练引起的细胞免疫功能低下寻找有效的干预措施.
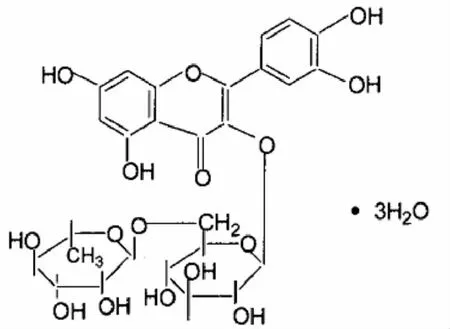
图1 芦丁的结构式
1 材料与方法
1.1 药物和安慰剂的制备
芦丁纯度为98%,由南京替斯艾么中药技术研究所提供,实验时用蒸馏水配成所需浓度的混悬液.对照组采用同体积的双蒸水,双蒸水由德国GFL双蒸水蒸馏设备提取.
1.2 动物分组及给药
实验动物:雄性Wistar大鼠45只,鼠龄8周,体重120~140 g,购于南方医科大学实验动物中心.进行跑台适应性训练剔除不会跑、不愿跑的大鼠,筛选出39只大鼠进行饲养.温度为21~24℃,湿度60%左右,昼夜节律用日光灯控制,每日光照时间12 h(8∶00~20∶00),大鼠分笼饲养,每笼5只.标准啮齿类动物维持期饲料常规饲养1周,自由进食和饮水.
分组:根据体重随机将小鼠分为2组:对照组19只大鼠进行耐力训练的同时每两天以双蒸水灌胃;芦丁组20只大鼠通过灌胃给药,给药量为10 m L/kg,每天灌胃一次.
1.3 跑台训练方法
目前,最为运动医学界认可的大鼠跑台运动模型为:Bedford渐增负荷跑台运动模型[5].Bedford通过大量实验,将大鼠跑台的速度、时间、坡度与运动强度联系起来,规范了大鼠跑台的量化指标,其具体内容:第一级负荷:0°,8.2 m/min,运动15 min (相当于53%VO2MAX);第二级负荷:10°,15 m/min,运动15 min (相当于64%VO2MAX);第三级负荷:15°,19.3 m/min,运动90 min (相当于76%VO2MAX),总运动时间为120 min,运动中采用毛刷刺激维持运动强度.随着大鼠跑台运动的广泛应用,又有研究使用如下方法:在坡度为0°的大鼠跑台训练,小强度训练组跑速15 m/min,训练时间40~60 min;中强度训练组跑速20~25 m/min,训练时间30~40 min;大强度训练组跑速30~35 m/min,训练时间20~30 min.因此在设置大鼠耐力训练模型时,本研究借鉴上述跑台运动的设计,考虑本研究样本量略大,研究动物个体运动能力差异,拟选用同一速度:25 m/min,每次运动40 min,每周运动5天,持续4周,将运动控制在中高强度,以期模拟运动员平时运动的状态.
1.4 仪 器
723C型分光光度计:上海精密仪器仪表有限公司产品.JD-3B多功能电子天平:由沈阳龙腾电子有限公司提供.日本东芝TBA-10FR全自动生化分析仪:(日本)东芝公司产品.
1.5 取样及测试方法
4周训练结束后对照组和芦丁组大鼠在最后一次训练停止后20 h左右用1.5 m L三氯乙醛腹腔麻醉,腹主动脉取血2 m L,肝素抗凝.一部分抗凝血用于外周血单个核细胞 (PBMC)的分离与培养,T细胞数量的测定.剩下的部分静置30 min后,2500 r/min离心10 min,取上清液体保存于小试管中,-20℃冻存待测.MDA采用TBA比色法 (硫代巴比妥酸),SOD采用黄嘌呤氧化酶法,GSH采用比色定量.白细胞介素采用放射免疫检测法,在γ计数仪 (美国Beckman公司500型)上检测IL-2,IL-6浓度.
1.5.1 外周血WBC、淋巴细胞数量的测定
取20μL全血,放入事先加好血细胞稀释液试管 (1∶200稀释)中,用Culhae MEK—6318K血细胞分析仪 (日本光电公司制造)测定WBC、淋巴细胞数量,血细胞稀释液 (批号040525)由日本光电工业株式会社授权生产.
1.5.2 T淋巴细胞数量测定
取20μL抗凝血,加入FITC标记的抗大鼠CD3的单抗 (美国CALTAG公司产品)0.3μL,混匀,室温避光孵育15 min.加入200μL1∶9稀释的溶血剂 (三和医疗设备有限公司公司产品),混匀,室温避光孵育10 min.离心10 min后,弃上清.加血清、叠氮钠等混匀,离心5 min后,弃上清,混悬细胞.加300μL PBS(含胎牛血清和1%多聚甲醛)混匀.在流式细胞仪上计数细胞,分析T细胞 (CD3+)数量.
1.6 统计学处理
2 结 果
2.1 补充芦丁对耐力训练大鼠外周血WBC和淋巴细胞及T细胞数的影响
在训练4周后,芦丁组大鼠外周血WBC、淋巴细胞数和T细胞数均比对照组高.但差异无统计学意义 (P>0.05)(见表1).

表1 训练4周后大鼠外周血WBC和淋巴细胞及T淋巴数测试结果
2.2 补充芦丁对耐力训练大鼠血清MDA、GSH、SOD含量的影响
与对照组比较,芦丁组血清MDA含量明显降低 (P<0.05),GSH含量升高(P<0.05),血清SOD活力显著升高 (P<0.01)(见表2).

表2 训练4周后大鼠血清MDA、GSH、SOD含量测试结果
2.3 补充芦丁对耐力训练大鼠血浆白细胞介素浓度变化的影响
与对照组比较,芦丁组IL-2浓度显著增加,差异具有统计学意义 (P<0.05).运动后20 h芦丁组大鼠血浆IL-6水平比对照组显著下降 (P<0.01),由此可以推断补充芦丁能缓解运动大鼠运动后IL-6升高 (见表3).

表3 训练4周后大鼠血浆白细胞介素浓度的变化
3 讨 论
本研究表明4周耐力训练后,单纯运动组6周大鼠外周血WBC、淋巴细胞数、T细胞数下降,与外国学者的研究结果类似[5],补充芦丁在运动后均维持在较高水平.大量的研究已经证明:淋巴细胞在运动过程中浓度升高,运动后反而下降,并低于运动前水平[6-8].故我们推断,耐力训练过程中,由于自由基浓度升高,引起外周血白细胞、淋巴细胞膜损伤或破裂,细胞膜通透性增加,导致数量减少.Hung等研究证实芦丁的抗氧化作用强于维生素E及维生素C[9].并能清除自由基,尤其是羟自由基,使DNA免受损伤,我们推测补充芦丁在运动后维持外周血WBC、淋巴细胞数、T细胞数无太大波动,也与这个原因有关.
MDA含量可反映组织细胞脂质过氧化的速率和强度,间接反映细胞的损伤程度,其含量越高,生物膜破坏越严重.试验中芦丁组可显著降低MDA含量,使其恢复到正常水平,这与大鼠体内抗氧化能力增强有关.谷胱甘肽过氧化物酶 (GSH-Px)是机体内广泛存在的一种重要的过氧化物分解酶,能同时促进H2O2的分解[10],从而保护细胞膜的结构及功能不受过氧化物的干扰及损害.SOD可清除自由基,减轻和阻断脂质过氧化,保护机体免受自由基损伤.补充芦丁后GSH、血清SOD活性增高、MDA含量下降提示:芦丁可以使体内抗自由基能力提高,芦丁是一种天然抗氧化剂,夏维木等发现芦丁对O2-有很强的清除作用,清除效率可达96%以上[11].芦丁作为Fe2+的螯合剂,能抑制Fenton(芬顿)反应和脂质过氧化的链式反应而具有明显的抗脂质过氧化作用[12].
IL-2主要以自分泌或旁分泌方式发挥效应.IL-2是辅助T淋巴细胞受抗原或分裂原刺激产生的一种糖蛋白,有促进B淋巴细胞分化和增殖,提高NK细胞活性的作用.IL-6本属于前炎性细胞因子,但在应激状态下也有整体调节作用.剧烈运动后,这两种细胞因子可成倍增加[14]如,马拉松比赛后,IL-6的血清浓度增加值高达安静值的50倍[15].本研究结果显示,与对照组比较,芦丁组IL-2浓度显著增加,差异具有统计学意义.运动后20 h芦丁组大鼠血浆IL-6水平比对照组显著下降,由此可以推断补充芦丁能缓解运动大鼠运动后IL-6升高,抑制进一步的炎症反应.
4 结 论
4.1 补充芦丁可使大鼠耐力训练后外周血WBC和淋巴细胞及T细胞数下降幅度减低,由此可推断芦丁可防止大鼠后耐力训练外周血WBC和淋巴细胞数显著下降.
4.2 补充芦丁可以使大鼠耐力训练后血清MDA含量明显降低,GSH含量升高,血清SOD活力比对照组显著升高.由此推断芦丁可以使体内抗自由基能力提高,通过酚羟基和羰基的转换,可提供氢原子而终止自由基连锁反应,以保护细胞完整性,因此其具有抗运动疲劳的功能.
4.3 补充芦丁可以使耐力训练大鼠IL-2浓度显著增加,血浆IL-6水平比对照组显著下降,由此可以推断补充芦丁能促进B淋巴细胞分化和增殖,缓解运动大老鼠运动后IL-6升高,抑制进一步的炎症反应.
[1] Jin MS,Lee Jo.Structures of the Toll-like receptor family and it ligand complexes [J].Immunity,2008,29 (2):182-191
[2] 臧志和,曹丽萍,钟铃.芦丁药理作用及制剂的研究进展 [J].医药导报,2007,(7).16-18
[3] 孟祥颖,郭良,李玉新,等.芦丁的来源、用途及提取纯化方法 [J].长春中医学院学报,2010,19(2):61-64
[4] 顾洪雁,张媛英,翟静,等.维生素C和芦丁对力竭运动小鼠组织自由基代谢的影响 [J].中国临床康复,2009,9(44):132-134
[5] Sato K,Takayanagi H.Osteoclasts,rheumatoid,arthritis and osteoimmunology[J].Curr Opin Rheumatol,2006,18 (1):419-426
[6] Fournier PG,Chirgwin JM,Guise TA.Newinsights into the role of T cells in the vicious cycle of bone metastases[J].Curr Opin Rheumatol,2006,18 (4):396-404
[7] Peake JM,Suzuki K,Wilson G,et al.Exercise-induced muscle damage,plasma cytokines,and markers of neutrophil activation1 [J].Med Sci Sports Exerc,2005,37 (5):737-745
[8] 谢红,郝选明.T淋巴细胞活性对有氧运动的免疫应答与适应特征[J].中国运动医学杂志.2003,3(21):206-207
[9] Hung Y,Qian WP,Dark K,et al.Estrogen prevent bone loss through transformation growth factor β signaling in T cells [J].Pro Natl Acad Sci USA,2004,100 (4):10405-10410
[10] Wretman C,Lionikas A,Widegren U,et al.Effects of concentric and eccentric contractions on phosphorylation of MAPK (erk1/2)and MAPK (p38)in isolated rat skeletal muscle [J].J Physiol,2001,535 (1):155-164
[11] 黄尚荣.药用芦丁化学成分提取方法及其药理学研究进展 [J].现代农业科技2009,(23):388-389
[12] 马国刚,王建中,黄建东.槐米芦丁的提取、纯化及铬 (Cr~ (3+))配合物光谱表征 [J].北京林业大学学报,2011,33 (1);225
[13] 阎道广,周玫,陈瑗等.槲皮素、芦丁和BHT对低密度脂蛋白氧化修饰的抑制效应 [J].第一军医大学学报,1995,15 (1):24-26
[14] Mitchell JB,Paquet AJ,Pizza FX,et al.The effect of moderate aerobic training on lymphocyte proliferation [J].Int J Sports Med,1995,17 (3):384-389
[15] Tvede N.Evidence that the effect of bicycle ezercise on blood mononuclear cellproliferative responses and subsets is mediated by epinephrine [J].Int J Sports Med,1994,156 (2):100-104

