Stanford B型主动脉夹层支架置入术前MSCTA的诊断价值
主动脉夹层(aortic dissection,AD)是危及生命的严重心血管病变,具有很高的病死率。近年来随着介入治疗尤其是支架置入术的发展,AD生存率大大提高。而多层螺旋CT(multislice spiral CT angiography,MSCTA)以其快速的扫描速度、各向同性的分辨力、功能强大的后处理软件以及近100%的敏感性和特异性,成为 AD的首选影像学检查方法[1]。利用MSCTA对AD进行单纯诊断已不能满足临床诊疗要求,AD各种参数的准确测量及信息提供成为放射科医生参与AD诊疗的重要一环。本研究分析了26例Stanford B型 AD病例资料,旨在探讨 MSCTA对Stanford B型AD支架置入术前诊断价值,并对繁多的MSCTA测量数值及征象按诊疗过程进行分类,希望能得出系统规律的诊断方法。
1 资料与方法
1.1 资料 搜集2005-05~2010-03天津市人民医院26例Stanford B型AD患者,男性16例,女性10例,年龄32~77岁,平均54.5岁。临床症状主要表现为胸腹撕裂样剧痛。体格检查示1例心音遥远、3例扪及腹部搏动性包块、12例双上肢血压不一致,26例均行介入支架置入术治疗。
1.2 方法 采用Philips M x8000 16层CT进行全程主动脉扫描。扫描范围从胸廓入口至腹股沟水平。扫描参数:管电压140kV,管电流140mA,螺距3,矩阵512×512,扫描层厚3mm,重建层厚1mm。增强扫描:对比剂采用碘海醇350mgI/100m l经肘静脉注射,注射流率 4.0m l/s。将降主动脉真腔选作感兴趣区(ROI),CT值达170Hu时触发扫描。原始数据传导至 Extended BrillianceTM 工作站采用多平面重组(multiplanar reconstruction,MPR)、曲面重组(curved planar reconstruction,CPR)、容积再现(volume rendering,VR)及最大密度投影(maximum intensity projection,M IP)技术进行后处理。所得结果与介入结果相比较。
2 结果
2.1 MSCTA表现 ①破裂口情况:26例均能明确破裂口位置。破裂口距左锁骨下动脉开口距离均>1.0cm,1.8~12.2cm,平均 7.4cm。破裂口绝对长度(所测最长长度)0.9~5.2cm,平均2.1cm,破裂口相对长度(与主动脉长轴平行距离)0.5~3.1cm,平均1.9cm。发现破裂口共计42处,6例存在多个破裂口,破裂口间最大距离为3.3~5.1cm,平均4.5cm。2例破裂口位于 T9~L2椎体水平。破裂口近端锚定区管腔直径2.0~3.6cm,平均2.8cm,锚定区存在粥样斑块4例(图1)。②主要血管分支假腔供血情况:肠系膜上动脉2例,右肾动脉8例,左肾动脉7例。③真假腔形态:真腔截面积大于假腔有4例,假腔大于真腔有20例,其中4例真腔变小呈线样。④髂股动脉情况:12例仅单侧髂股动脉管腔最小直径<0.8cm,1例双侧髂股动脉管腔最小值均<0.8cm。⑤合并症:动脉粥样斑块17例,胸腔积液3例,肺部炎症3例。
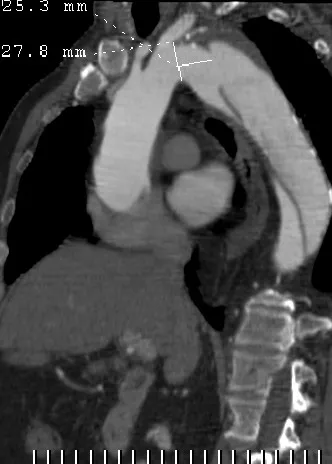
图1 男性,48岁,Stanford B型患者M IP斜矢状位。破裂口近端主动脉管壁粥样斑块(箭头示),数据测量显示破裂口距离左锁骨下动脉开口距离>1cm,近端主动脉直径<38mm,符合介入覆膜支架置入适应证
2.2 介入治疗结果 26例术前均行 DSA主动脉造影,发现破裂口共计45处,破裂口距左锁骨下动脉开口距离2.0~13.2cm,平均7.6cm,破裂口近端管腔直径1.8~3.4cm,平均2.7cm,余破裂口及真假腔显示情况与MSCTA显示无差异,22例行单纯经皮主动脉腔内覆膜支架置入术(图2),4例行经皮主动脉内膜开窗术合并经皮主动脉腔内覆膜支架置入术,与术前MSCTA测量结果参数支架选取未发生不相符情况。26例术后辅以内科治疗,情况稳定后出院。
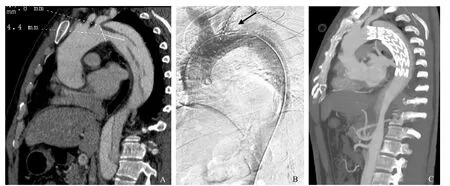
图2 男性,52岁,Stanford B型患者。A.支架置入术前MRP显示破裂口距离左锁骨下动脉开口距离>1.0cm,近端主动脉直径<38mm,符合介入覆膜支架置入适应证;B.支架放入后,造影显示左锁骨下动脉开口未封闭,血流通畅(箭头示);C.术后2周复查,未见内漏、支架移位,左锁骨下动脉血流通畅
3 讨论
本组病例选用较Debakey分型更简洁的Stanford分型[2],即根据破裂口所在位置及血肿累及范围分型,A型累及升主动脉,B型只累及左锁骨下动脉以远。B型适于介入治疗。随着介入治疗手段的发展,为能更好向临床特别是介入医师提供诊疗过程相关信息,笔者将B型AD的MSCTA信息按诊疗过程分为介入支架置入术适应证、介入术前评估及介入术后预判三方面。
3.1 支架置入适应证信息 综合 Nienaber等[3]和Shimono等[4]总结提出的AD支架置入指征:近端撕裂口与左锁骨下动脉开口距离>1.0~1.5cm;AD动脉瘤最大直径>5.5cm;存在持续开放的内膜撕裂口;假腔进行性扩张趋势;反复发作性疼痛;与支架近端锚定区主动脉无明显扩张(直径<3.8cm)或动脉粥样硬化;无严重的主动脉瓣反流;至少一侧肾动脉及肠系膜上动脉由真腔供血。
结合本组病例,MSCTA提供信息如下。
3.1.1 近端破裂口位置 通过 MPR测量破裂口距左锁骨下动脉开口距离,本组病例中距离均>1.0cm,介入术后复查支架均未造成左锁骨下动脉封堵,血供良好。
3.1.2 锚定区测评 包括破裂口近端主动脉锚定区直径的测量,锚定区是否存在严重粥样斑块等。破裂口近端主动脉锚定区直径均采用斜矢状 MPR测量(本组病例锚定区直径均<3.8cm)。另也用此方法显示锚定区内膜情况,本组4例锚定区发现部分粥样斑块,通过MPR及VR显示,介入操作者在术前对支架锚定步骤实施可提前做好准备,4例患者术后复查支架锚定未见移位及内漏等并发症。
3.1.3 重要动脉情况 通常 AD真假腔压力不一致,假腔压力过大致真腔变小,部分重要脏器灌注不足且支架误置入假腔将危及患者生命。MSCTA通过“鸟嘴征”等对真假腔较易判断[5]。MSCTA对支架置入术前是否需要进行经皮主动脉内膜开窗术(percutaneous transluminal fenestration, PTF)或分支血管置入支架来缓解脏器及四肢缺血状态有重要作用[6,7]。PTF一般选择真腔最狭窄部位进行开窗,因该处也是受假腔挤压最严重部位[8],并可借助VR或 M IP重组直观显示病变形态。本组4例MSCTA显示真腔部分层面呈线样狭窄,且存在肾动脉和(或)肠系膜上动脉假腔供血,术前评估后在支架置入术前行PTF治疗缓解真假腔间压力。通过多期像观察是否存在肾皮髓质灌注不良、肾萎缩、肠管水肿等,对肾灌注情况、肠系膜上动脉供应肠管血运状态等较易判断。本组病例中多个病例存在单侧肾动脉由假腔供血,但MSCTA显示相应肾未出现灌注缺血改变,除4例合并真假腔线样改变行PTF治疗,余均未进行特殊处理,AD支架置入术后稳定,未发生脏器缺血改变,与以往相关报道相近[9,10]。
3.2 支架置入术前评估 当各方面资料提示患者适合支架置入后,下一步就应该进行术前评估信息提供。
3.2.1 支架选取 ①支架型号:支架型号选择标准是其直径大于主动脉近端锚定区直径的20%,此通过MPR及多项后处理结合均能较为精确地测定。②支架长度:支架长度应以能完全封堵破裂口相对长度为原则,本组病例通过CPR、MPR及轴位图像综合观察,对破裂口绝对长度和相对长度进行测量,辅助临床确定支架长度选取。③支架数量:MSCTA所示夹层破口范围较大或有多个破口时,需测量破裂口间距离。Palma等[11]报道有48.6%的患者因多个破口等原因需置入两个或多个支架。本组病例通过破裂口数值测量推测支架长度及数量与术后一致。
3.2.2 手术入路 AD介入治疗通常选取双侧股动脉作为入路,要求患者至少一侧髂股动脉无夹层分离,且管腔无严重狭窄(>0.8cm)或扭曲等。扩大MSCTA检查范围,详细检测及测量双侧髂股动脉管壁及管径能为介入治疗入路选择提供有益信息,本组1例合并双侧髂股动脉粥样斑块形成,管腔直径<0.8cm,不能经股动脉入路,最终采取经腹主动脉入路(图3)。其余病例均由股动脉入路。
3.3 介入支架置入术后预判 介入支架置入术后可能出现截瘫、内漏、支架移位、再撕裂、动脉瘤变等并发症。内漏、支架移位、再撕裂、动脉瘤变机制繁多,MSCTA术前预判较为困难,本组病例术后未见相关并发症。主动脉夹层支架置入术后截瘫发生率为0~1.6%,考虑与支架阻塞相关肋间动脉,导致起源于 T9~L2水平肋间动脉的脊髓根大动脉闭塞引起脊髓梗死所致,故术中应尽量避开这些肋间动脉,并尽量缩短覆膜支架的长度,以预防截瘫的发生[12],术前VR能够观察椎体与主动脉之间整体关系,对支架是否可能覆盖T9~L2水平肋间动脉有充分预判(图4)。

图3 男性,55岁,Stanford B型患者。A.左侧股动脉管腔直径<8mm,右侧股动脉管腔符合支架置入条件;B.向上层面显示右侧髂血管闭塞(箭头示)。最终患者选用经腹主动脉血管穿刺作为介入入路
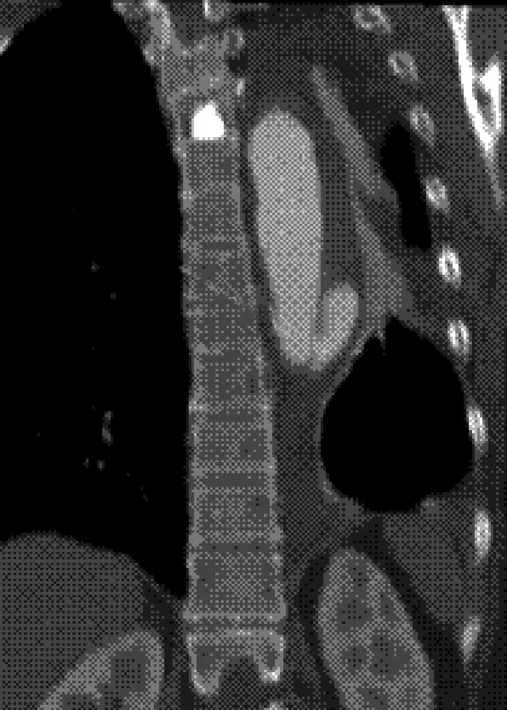
图4 男性,67岁,Stanford B型患者。MPR显示破裂口位于约T7水平(箭头示),提示临床最终介入选用尽量短的血管覆膜支架,以避免T9~L2水平展开
通过本组病例,我们认为MSCTA对Stanford B型 AD支架置入术前的评估及术后预判具有重要作用,并初次将各种繁多的MSCTA测量数值及征象按诊疗过程进行分类,希望能得出系统规律的诊断方法。其次,为方便手术入路评估,我们认为可适当扩大扫描范围至双侧股动脉起始部水平。
[1] Hayter RG, Rhea JT, Small A, et al. Suspected aortic dissection and other aortic disorders multi-detect or row CT in 373 cases in the emergency setting.Radiology, 2006, 238(3): 841-852.
[2] 张灿, 周运锋. MSCT对主动脉夹层的诊断价值. 放射学实践, 2009, 24(5): 480-483.
[3] Nienaber CA, Fattori R, Lund G, et al. Nonsurgical reconstruction of thoracic aortic dissection by stentgraft placement.N Engl J Med, 1999, 340(20): 1539-1545.
[4] Shimono T, Kato N, Yasuda F, et al. Transluminal stentgraft placements for the treatments of acute onset and chronic aortic dissections.Circulation, 2002, 106(12): 1241-1247.
[5] 秦卫和, 陈燕萍. 主动脉夹层真假腔的多层螺旋 CT特征. 中国医学影像学杂志, 2009, 17(5): 353-356.
[6] Vedantham S, Picus D, Sanchez LA, et al. Percutaneous management of ischemic complications in patients w ith type-B aortic dissection. Vasc Interv Radiol, 2003, 14(3): 181-185.
[7] 徐浩, 祖茂衡. 经皮开窗术治疗主动脉夹层引起的缺血.中华放射学杂志, 2005, 39(9): 906-910.
[8] Eggebrecht H, Baumgart D, Herold U, et al. Interventional management of aortic dissection. Herz, 2002, 27(6): 471-539.
[9] 黄连军, 杨剑. 腔内覆膜支架治疗B型主动脉夹层对腹部分支血管供血的影响. 中华放射学杂志, 2005, 36(6): 657-660.
[10] 张曦彤, 张强. 血管内支架移植物置入术治疗 Stanford B型主动脉夹层. 中国医学影像技术, 2004, 20(6): 925-928.
[11] Palma JH, de S ouza JA, Rodrigues A lves CM, et al. lf-expandable aortic stent-grafts for treatment of descending aortic dissections. Ann Thorac Surg, 2002, 73(4): 1138-1141.
[12] Dake MD. Endovascular stent-graft management of thoracic aortic diseases. Eur Radiol, 2001, 39(1): 42-49

