黑木耳菌丝原生质体的制备﹑再生及单核鉴定研究
许修宏,孟 琦,刘华晶,李 亮
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.黑龙江省农业科学院大庆分院,黑龙江 大庆 161090)
黑木耳(Auricularia auricula)又称木耳、细木耳、光木耳、云耳,分类上属担子菌纲,银耳目,木耳科,木耳属。它是我国主要栽培的食用菌之一[1]。
1972年荷兰Vessels首次用裂解酶分离了褶皱菌原生质体。原生质体技术开始应用于食用菌研究领域[2]。近年来,原生质体技术取得了较大进展,而原生质体的制备与再生是研究原生质体融合及单核杂交技术的前提条件。本文研究了黑木耳菌丝分离原生质体的主要酶解条件,再生条件及单核化,为以后培育新品种及基因工程研究等奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
黑木耳菌株黑29由黑龙江省微生物所提供。
1.1.2 培养基
PDA液体培养基:马铃薯200 g(煮汁),葡萄糖 20 g,蛋白胨 3 g,KH2PO43 g,MgSO4·7H2O 2 g加水至1 000 mL用于原生质体前菌丝的培养。
液体再生培养基:马铃薯200 g(煮汁),葡萄糖20 g,蛋白胨 3 g,KH2PO43 g,MgSO4·7H2O 2 g,酵母膏2 g,维生素B110 mg,甘露醇109.3 g加水至1 000 mL用于原生质体孵育。
原生质体再生培养基:
RM1:马铃薯200 g,葡萄糖20 g;琼脂20 g加水至1 000 mL;
RM2:马铃薯200 g,葡萄糖20 g,KH2PO43 g,蛋白胨3 g,MgSO4·7H2O 2 g,琼脂 20 g加水至1 000 mL;
RM3:马铃薯200 g,葡萄糖20 g,KH2PO43 g,蛋白胨 3 g,MgSO4·7H2O 2 g,酵母膏 2 g,琼脂20 g加水至1 000 mL;
RM4:马铃薯200 g,葡萄糖20 g,KH2PO43 g,蛋白胨3 g,MgSO4·7H2O 2 g,酵母膏2 g,维生素B110 mg,琼脂20 g加水至1 000 mL;
RM5:马铃薯200 g,葡萄糖20 g,蛋白胨3 g,KH2PO43 g,MgSO4·7H2O 2 g,酵母膏 2 g,维生素B110 mg,甘露醇109.3 g,琼脂20 g加水至1 000 mL用于原生质体再生;
PDA综合培养基:马铃薯200 g,葡萄糖20 g,KH2PO43 g,蛋白胨 3 g,MgSO4·7H2O 2 g,琼脂20 g加水至1 000 mL。
1.1.3 酶制剂
溶壁酶由广东微生物所提供。
1.1.4 试剂
KCl、MgSO4、蔗糖、甘露醇浓度:用 0.05 mol·L-1pH 5.8的磷酸盐缓冲液配制;酶液:用0.05 mol·L-1pH 5.8的磷酸盐缓冲液配制 0.6 mol·L-1MgSO4,然后用MgSO4溶液配置酶溶液。
1.2 方法
1.2.1 菌丝培养
将试管斜面菌丝块接种于装有150 mL PDA液体培养基三角瓶中,25℃摇床培养(121 r·min-1)7~11 d。
1.2.2 原生质体的制备
无菌条件下收集黑29菌丝体,无菌水冲洗1次,用 0.6 mol·L-1MgSO4高渗液冲洗后,5 000 r·min-1,离心 10 min,收集的菌丝用 0.6 mol·L-1MgSO4高渗液再冲洗 1 次,5 000 r·min-1,离心 10 min,用无菌滤纸吸干水分。酶液用0.22 um微孔过滤膜过滤后,按菌丝体∶酶液=1∶2(m∶V)的比例添加酶液,震荡2 min,混匀,在不同温度下振荡酶解不同时间,无菌条件下用无菌脱脂棉过滤,无菌管收集滤液,用0.6 mol·L-1MgSO4高渗液冲洗2次,5 000 r·min-1离心 5 min,沉淀用 0.5 mol·L-1MgSO4稳渗剂洗涤离心,5 000 r·min-1,5 min 2次,用0.5 mol·L-1MgSO4稳渗剂稀释至一定体积后,血球计数板计算原生质体数量。
1.2.3 原生质体制备最佳条件的选择
以黑29为供试菌株在不同酶浓度、酶解时间、酶解温度、渗透压稳定剂种类及其浓度、菌龄、条件下进行酶解脱壁,根据原生质体数确定最佳条件。
1.2.4 原生质体再生培养基的选择
将制备的原生质体溶液稀释至2×104个·mL-1后加入等体积的液体再生培养基,25℃静置孵育24 h,取孵育好的原生质体0.1 mL涂培养皿,使每培养皿原生质体数目达到103个,采用不同的再生培养基,25℃下静置培养15~20 d,观察培养皿中的再生菌落数。
原生质体再生率计算:再生率(%)=再生菌落数/原生质体总数×100%。
1.2.5 渗透压稳定剂对原生质体再生的影响
选择不同的渗透压稳定剂稀释原生质体后涂皿,25℃下静置培养20 d,观察平皿中的再生菌落数。
1.2.6 原生质体再生菌株的培养
挑取涂布于再生培养基中萌发的菌落,于PDA斜面上25℃培养10 d,将所获得的菌株编号,4℃保藏备用。
1.2.7 单核鉴定
挑取原生质体再生的菌丝接种到PDA综合培养基的平皿上,25℃静止培养。待菌丝长满整个平皿后,用剪刀剪边长1 cm的正方形大小的透明胶布,用其粘平皿内的菌丝并在显微镜下观察。
2 结果与分析
2.1 不同酶浓度对原生质体数量的影响
选择1.0%、1.5%、2.0%、2.5%、3%五种不同的溶壁酶浓度,水浴处理黑木耳菌丝体,结果为:浓度为1.0%、1.5%、2.0%、2.5%、3.0%溶壁酶产生的原生质体数量分别为 8.4×107、9.8×107、11.5×107、10.9×107、10.2×107个·mL-1。浓度 2.0%效果最好,2.5%~3%次之。由此可知,在其他条件不变的情况下,原生质体的数量随酶浓度的增大而增加,但达到一定产量后,没有明显改变。酶中有对原生质体有害的酶类,随着酶量的增加,杂酶的浓度也会随之增加,当达到一定浓度后,会影响原生质体的活性。酶浓度过高会使酶体脱壁过于彻底,会影响原生质体的再生能力。
2.2 不同的酶解时间对原生质体数量的影响
由图1可见,在其他条件不变的情况下,原生质体的数量在酶解4 h时产量达到最高,最高值为11.5×107个·mL-1。4 h 后原生质体的数量基本无明显降低。若酶解时间过长原生质体的产量和再生率都会降低,可能是因为脱壁的时间太久或杂酶的影响。
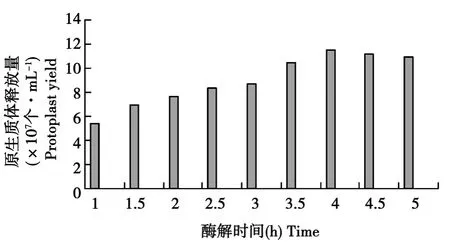
图1 酶解时间对原生质体释放量的影响Fig.1 Effect of digesting time on protoplast yield
2.3 温度对原生质体产量的影响
黑木耳菌丝加入2.0%的溶壁酶后分别放入27、29、31、33、35℃的水浴中酶解4 h。由图2可见,浴温度在31℃时原生质体的数量最多,温度太高或太低对原生质体的数量都会有影响,原因可能是酶的温度过高或过低会影响酶的活性。酶解温度依不同的食用菌和不同的酶而有所不同,对于一般食用菌来讲,一般酶解温度在28~35℃,温度太高或太低多不利于原生质体的释放。在低于最适酶解温度时,随着温度的升高,原生质体制备率不断提高;高于最适酶解温度时,原生质体的产量明显减少。在本试验中,水浴温度在31℃时原生质体的数量最多,在27~31℃之间,随着温度的增加原生质体产量逐渐升高,在31~35℃之间,原生质体产量随着温度的增高而降低。
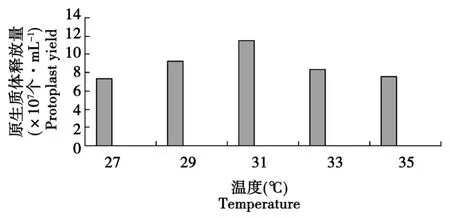
图2 温度对原生质体产量的影响Fig.2 Effect of enzymolysis temperature on protoplast yield
2.4 渗透压稳定剂及其浓度对原生质体数量的影响
分别用KCl、MgSO4、蔗糖、甘露醇作为稳渗剂,并分别用 0.3、0.5、0.7 mol·L-1浓度对其处理。由图3可见,0.5 mol·L-1的MgSO4做稳渗剂原生质体的产量最高。脱去了细胞壁的原生质体是很脆弱的,如果胞外的渗透压比胞内的低,再生质体就会因吸水而涨破,所以,需要特定的高渗溶液来悬浮原生质体,这类高渗液就是渗透压稳定剂。

图3 渗透压稳定剂种类及其浓度对原生质体释放量的影响Fig.3 Effect of osmotic pressure stabilizer and its concentration on protoplast yield
无机盐做渗透压稳定剂较糖及醇合适,这与制备真菌原生质体的多数报导相一致。
2.5 菌龄对原生质体数量的影响
由图3可见,培养了8 d的菌丝原生质体数量最高。其次分别为7、9、10 d。菌龄影响菌体生理状态如细胞壁的结构、菌体的代谢水平与菌体的活力,从而影响原生质体形成与再生。从形态学上看,新合成的细胞壁物质淤积在菌丝的顶尖部位,而新生的细胞壁较薄,易于被降解,所以在菌丝生长速度最快的时期是原生质体释放最有利的阶段。培养时间较短的菌丝体,菌丝生长量不够。不易制得较多原生质体,而培养时间过长,菌体老化,细胞壁加厚,比较牢固,不易被酶解。菌体的不同生理状况直接影响到细胞壁的结构及菌体的活力等,它是影响原生质体产量的内在因素。

图4 菌龄对原生质体产量的影响Fig.4 Effect of culture time on protoplast yield
2.6 再生培养基对原生质体再生率的影响
结果见图5~6。

图5 最佳条件下原生质体Fig.5 Highest yield of protoplast
RM1、RM2、RM3、RM4、RM5培养基原生质体的再生率分别为0.88%、1.27%、1.40%、1.42%、1.63%。其中RM5再生率最高。原生质体的再生包括细胞壁的再生和复原,在分离的原生质体中,有的带有细胞核,有的没有细胞核,只有具有细胞核的原生质体才能再生出新的细胞壁进而恢复成为一个完整的具有胜利功能的细胞。影响原生质体再生的因素很多,例如原生质体自身的活性,原生质体自身的状态,再生是的培养条件等。本试验通过调整再生培养基的组分,往里面加一些适于作为细胞壁合成前体的物质或可加速细胞合成的营养因子来培养原生质体。
图6 原生质体再生菌株Fig.6 Protoplast regeneration
2.7 渗透压稳定剂对原生质体再生率的影响
分别选用不同的渗透压稳定剂观察原生质体的再生率,蔗糖作为渗透压稳定剂再生率为1.59%,甘露醇做渗透压稳定剂再生率为1.55,硫酸镁做渗透压稳定剂再生率为1.63%,氯化钾做渗透压稳定剂再生率达1.43%。结果表明硫酸镁做渗透压稳定剂再生率最高。
2.8 再生菌丝单核化
双核菌丝及单核菌丝表达见图7~8。单核菌丝经过3代培养后观察菌丝形态,若仍是单核菌丝即可用于培育新品种及基因工程方面的研究。单核体菌丝生长速度通常慢于双核体,且菌丝较稀疏,气生菌丝相对旺盛。通过锁状联合观察较容易对再生菌株的单核或双核菌丝进行判断。

图7 双核菌丝Fig.7 Nuclei of A.auricula dikaryons
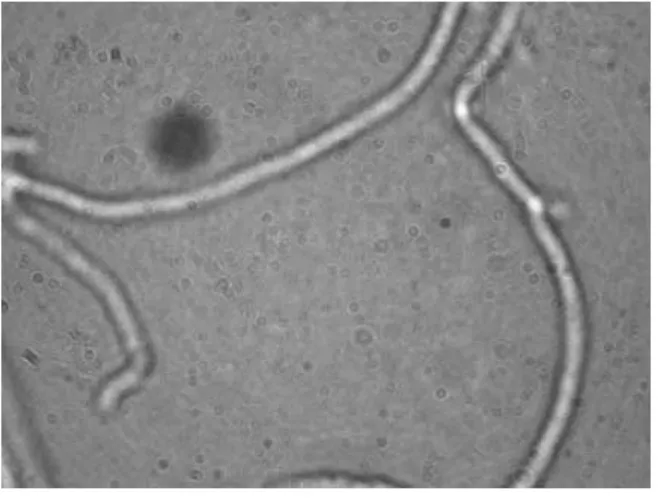
图8 单核菌丝Fig.8 Nuclei of A.auricula monokaryons
3 讨 论
影响原生质体数量的因素大小依次为酶解温度酶浓度、菌龄和酶解时间。选择RM5培养基及硫酸镁为渗透压为稳渗剂原生质体再生率较高。影响原生质体再生的因素还有很多,例如,原生质体本身的活性,原生质体制备的状态,操作方式等都必须考虑。原生质体在结构上并不完全等同于缺失了细胞壁的细胞,可能造成许多结果和功能上的改变,从而影响了自身的活力,造成再生能力的差异。
4 结论
在本研究中,通过对黑木耳原生质体的分离、再生以及对再生后的菌丝单核体的鉴定。试验结果表明:液体培养 8 d,以 0.6 mol·L-1MgSO4·7H2O作渗透压稳定剂,加入2.0%溶壁酶在31℃下酶解4 h,分离原生质体效果最佳,原生质体产量可达11.5×107个·mL-1。对五种不同再生培养基进行比较试验。结果表明,再生培养基配方为马铃薯200.0 g,葡萄糖 20.0 g,蛋白胨 3.0 g,KH2PO43.0 g,MgSO4·7H2O 2.0 g,酵母膏 2.0 g,维生素B110.0 mg,甘露醇109.3 g,琼脂20.0 g加水至1 000 mL的再生培养基原生质体再生率最高,再生率可达1.63%。
[1]汪兴安.黑木耳段木栽培[J].安徽林业,2001(4):19.
[2]Vriesomh D E,Wessels J G H.Release of prot oplasts f rom Schizop hyllum commune by a lyticenzyme p rep aration f rom Trichoderma viride[J].J Gen Microbiol,1972,73:13222.
[3]何培新.木耳原生质体技术的研究及应用[J].河南职技师院学报,2001(2):21.
[4]刘祖同,罗信昌.食用蕈菌生物技术及应用[M].北京:清华大学出版社,1999.
[5]张卉,刘长江.姬松茸原生质体形成和再生的研究[J].微生物学杂志,2003(23):18.
[6]鹿桂花.食用菌原生质体技术的研究进展[J].生物技术,2008,18(1):87.
[7]刘方.灵芝原生质体单核化杂交育种[D].福州:福建农林大学,2009:22-32.
[8]韩增华,张丕奇,戴肖东,等.黑木耳原生质体制备、再生及单核体荧光鉴定[J].食用菌学报,2008,15(3):13-17.
[9]孙溪,郭成金.双胞蘑菇原生质体制备条件的优化[J].天津师范大学学报:自然科学版,2006,26(4):32-35.
[10]李楠,许修宏.黑木耳原生质体制备及再生的研究[J].东北农业大学学报,2009(7):47.
[11]李琳,周国英,刘君昂,等.双胞蘑菇遗传育种研究进展[J].食用菌学报,2007,14(1):62-66.
[12]江力,刘国庆,窦伟.茶树菇原生质体制备及融合研究[J].食品科学,2008,348-351.
[13]孙剑秋,周东坡.微生物原生质体技术[J].生物学通报.2002,37(7):9-11.
[14]李刚,李宝健.灵芝原生质体分离与再生研究[J].菌物系统,1999,18(1):79-88.
[15]梁枝荣.香菇原生质体分离诱变育种研究[J].微生物学通报,2001,28(2):38-39.
[16]司梦琦,彭强,许修宏.不同黑木耳菌株在松木屑培养基上菌丝生长和子实体产量研[J].东北农业大学学报,2009(5):42-45.
——2017年渗透压相关高考真题赏析
- 东北农业大学学报的其它文章
- 哈尔滨市水资源预警模型研究(I)——基于时差相关分析法的区域水资源预警指标体系构建

