鼻咽癌调强适形放疗中正常器官体积剂量变化的研究
王震吾,王明智,杨 波,楚建军
(苏州大学附属第四医院肿瘤放疗科,江苏无锡,214062)
鼻咽癌(NPC)调强适形放疗(IMRT)因能高度适合靶区形状的剂量分布,在明显提高靶区平均剂量的同时,大大降低重要器官的照射剂量,在临床上得到广泛的应用。调强放射治疗计划的设计多是依据治疗前瞬间获取的影像学CT、MRI、PET-CT等图像来设计的,一般情况一个IMRT计划运用至全程放疗结束。但是,随着剂量的累加,诸多因素会发生相应的变化,如原发肿瘤会逐渐退缩、腮腺体积退缩、患者体质量下降、轮廓改变等而引起周围正常组织也会产生相应的空间位置变化[1-6]。为此,作者在2009年2~7月进行IMRT的鼻咽癌患者在放疗至20次时重新CT扫描,复制第1次的GTV、CTV,而正常器官重新勾画,使用原计划侧重观察正常器官的体积和剂量的变化,旨在探讨在鼻咽癌患者的调强放疗过程中是否有必要行重复CT扫描和重新计划,实行分阶段设计治疗计划的可能,现将研究结果报告如下。
1 临床资料与方法
1.1 主要设备
美国Varian公司的23EX医用直线加速器(配备120叶多叶准直器)、Eclipse治疗计划系统和ARIA8.6网络;美国CMS公司的Xio治疗计划系统;美国Picker公司的PQS-单排螺旋CT;比利时ORFIT公司的头颈肩固定架及EFFCAST热塑面罩,日本东芝公司的 LX-40A医用模拟定位机等。
1.2 一般资料
2009年2~7月本院首治经鼻咽活检和CT/MRI诊断为鼻咽癌患者20例,其中男14例;女6例,年龄32~81岁,中位年龄56岁。全部标本经病理活检为低分化鳞癌,所有患者放疗前KPS评分>70分。临床分期按1992年福州分期的标准,T1、T2、T3、T4分别为 4 、12、4、0 例 ,N0、N1、N2、N3分别为 2、4、11、3例,TNM 分期 :Ⅰ 、Ⅱ、Ⅲ、Ⅳ期分别为 1、3、13、3例。放疗前常规胸片、腹部B超、骨扫描等影像学检查,排除远处转移。
1.3 方法
1.3.1 体位固定及CT扫描要求:患者取仰卧位,双手置体侧,以热塑网膜固定体位。扫描从颅顶到隆突分叉水平,病灶区层厚3 mm,其余层厚5 mm,增强扫描,扫描图像经过网络传送到美国CMS公司Xio三维治疗计划系统工作站主机中。
1.3.2 靶体积的定义、勾画和处方剂量:靶区定义参考ICRU50号和62号报告原则[7-8],GTVnx为增强CT/MRI和鼻咽癌显示的鼻咽部肿块和咽后淋巴结;GTVnd为增强CT/MRI和临床确定的颈部转移淋巴结,CTV1包括鼻咽、颅底、咽旁间隙、翼腭窝、上颌窦和高危淋巴引流区,CTV2为颈部淋巴结预防照射区,PTV是CTV的基础上外放3~5 mm。20例鼻咽癌患者均接受根治性放疗,鼻咽、全颈和锁骨上区全程均实施9野的IMRT,各靶区处方剂量均以其PTV定义给予,肿瘤靶区给予剂量68~78 Gy,鼻咽区及上颈部临床靶区给予剂量分别为60~66 Gy、下颈部锁骨上区域给予剂量分别为54~60 Gy,GTVnx,GTVnd的分次剂量为2.12~2.2 Gy,33次,5次/周,1次/d。
1.3.3 正常器官勾画和限制剂量:在横断面CT扫描图上逐层勾画正常器官,包括眼球、晶体、视神经、视交叉、垂体、腮腺、颞颌关节、脑干、脊髓等。一般危及器官限制剂量100%的体积为:脊髓≤45 Gy、脑干≤54 Gy、颞叶≤54~60 Gy、垂体≤45 Gy、视交叉 ≤54 Gy、视神经 ≤54 Gy、腮腺50%的体积≤30~35 Gy、而眼球、晶体剂量应尽可能小。
1.3.4 治疗计划制定、评价和验证、实施:治疗计划系统根据要求进行9个野共面逆向治疗计划设计:①靶区体积的剂量要求V95≥95%;②PTV接受>110%的处方剂量的体积应<20%;③PTV接受<93%的处方剂量的体积应<3%;④PTV以外的任何地方不能出现>110%的处方剂量。治疗计划评价后,经物理师和医师确认并进行精度、剂量学验证,验证合格后实施治疗计划。
1.3.5 重新CT扫描和重新设计计划:在调强放疗20次后,按原固定体位和参考坐标重新CT扫描,参照第1次计划CT上的靶区在新CT上复制勾画GTV和CTV,而正常器官重新勾画,研究腮腺、脑干、脊髓、眼球、晶体和视神经等正常器官的体积和照射剂量的改变。在第2次CT扫描上按原计划参数重新逆向计划计算,得到计划2,拷贝放疗前计划1至重新CT扫描上得到比较计划1-2,计划2和计划1-2仍给予相同根治剂量。
1.3.6 数据获取:IMRT治疗前及放射20次后,记录两次CT扫描上腮腺位移、轮廓横径变化情况。腮腺位移:选取枢椎体即枢椎齿突第一层面与体中线交界处(C2)作为参考点,记录左右腮腺内侧位置以及前后、左右轮廓横径。在DVH图上获取:各正常危及器官的体积、最大剂量(Dmax)、平均剂量(Dm)、腮腺50%体积所受的剂量(D50)、大于26 Gy腮腺体积(V26)、大于35 Gy腮腺体积(V35)、1 cm3脊髓和脑干组织所受的剂量(Dlcc)。在制定第2次计划时,保证重新计划与第1次逆向计划制定时的射野中心,目标函数,处方剂量归一点都相同。
2 结 果
2.1 腮腺、轮廓横径和体质量的变化
IMRT 20次后,在C2水平横断面上,左腮腺的外界位置向内减少0.2~1.7cm(2.99%~21.79%,P=0.000),右侧减少0.5~0.6 cm(7.81%~7.79%,P=0.001),左右轮廓横径减少0.80~2.20cm(5.06%~12.72%,P=0.003),体重下降1.5~12kg(3.66%~15.38%,P=0.000),具有统计学意义。左右腮腺的内界位置、前后轮廓横径变化不大(表1)。
2.2 IMRT中正常器官体积的变化
20例鼻咽癌患者IMRT过程中,观察正常器官(眼球、晶状体、腮腺、视神经、脊髓和脑干)的体积变化,发现放疗20次与放疗前腮腺总体积VT明显变化。左腮腺体积缩小 0.02~22.69 cm3(0.12%~52.93%,P=0.001),平均缩小5.83 cm3;右腮腺绝对体积缩小0.19~21.25 cm3(1.15%~51.16%,P=0.000),平均缩小6.73 cm3(24.73%)。其余正常器官在放疗中体积变化不明显(表2)。
表1 调强放疗前与20次时腮腺位置和轮廓横径变化情况(±s)
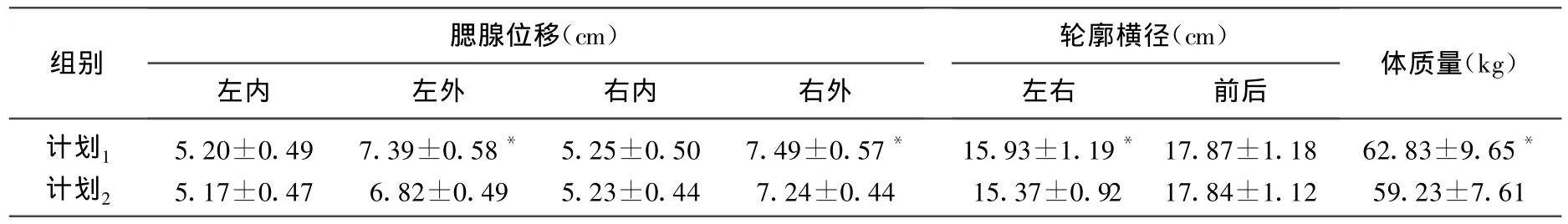
表1 调强放疗前与20次时腮腺位置和轮廓横径变化情况(±s)
*P<0.05。
腮腺位移(cm)轮廓横径(cm)组别体质量(kg)左内 左外 右内 右外 左右 前后计划1 5.20±0.49 7.39±0.58* 5.25±0.50 7.49±0.57* 15.93±1.19* 17.87±1.18 62.83±9.65*计划2 5.17±0.47 6.82±0.49 5.23±0.44 7.24±0.44 15.37±0.92 17.84±1.12 59.23±7.61
表2 计划1与计划1-2中正常器官总体积VT(cm3)的比较(±s)
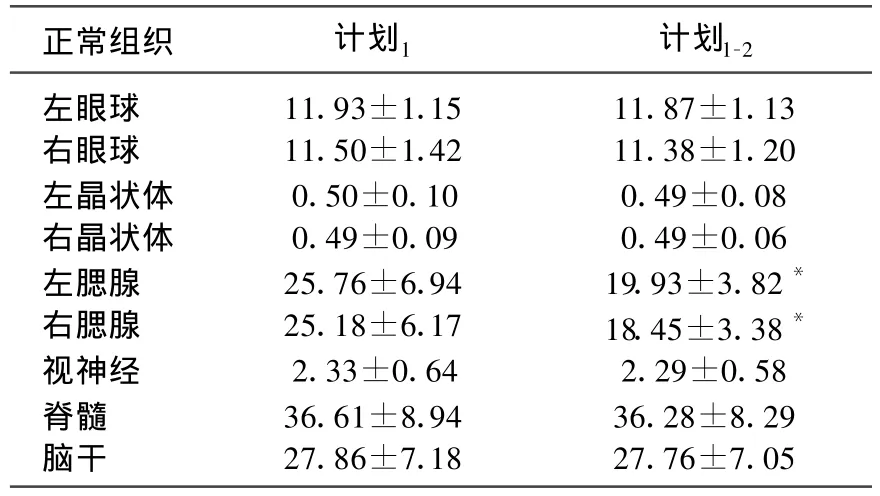
表2 计划1与计划1-2中正常器官总体积VT(cm3)的比较(±s)
正常组织 计划1 计划1-2左眼球 11.93±1.15 11.87±1.13右眼球 11.50±1.42 11.38±1.20左晶状体 0.50±0.10 0.49±0.08右晶状体 0.49±0.09 0.49±0.06左腮腺 25.76±6.94 19.93±3.82*右腮腺 25.18±6.17 18.45±3.38*视神经 2.33±0.64 2.29±0.58脊髓 36.61±8.94 36.28±8.29脑干 27.86±7.18 27.76±7.05
2.3 IMRT中正常器官剂量的变化
对计划1和计划1-2比较分析,正常器官中腮腺、脊髓、脑干剂量增大具有统计学意义。左侧腮腺最大剂量Dmax增加1.19~7.75 Gy(1.85%~12.76%,P=0.015),平均剂量Dm增加1.59~5.04 Gy(4.99%~17.24%,P=0.026);右侧腮腺Dmax增加2.72~7.46 Gy(4.18~12.07%,P=0.011),Dm增加2.49~6.84 Gy(7.42%~23.77%,P=0.023);脊髓Dmax增加1.33~8.14 Gy(3.25%~20.23%,P=0.019),Dm增加0.14~6.31Gy(0.48%~31.05%,P=0.028);脑干Dmax增加 0.17~7.71 Gy(0.38%~17.16%,P=0.011)。其余正常器官或相关指标变化不明显,见表3。
表3 计划1与计划1-2中正常器官最大剂量Dmax(Gy)和平均剂量 Dm(Gy)的比较(±s)

表3 计划1与计划1-2中正常器官最大剂量Dmax(Gy)和平均剂量 Dm(Gy)的比较(±s)
*P<0.05。
正常组织Dmax(Gy)Dm(Gy)计划1 计划1-2计划1 计划1-2左眼球 24.02±5.87 24.15±5.74 7.65±2.05 7.68±2.04右眼球 22.52±5.30 22.59±5.18 7.64±1.77 7.70±1.74左晶状体 5.17±0.66 5.19±0.62 4.03±0.67 4.05±0.63右晶状体 5.36±1.12 5.43±0.98 4.34±0.90 4.39±0.81左腮腺 63.84±2.70 65.23±3.25* 32.47±2.71 33.34±2.52*右腮腺 64.18±2.41 65.69±3.02* 31.86±3.36 32.92±3.61*视神经 50.13±8.97 50.86±9.08 25.71±5.94 26.05±5.92脊髓 42.03±2.36 43.38±3.24* 25.65±3.00 26.65±3.36*脑干 46.65±3.85 48.14±4.45* 34.09±2.62 34.50±2.45
继续观察腮腺、脊髓和脑干的其他相关剂量指标,其中腮腺的D50、V30和脊髓的 D1cc增加明显,具有统计学意义,而腮腺的 V26和脑干的D1cc变化无统计学意义,见表4。对表3中剂量有变化的腮腺、脊髓和脑干进一步观察,发现计划2中剂量比计划1-2下降,调整至计划1的水平,说明重新计划能够降低正常器官在 IMRT中由于解剖位置变化引起剂量的增加,见表5。
表4 计划1与计划1-2中腮腺、脊髓和脑干剂量其他相关指标的比较(±s)
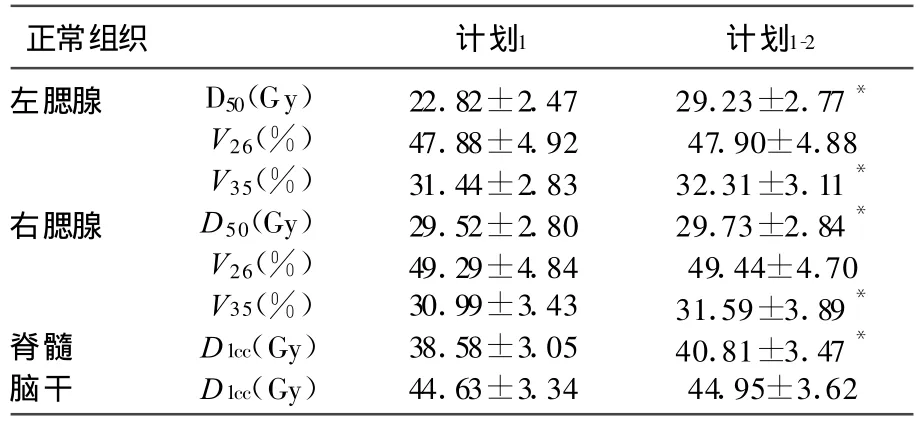
表4 计划1与计划1-2中腮腺、脊髓和脑干剂量其他相关指标的比较(±s)
*P<0.05。
正常组织 计划1 计划1-2左腮腺 D50(Gy) 22.82±2.47 29.23±2.77*V26(%) 47.88±4.92 47.90±4.88 V35(%) 31.44±2.83 32.31±3.11*右腮腺 D50(Gy) 29.52±2.80 29.73±2.84*V26(%) 49.29±4.84 49.44±4.70 V35(%) 30.99±3.43 31.59±3.89*脊髓 D1cc(Gy) 38.58±3.05 40.81±3.47*脑干 D1cc(Gy) 44.63±3.34 44.95±3.62
表5 计划2和计划1-2中腮腺、脊髓、脑干剂量(Gy)的比较(±s)

表5 计划2和计划1-2中腮腺、脊髓、脑干剂量(Gy)的比较(±s)
*P<0.05。
Dmax(Gy)Dm(Gy)正常组织 计划2 计划1-2计划2 计划1-2左腮腺 64.10±2.77 65.23±3.25* 31.89±2.65 33.34±2.52*右腮腺 63.83±2.48 65.69±3.02* 32.33±3.52 32.92±3.61*脊髓 42.39±2.44 44.23±3.98* 26.11±2.83 26.65±3.36*脑干 47.96±4.16 48.14±4.45 34.27±2.62 34.50±2.45
2.4 相关性方面
鼻咽癌IMRT过程腮腺的受照剂量的增加与体重下降、左右轮廓减少、腮腺体积的缩小程度有一定关系,脊髓Dmax增加与左右轮廓减少程度相关(r=0.469,P=0.037)。脑干的最大剂量、脊髓最大剂量和平均剂量在放疗20次后变化都比较明显,但是与两侧腮腺总体积、体重和左右轮廓的变化程度无统计学相关性,详见表6。

表6 正常器官剂量增加与体重、左右轮廓、腮腺变化的相关性
腮腺、脊髓和脑干Dmax和Dm增加程度是计划1-2与计划1的比较。在与腮腺体积缩小程度相关性方面,左、右腮腺剂量增加程度分别与左、右腮腺体积缩小程度相比较,脊髓和脑干剂量增加程度与腮腺总体积减少程度相比较。
3 讨 论
鼻咽癌首选治疗为放疗,靶区大且极不规则,周围重要器官多且密集,常规照射的高剂量区很难与靶区一致,致使正常组织器官受照射剂量较高[7-8],而IMRT可产生高度适合靶区形状的剂量分布,即提高了靶区平均照射剂量的同时,明显降低了重要器官的照射剂量[9]。但是头颈部肿瘤在放疗过程中,许多患者的解剖结构、空间位置会发生变化,引起这些变化的原因包括放疗中出现水肿、放疗中由于放疗反应而导致患者体重下降、原发肿瘤和颈部转移淋巴结退缩等。同时由于肿瘤的退缩通常不对称,可以推测在放疗一段时间后肿瘤的形态、体积、位置,包括周围正常组织的解剖结构都可能会发生一定的变化。
本研究观察了20例初治鼻咽癌患者,将首次和调强放疗20次后重新CT扫描和重复计划所产生的DVH图进行比较分析,发现两侧腮腺在放疗过程中体积进行地缩小,两侧腮腺外界向内退缩,左右轮廓直径减小。国内外有类似的研究,例如曹建忠[6]等研究表明照射至25次,腮腺体积缩小0.13~23.80 cm3;Barker等[5]报道14例头颈部癌患者在放疗中腮腺的体积逐渐变小,平均每天减小0.1 cm3/d(范围0.04~0.84 cm3/d),且位置逐渐向内侧移动、平均移动3.1 mm(范围0~9.9 mm)。Hansen等[10]认为鼻咽癌患者放疗时,发现对有体质量明显下降及肿瘤退缩明显因素的患者,会出现靶区覆盖的明显下降和正常组织剂量的明显增加。提示放疗中不仅靶区而其正常器官如腮腺也存在着几何学形状及位置的变化。
作者观察放疗过程中Dmax和Dm的情况,腮腺、脊髓和脑干的剂量发生了比较明显的变化,腮腺是放射比较敏感的并联组织,部分体积在受到不均匀照射时有明显的剂量-体积关系,即平均剂量不大于26 Gy时腮腺的功能保护较好,随着时间的延长,功能可以恢复到放射治疗前的水平,上述剂量被称为“阀值剂量”,当平均剂量超过“阀值剂量”时,腮腺几乎不分泌唾液,随着时间推移,功能叶不能恢复[11-12]。本实验研究观察到放疗过程中,由于腮腺退缩,向内更高剂量区位移,腮腺受照射剂量和体积逐渐增大。通过重新CT扫描,重新计划和计划1-2相比较,明显重现计划在满足靶区覆盖的同时,降低了正常组织如腮腺、脊髓、脑干的剂量。
笔者研究发现,左、右腮腺的剂量增加分别与体重下降、左右轮廓减少和左、右腮腺的体积缩小程度有关,脊髓Dmax增加与左右轮廓减少程度相关(r=0.469,P=0.037)。调强放疗由于肿瘤和正常组织之间形成了陡峭的剂量梯度曲线,腮腺在放疗中体积向内移动退缩,致使腮腺逐渐向高剂量区移动,而腮腺缩小程度与体质量减小[5]、左右轮廓减少和原体积大小[6]呈正相关。A-hamad等[13]认为体质量每下降10%,同侧腮腺所受的平均剂量会增加6.1 Gy,并且使大于24 Gy和30 Gy的体积比初始计划高出10%以上,这些提示大腮腺、腮腺变化巨大或高体质量、左右轮廓减少明显的患者,可通过及时修改靶区,调正治疗计划来降低腮腺的受量。脑干的最大剂量、脊髓的最大剂量和平均剂量在放疗20次时增加比较明显,但是与腮腺总体积的缩小程度无统计学相关性,说明放疗中脊髓、脑干剂量的变化并非是由于腮腺体积退缩主要引起的,可能还有其他影响因素存在。国内外尚无此类详细的研究报道,因此尚需扩大病例数、多角度、更深入的研究加以证实。
[1] Sobel S,Rubin P,Keller B,et al.Tumor persistence as a predictor of outcome after radiation therapy of head and neck cancers[J].Int J Radiat Oncol Biol Phys,1976,1(9-10):873.
[2] Barkley H T,Fleteher G H.T he significance of residual disease after external irradiation of squamous-cell carcinoma of the oropharynx[J].Radiology,1977,124(2):493.
[3] Suit H D,WaIker A M.Assessment of the response of tumors to radiation:Clinical and experimental studies[J].Br Caneer,1980,41:1.
[4] Nguyen L N,Ang K K.Radiotherapy for cancer of the head and neck:Altered fractionation regimens[J].Lancet Oncol,2002,3(11):693.
[5] Barker J L Jr,Garden A S,Ang K K,et al.Quantification of volumetric and geometric changes occurring during fractionated radiotherapy for head-and-neck cancer using an integrated CT/linear accelerator system[J].Int J Radiat Oncol Biol Phys,2004,59(4):960.
[6] 曹建忠,罗京伟,徐国镇,等.鼻咽癌调强放疗中靶区和正常器官变化规律及临床意义探讨[J].中华放射肿瘤学杂志,2007,16(2):81.
[7] 袁智勇,高黎,徐国镇,等.初治鼻咽癌调强放疗的初步结果[J].中华放射肿瘤学杂志,2006,15(4):237.
[8] Bjordal K,Kasa S,Matekaasa A,et al.Quality of life in patients treated for head and neck cancer:A follow-up study 7 to 11 years after radiotherapy[J].Int J Radiat Oncol Biol Phys,1994,28(4):847.
[9] Cozzi L,Fogliata A,Bolsi A,et al.T hree-dimensional conformal vs.intensity-modulated radiotherapy in head and neck cancer patients:comparative analysis of dosimetric and technical[J].Int J Radiat Oncol Biol Phys,2004,58(2):617.
[10] Hansen E K,Bucci M K,Quivey J M,et al.Repeat CT imaging and replanning during the course of IM RT for head and neck cancer[J].Int J Radiat Oncol Biol Phys,2006,64(2):355.
[11] Eisbauch A,T en H R,Kim H M,et al.Dose,volume,and function relationships in parotid salivary glands following conformal and intensity modulated radiation therapy of head and neck cancer[J].Int J Radiat Oncol Biol Phys,1999,45(3):577.
[12] Eisbauch A,Ship J A,Dawson L A,et al.Salivary gland sparing and improved target irradiation by conformal and intensity modulated irradiation of head and neck cancer[J].World J Surg,2003,27(7):832.
[13] Ahamad A,Dong L,Zhang L,et al.Is There a Trigger Point for Adaptive Replanning During Head&Neck IMRT[J].Int J Radiat Oncol Biol Phys,2006,66(3):S100.

