巨噬细胞感染鼠伤寒沙门菌后NO表达及与胞内菌增殖的关系
李广波,潘 欣,李 晗,蔡家麟,赵子夜,吴鉴今
(1上海市血液中心,上海200433;2中国人民解放军第二军医大学微生物学教研室)
鼠伤寒沙门菌是重要的肠道致病菌[1],其在细胞内的感染、增殖及杀灭对疾病的发展和转归有重要意义[2]。该菌细胞壁的脂多糖与受感染细胞膜表面的受体结合以及感染到细胞内的细菌能引起细胞启动杀菌机制,其中诱导型一氧化氮合酶(iNOS)催化左旋精氨酸(L-Arg)产生的NO 是重要的杀菌物质之一。NO除本身具有杀菌活性外,它还氧化生成NO2、NO-2、N2O3和亚硝基硫醇等杀菌性活性氮中间物(RNI)。这些活性化合物与细菌的关键蛋白或脂质分子反应,杀灭和消化细菌。2009~2011年,我们分别采用野生型鼠伤寒沙门菌活菌和灭活菌感染鼠巨噬细胞,观察了感染后不同时间点感染细胞iNOS的表达情况,同时检测细胞培养液NO浓度以及活菌感染时细胞内沙门菌增殖及细胞对细菌的杀灭情况,分析其随感染时间的变化及三者之间的关系。
1 材料与方法
1.1 材料 野生型鼠伤寒沙门菌(ATCC 14028,以下简称沙门菌)购于美国 ATCC;鼠巨噬细胞RAW264.7购于中国科学院上海细胞生物研究所。Trizol总RNA抽提试剂盒购于Invitrogen公司;核酸回收试剂盒购于北京博大泰克公司,RNA反转录试剂盒购于Fermentas;FastStart Universal SYBR Green Master购于罗氏公司;兔抗鼠伤寒沙门菌多抗为本室自备,羊抗兔IgG Alex Fluor 488二抗购于Invitrogen公司;引物由宝生物工程(大连)有限公司合成。SLAN实时荧光定量PCR检测仪购于上海宏石医疗科技有限公司;Olympus IX81荧光显微镜购于日本Olympus公司;Thermo Scientific A2型生物安全柜购于美国Thermo公司。
1.2 实验方法
1.2.1 沙门菌14028感染鼠巨噬细胞 沙门菌接种于LB液体培养基,37℃静置培养过夜(约16 h);灭活菌为培养细菌用4%多聚甲醛固定过夜后,用PBS洗20次,培养48 h证明无活细菌。鼠巨噬细胞RAW264.7用不含抗生素的DMEM完全培养基(含10%小牛血清)培养。沙门菌用PBS洗1次,用DMEM完全培养基洗2次,并悬浮于该培养基中,检测菌液OD600定量沙门菌浓度。沙门菌以MOI=20(即细菌∶细胞=20∶1)的比例感染细胞,以1 000 rpm×5 min室温水平离心细胞培养皿,37℃下在5%CO2培养箱培养1 h,然后用37℃预温的PBS洗3次,洗掉胞外游离菌,换含50 μg/ml庆大霉素的10%DMEM培养基继续培养1 h杀灭细胞外的沙门菌,1 h后用37℃预温的PBS洗3次,换含5 μg/ml庆大霉素的DMEM完全培养基继续培养到相应时间点,活菌感染和灭活菌感染均在指定时间点即感染后1、4、8、12、24 h取样行相关指标检测。
1.2.2 细胞内细菌计数 7.5×105个RAW264.7细胞接种于6孔板的无菌盖玻片上,细胞感染MOI为20的ST,在给定感染时间内用含4%多聚甲醛的PBS室温固定细胞20 min,用PBS洗3次,用0.5% Triton X-100(Sigma)PBS透化1 h,1 h后用PBS洗3次;用Image-iT FX信号增强剂(Invitrogen)封闭30 min,用PBS洗3次;然后加入1∶1 000 PBS稀释的兔抗鼠伤寒沙门菌14028一抗,37℃标记2 h后转入4℃冰箱标记过夜。次日取出标本,室温复温1 h后用PBS洗3次;加入1∶1 000 PBS稀释的羊抗兔Alex Fluor 488,37℃避光标记2 h,用PBS洗3次,用灭菌双蒸水洗1次后,取出细胞爬片,避光晾干后在载玻片上用甘油封片,镜检。各时间点计数200个感染细胞内的细菌数。因灭活菌感染细胞后,细菌在细胞内不增殖,而被降解变小,计数时按细菌荧光染色体积大于0.5个完整细菌体积计数为1个。
1.2.3 细胞内生存菌计数 参照1.3.1方法以MOI为20的活菌ST感染细胞1 h。感染至指定时间后,用暖PBS洗3次,洗掉细胞外游离菌。加少量PBS,用细胞刮子刮取细胞,收集细胞悬液并混匀,取少量供细胞计数,另取1 ml,以2 000 rpm离心10 min,去上清后加入1 ml 0.1%Triton X-100 PBS混匀并裂解细胞20 min。取混悬液做系列稀释后接种LB平板,培养过夜。细胞内活菌数量=[(平板细菌菌落计数均值/接种混悬液体积)×接种混悬液稀释倍数]/混悬液细胞浓度。
1.2.4 iNOS mRNA表达检测 采用RT-PCR法。总RNA使用Trizol总RNA抽提试剂盒抽提,用Molecular Probes的 RiboGreen初步定量。荧光定量RT-PCR选择罗氏公司的FastStart Universal SYBR Green Master试剂盒,按说明书操作,在定量PCR反应体系中加入1 μl cDNA、正反向引物各167 nmol/ L、1×FastStart Universal SYBR Green Master,共计15 μl反应体系,使用上海宏石医疗科技有限公司的SLAN实时荧光定量PCR检测仪。检测各组参比基因GAPDH,调整各感染组参比基因GAPDH Cq值至指定点后,分别测定各组参比基因和目的基因iNOS的Cq值。每样本平行检测4次参比基因和目的基因,mRNA浓度差异使用公式2(△Cq目的基因-△Cq参比基因)计算。
1.2.5 细胞培养上清NO检测 细胞培养上清NO通过Griess试剂检测。Griess试剂A为5%磷酸配制的1%对氨基苯磺酰胺,试剂B为无菌双蒸水配制的0.1%盐酸萘乙二胺。使用前试剂A与B等体积混合成为Griess试剂。收集各指定时间点细胞培养上清,每200 μl加10 μl 30%硫酸锌去除蛋白,8 000 rpm离心10 min,取上清100 μl与等体积Griess试剂混合,37℃孵育10 min,于酶标仪上检测570 nm处吸光值。用亚硝酸钠标准品(125 μmol/ L)倍比稀释后,同样用Griess试剂测570 nm处吸光值绘标准曲线,样品NO浓度由标准曲线求得。
1.3 统计学方法 采用SPSS14.0统计软件。计量数据以±s表示,进行t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 细胞内细菌计数 活菌感染时细菌计数见图1,用灭活菌感染时细菌计数见图2。

图1 活菌感染时细菌计数
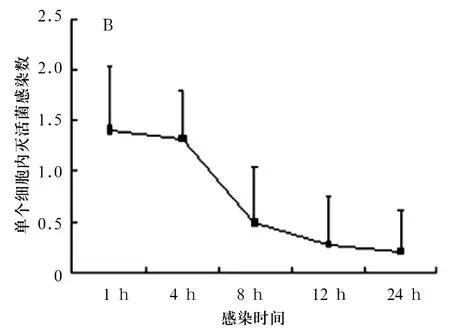
图2 灭活菌感染时细菌计数
2.2 iNOS mRNA转录水平和培养液中NO的检测
感染后1、4、8、12、24 h检测细胞的iNOS mRNA变化见图3,细胞培养液NO浓度变化见图4。

图3 细胞感染期间iNOS表达

图4 细胞感染期间培养上清NO浓度变化
3 讨论
沙门菌是重要的细胞内寄生菌。在其感染过程中,细菌由肠道扩散入血液、肠系膜淋巴结以及肝脾等器官,有时迁延不愈,易复发[3]。沙门菌可通过被动吞噬进入吞噬细胞,还可通过Ⅲ型分泌系统1 (TTSS1)分泌的效应因子 SipA、SipC、SopB/SigD、SopD、SopE2和SptP促进细菌快速侵入吞噬细胞和非吞噬细胞[4];通过菌毛的黏附等机制被细胞内吞[5]。活的沙门菌通过以上方式进入细胞,而灭活菌只是被动地被细胞吞入,因此在感染1 h时,细胞内活细菌计数明显高出灭活菌。
巨噬细胞是沙门菌感染的重要宿主,NO是巨噬细胞重要的效应分子,能增强巨噬细胞的杀菌和吞噬活性。细菌诱导巨噬细胞表达iNOS合成NO是通过有效接触和被吞噬实现的[6]。细菌LPS通过TLR NFkB通路以及细菌分解产物通过MAPK通路等促进感染细胞iNOS mRNA表达[7,8]。NO的合成是通过巨噬细胞表达iNOS催化L-精氨酸实现的。iNOS产生的活性氮中间物(RNI)对杀灭胞内致病菌如李斯特菌、结核分枝杆菌和沙门菌等非常重要[9,10]。沙门菌致病岛2(SPI2)在巨噬细胞内的表达依赖PhoQ,PhoQ传感器激酶能帮助降低iNOS产生的RNI对细菌的毒性。NO介导的对PhoQ表达的抑制,导致SPI2的表达受到抑制,起到促进SCV成熟并与溶酶体融合、促进细胞的杀菌活性,发挥抑制细菌增殖和降低沙门菌致病性的作用[11,12]。有文献报道当加入抑制剂抑制iNOS活性后细胞内沙门菌的增殖增长明显[13]。如果用能降低亚硝酸盐生成的沙门菌突变株感染鼠巨噬细胞,也表现出在细胞内增殖明显的迹象。沙门菌还存在阻碍宿主细胞杀菌的一些机制:SPI2表达的效应因子可以阻碍宿主细胞将iNOS运输到SCV;还有实验表明沙门菌感染诱导的精氨酸酶能从iNOS池中大量消耗L-精氨酸来竞争抑制iNOS从而减少RNI的产生,增加沙门菌在细胞内的生存及增殖。
综上所述,鼠伤寒沙门菌感染能有效引起鼠巨噬细胞iNOS表达,表达量与感染细菌数量关系不大,细胞内活的鼠伤寒沙门菌抑制细胞iNOS的表达及NO的生成。尽管临床应用抗生素能杀灭血液感染的沙门菌,但是能否渗透入细胞内的SCV尚不确定。当出现多重耐药性沙门菌感染时,沙门菌的治疗变得更加复杂,需要有更加有效的治疗方案。
[1]Chakravortty D,Hansen-Wester I,Hensel M.Salmonella pathogenicity island 2 mediates protection of intracellular Salmonella from reactive nitrogen intermediates[J].J Exp Med,2002,195(9): 1155-1166.
[2]Pan X,Tamilselvam B,Hansen EJ,et al.Modulation of iron homeostasis in macrophages by bacterial intracellular pathogens[J].BMC Microbiol,2010,(10):64.
[3]Salcedo SP,Noursadeghi M,Cohen J,et al.Intracellular replication of Salmonella typhimurium strains in specific subsets of splenic macrophages in vivo[J].Cell Microbiol,2001,3(9):587-597.
[4]McGhie EJ,Brawn LC,Hume PJ,et al.Salmonella takes control: effector-driven manipulation of the host[J].Curr Opin Microbiol,2009,12(1):117-124.
[5]Guo A,Lasaro MA,Sirard JC,et al.Adhesin-dependent binding and uptake of Salmonella enterica serovar Typhimurium by dendritic cells[J].Microbiology,2007,153(4):1059-1069.
[6]Chakravortty D,Hansen-Wester I,Hensel M.Salmonella pathogenicity island 2 mediates protection of intracellular Salmonella from reactive nitrogen intermediates[J].J Exp Med,2002,195(9): 1155-1166.
[7]Cherayil BJ,Antos D.Inducible nitric oxide synthase and Salmonella infection[J].Microbes Infect,2001,3(9):771-776.
[8]衰小林,张春蓄,李殷俊.巨噬细胞的激活及其信号传导机制的研究进展[J].国际免疫学杂志,2007,30(5);333-337.
[9]Nathan C,Shiloh MU.Reactive oxygen and nitrogen intermediates in the relationship between mammalian hosts and microbial pathogens[J].Proc Natl Acad Sci U S A,2000,97(16):8841-8848.
[10]Ohno H,Zhu G,Mohan VP,et al.The effects of reactive nitrogen intermediates on gene expression in Mycobacterium tuberculosis[J].Cell Microbiol,2003,5(9):637-648.
[11]McCollister BD,Bourret TJ,Gill R,et al.Repression of SPI2 transcription by nitric oxide-producing,IFNgamma-activated macrophages promotes maturation of Salmonella phagosomes[J].J Exp Med,2005,202(5):625-635.
[12]Bourret TJ,Song M,Vázquez-Torres A.Codependent and independent effects of nitric oxide-mediated suppression of PhoPQ and Salmonella pathogenicity island 2 on intracellular Salmonella enterica serovar typhimurium survival[J].Infect Immun,2009,77(11): 5107-5115.
[13]Vazquez-Torres A,Jones-Carson J,Mastroeni P,et al.Antimicrobial actions of the NADPH phagocyte oxidase and inducible nitric oxide synthase in experimental salmonellosis.I.Effects on microbial killing by activated peritoneal macrophages in vitro[J].J Exp Med,2000,192(2):227-236.
