肿瘤全抗原致敏的恶性胸水中肿瘤浸润免疫细胞的体外抗癌作用
黄 艳 王红阳 李球兵 刘信荣 喻昌利 刘 飒
(华北煤炭医学院附属医院呼吸内科,河北 唐山 063000)
肿瘤全抗原致敏的恶性胸水中肿瘤浸润免疫细胞的体外抗癌作用
黄 艳 王红阳 李球兵 刘信荣 喻昌利 刘 飒
(华北煤炭医学院附属医院呼吸内科,河北 唐山 063000)
目的 观察恶性胸水中肿瘤浸润免疫细胞中浸润树突细胞(TIDC)和肿瘤浸润T淋巴细胞(TIL)经过IL-2活化负载CALU-6腺癌细胞肿瘤全抗原后的体外抗癌作用。方法 分离恶性胸水单个核细胞(PEMCs),采用两步贴壁法获得非贴壁细胞,TIDC及TIL是其主要功能细胞成分。SP法检测TIL亚群的数量及免疫功能,SP法S-100蛋白染色检测TIDC。IL-2活化肿瘤浸润免疫细胞并负载CALU-6肿瘤细胞全抗原,MTT法分别检测活化的免疫细胞对CALU-6和GLC-82腺癌细胞的体外杀伤作用。结果 IL-2活化培养7 d后TIDC和TIL数量明显增加。恶性胸水肿瘤浸润免疫细胞(主要包括TIL和TIDC)经过CALU-6腺癌细胞肿瘤全抗原负载后,相同浓度对于CALU-6腺癌细胞杀伤明显,而对于GLC-82腺癌细胞无明显杀伤作用,两者比较差异具有显著意义(P<0.01)。结论 IL-2同时活化肿瘤微环境中TIL及TIDC,使其由一种无功能或功能低下状态恢复免疫监视功能,有效地负载肿瘤抗原,协同TIL等其他免疫细胞可以有效杀伤肿瘤细胞。活化恶性胸水免疫细胞自体回输治疗恶性胸水具有临床应用前景。
肿瘤浸润树突细胞;肿瘤浸润性淋巴细胞;恶性胸水
恶性胸水临床上常用的治疗方法是抽取胸腔积液,进行胸腔内化疗或生物治疗。恶性胸腔积液细胞成分丰富,含有多种免疫细胞,但是通常临床弃之不用。目前认为肿瘤微环境中抗原提呈细胞及效应细胞是肿瘤微环境的关键细胞,可以发挥免疫监视及清除癌细胞的作用。对肿瘤浸润树突细胞(TIDC)的研究证实,树突细胞(Dendritic cells,DCs)是肿瘤微环境中的主要抗原提呈细胞,但是无功能或功能低下〔1〕,有关恶性胸水肿瘤微环境的TIDC研究较少。目前认为肿瘤浸润T淋巴细胞(TIL)主要源于T淋巴细胞,在白细胞介素-2(IL-2)作用下可增殖、分化为细胞毒性T细胞(CTL)。本文选择在体外用IL-2活化恶性胸水免疫细胞,主要针对TIL和TIDC,观察负载肿瘤全抗原后其对肿瘤细胞的体外杀伤作用。
1 材料与方法
1.1 材料 多种氨基酸培养基(RPMI1640,美国Life Technologies公司)。淋巴细胞分离液(Ficoll-Hypaque液,上海试剂二厂),IL-2(北京双鹭生物工程制品厂),AB血清(中国医学科学院天津血液学研究所)。肝素抗凝试剂、人外周血T细胞亚群自动视野检测(SAP)法检测试剂盒、S-100蛋白SP法检测试剂盒(北京中山生物技术有限公司)。
1.2 方法
1.2.1 临床资料 选取2003年3月至2007年8月我院诊治的100例恶性胸水患者,男50例,女50例。所有病例经胸片、CT及病理学诊断和/或细胞学检查证实为晚期恶性肺肿瘤合并胸膜转移致胸腔积液,均为肺癌患者,但血性胸水患者不作为研究对象。
1.2.2 操作方法 无菌操作抽取患者胸水500 m l,并将其引流进含有肝素(10 U/ml)的无菌盐水瓶内,50 m l离心管分装胸水,1 000 r/min,20℃离心10 min。弃上清,Hanks液洗2遍。取10只10 ml离心管各加淋巴细胞分离液3.5 ml,以1∶1的比例加入汉斯平衡盐溶液(HBSS)悬浮细胞。2 000 r/min,20℃离心20 min。吸取白膜层细胞转移至 10 ml离心管。1 000 r/min离心10 min。弃去上清,含灭活补体的10%人AB型血清的RPMI1640培养基洗2遍。调整细胞浓度为106/ml,接种于6孔板中,每孔加2 ml,置体积分数为0.05的CO2、37℃温箱中培养2~3 h。轻轻吸取非贴壁细胞,洗去残余悬浮细胞,获得先贴壁细胞,所有悬浮细胞共同转移至另一个6孔板中再贴壁20 h,再次吸取非贴壁细胞(单核细胞为主)(包括TIDC和TIL)。非贴壁细胞中加入500 U/m l IL-2,每2 d传代1次,同时补充IL-2,37℃ 5%CO2温箱继续培养,相差显微镜下观察细胞形态。台盼蓝计数细胞并检测细胞活性。细胞培养前后SP法检测T细胞亚群免疫功能,SP法检测S-100蛋白阳性细胞。SP法检测S-100蛋白阳性细胞免疫组化二氨基联苯胺(DAB)染色判定标准:光镜下可见胞质及胞膜出现棕黄色,DCs为胞质着色,单核/巨噬细胞染色位于细胞膜。
1.2.3 制备肿瘤细胞全抗原 取对数生长期常规培养的CALU-6腺癌细胞,调整细胞浓度为1×107/ml,反复低渗冻融4次,高速离心(10 000 r/min),并收集上清过滤除菌作为肿瘤细胞全抗原备用。
1.2.4 细胞培养 细胞培养第7天,107/m l细胞浓度的肿瘤细胞全抗原分别与非贴壁细胞共同孵育24 h,参照Cole方法,调整腺癌细胞CALU-6和GLC-82的细胞浓度为1×105/ml,配制成悬液,加入96孔平底培养板中培养24 h使细胞恢复增殖,胸水肿瘤浸润免疫细胞以1∶10,1∶50,1∶100与两种腺癌细胞混合培养48 h以上,再加入噻唑蓝(MTT)试剂50 ng/m l,继续培养4~6 h,去除上清液加入10%二甲基亚砜200μl,用酶标比色计(波长540 nm)测OD值,计算细胞杀伤率。肿瘤浸润免疫细胞杀伤活性(%)=〔1-(实验组OD值-单独效应孔OD值)/单独靶细胞孔OD值〕×100%。
1.3 统计学分析 应用SPSS13.0统计软件进行分析,数据以±s表示,采用t检验。
2 结果
2.1 SP法检测S-100蛋白阳性细胞 恶性胸水存在少量S-100阳性DCs,为圆形或具有短而钝突起,是免疫功能低下的表现。IL-2活化后细胞形态变化,胞质出现分枝状突起,形似树突状的DCs,提示恢复抗原提呈功能。见图1。

图1 光镜下树突细胞形态
2.2 SP法检测T细胞亚群变化情况 400倍光镜下连续观察10个视野,并对每个视野CD3、CD4和CD8阳性细胞计数,结果发现T细胞亚群细胞数量明显增加,细胞体积较前增大。分别对CD3、CD4和CD8进行配对样本t检验,诱导前后T淋巴细胞表型比较,CD3,CD4均有明显增多,t值为 -18.59,-43.34,P<0.01;CD8比例较前减少,差异有显著性,t值为21.83,P<0.01。T淋巴细胞增多表现为CD4细胞增多,提示抗原提呈细胞介导的免疫功能上调。见表1。
表1 IL-2活化后恶性胸水中T淋巴细胞表型比较(±s,%)
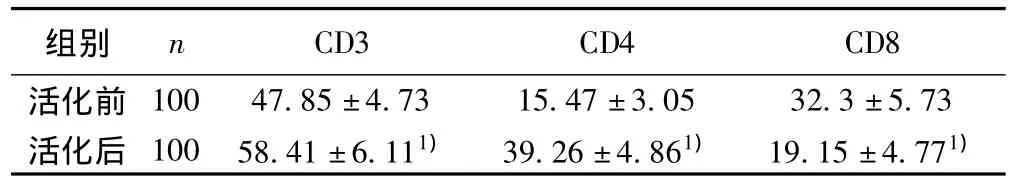
表1 IL-2活化后恶性胸水中T淋巴细胞表型比较(±s,%)
与活化前比较:1)P<0.01
组别 n CD3 CD4 CD8活化前100 47.85±4.73 15.47±3.05 32.3±5.73活化后 100 58.41±6.111) 39.26±4.861) 19.15±4.771)

图2 光镜下CTL溶解肿瘤细胞(×400)
2.3 肿瘤抗原负载后T细胞亚群变化情况 见表2,图2。肿瘤全抗原负载的肿瘤浸润免疫细胞对于GLC-82细胞杀伤活性较低,t值为33.55,两者比较差异具有显著意义(P<0.01)。CALU-6细胞作为肿瘤抗原负载恶性胸水共同孵育24 h后,可见到较多活化的CTL溶解肿瘤细胞。
表2 恶性胸水肿瘤浸润免疫细胞杀伤活性比较(±s,%)

表2 恶性胸水肿瘤浸润免疫细胞杀伤活性比较(±s,%)
与GLC-82组比较:1)P<0.01
组别 n 100 31.38±3.42 36.55±6.18 CALU-6组 100 51.71±5.071) 82.12±5.291)1∶50 1∶100 GLC-82组
3 讨论
肺癌合并恶性胸水临床较常见,其中以胸膜转移为常见原因,这些转移灶从生物学角度看具有异质性,每个病灶对抗肿瘤药物的敏感性也存在异质性,因此单纯化疗除去所有转移灶并不可能。抗原提呈细胞将肿瘤抗原有效地提呈给T淋巴细胞,激活肿瘤抗原特异性CTL对肿瘤细胞的杀伤作用是特异性抗肿瘤免疫的关键环节〔2,3〕。DC是体内功能最强的专职抗原提呈细胞,仅占外周血单个核细胞总数的0.5% ~1.0%。针对癌肿瘤微环境DCs数量、功能的研究鲜见报道。TIDC是肿瘤微环境中的主要抗原提呈细胞,可能是一种无功能或功能低下的DCs。肿瘤细胞在肿瘤局部分泌的免疫抑制因子可能是导致TIDC功能低下的原因之一,其可能抑制免疫细胞的抗肿瘤免疫应答,因此研究TIDC对了解肿瘤免疫逃避机制具有重要意义〔4〕。由于晚期癌症患者全身免疫功能低下,导致了癌性胸水中的TIL处于免疫抑制状态。目前,TIL体外活化后特异性及细胞杀伤活性等已得到临床证实,来自自体肿瘤细胞的TIL对自体肿瘤具有强大的细胞毒作用,对自体正常组织无杀伤性。随着肿瘤免疫学研究的不断深入,提出了“肿瘤微环境”(tumor environment)的概念,由于恶性肿瘤在患者体内生长时能分泌免疫抑制因子,抑制免疫细胞的抗肿瘤免疫应答。因此,如何解除肿瘤细胞的免疫抑制作用,优化机体特异性抗肿瘤免疫的微环境和提高肿瘤患者机体自身的抗肿瘤免疫应答是预防及治疗癌细胞扩散和转移过程一个重要问题〔5〕。以往的研究发现,IL-2基因修饰的DCs免疫治疗,能优化肿瘤宿主体内抗原提呈的微环境;腔内直接注入TIL,对局部抗肿瘤免疫应答的微环境起到了优化和增强作用,能有效地抑制晚期癌症患者胸水中癌细胞的增长。本文发现IL-2活化TIL的同时,使胸水中的无功能TIDC转变为成熟DC,肿瘤抗原致敏的TIL和TIDC有特异性杀伤作用。
本研究结果显示恶性胸水中的TIDC数量极少,经过IL-2活化,T细胞免疫功能明显上调,且对于肿瘤抗原具有特异性杀伤作用。本研究结果为恶性胸水的临床治疗提供了可靠的实验依据,在临床治疗中将有广阔的应用前景。
1 Michael R.Dendritic cells presenting tumor antigen〔J〕.Cancer Immunol,1996;43(3):158-64.
2 Sallusto F,Lanzavecchia A.Efficient presentation of soluble antigen by cultured human dendritic cells ismaintained by granulocyte〔J〕.JExp Med,1994;179(14):1109-18.
3 Canque B,Rosenzwaijg M,Camus S,et al.The effect of in vitro human immunodeficiency virus infection on dentritic-cell differentiation and function〔J〕.JBlood,1996;88(11):4215-28.
4 Alzona MT,Smith S,van Epps DC,et al.Macrophage colony-stimulating factor plus interleukin4 and down regulated by tumor necrosis factor alpha〔J〕.Blood,1996;88(suppl1):1090.
5 丘少鹏,陈辉熔,邓春华,等.前列腺癌肿瘤微环境树突状细胞与T细胞免疫的关系〔J〕.中山医科大学学报,2002;23(2):127-8,131.
R73
A
1005-9202(2011)12-2252-03
河北省卫生厅重点课题(No.04258)
王红阳(1958-),女,教授,硕士生导师,主任医师,主要从事呼吸系统疑难急症诊治研究。
黄 艳(1976-),女,硕士,主治医师,主要从事肺癌基础与临床研究。
〔2011-03-22收稿 2011-04-02修回〕
(编辑 袁左鸣/徐 杰)

