不同厂家复方丹参片抑菌作用强弱的比较
王海华
(广西南宁食品药品检验所,广西南宁530001)
复方丹参片收载在《中国药典》2005年版一部[1],含丹参、三七、冰片3种中药成分,具有活血化瘀,理气止痛的功效。处方中丹参和冰片两味中药材,均对某些细菌的生长繁殖有一定抑制作用[2-6]。为保证临床用药的安全性,目前各国药典对口服制剂的微生物污染状况有明确的质控指标[1,7-10]。在药品监督检验工作中,经常遇到该品种不同生产厂家提供的微生物限度检查资料所采用的方法差异很大,本实验通过回收率实验对16个厂家生产的复方丹参片的抑菌作用强弱进行了比较,为该品种的微生物限度检验方法的建立提供参考和依据。
1 仪器与试药
1.1 仪器 SPS202F电子天平[奥豪斯国际贸易(上海)有限公司];TDL-40B台式离心机(上海安亭科学仪器厂);LRH-250-G型光照培养箱(广东省医疗器械厂);LRH-250-A型生化培养箱(广东省医疗器械厂);HR-8753GM微波炉(青岛海尔微波制品有限公司);Ⅱ级生物安全柜(上海振梓创空气净化设备有限公司)等。
1.2 实验菌种 枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]、金黄色葡萄球菌(Staphlococcus aureus)[CMCC(B)26003]、大肠埃希菌(Escherichia coli)[CMCC(B)44102]、白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003],由中国医学微生物菌种保藏管理中心提供。
1.3 培养基及稀释剂 营养琼脂培养基,玫瑰红钠琼脂培养基,营养肉汤培养基,胆盐乳糖培养基(BL),改良马丁培养基,MUG培养基,曙红亚甲蓝琼脂培养基,胆盐乳糖发酵培养基,pH7.0无菌氯化钠-蛋白胨缓冲液,0.9%无菌氯化钠溶液。
1.4 样品 复方丹参片,16个厂家生产(编号分别为 A、B、C、D、E、F、G、H、I、J、K、L、M、N、O、P),从市场购买。
2 方法[1]
2.1 菌液的制备 取经35℃培养18~24 h的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的营养肉汤培养物用0.9%无菌氯化钠溶液制备成每1 mL含菌数为50~100 cfu的菌悬液,备用;取经25℃培养24~48 h的白色念珠菌液体培养物用0.9%无菌氯化钠溶液制备成每1 mL含菌数为50~100 cfu的菌悬液,备用;取经25℃培养1周的黑曲霉斜面培养物,加10 mL 0.9%无菌氯化钠溶液洗下霉菌孢子,吸取菌液用0.9%无菌氯化钠溶液制备成每1 mL含菌数为50~100 cfu的菌悬液,备用。
2.2 供试液制备 取样品10 g,加pH7.0无菌氯化钠—蛋白胨缓冲液稀释至100 mL,制备成溶解均匀的1∶10的供试液。
2.3 采用方法
2.3.1 常规法 取1∶10的供试液1 mL注皿。
2.3.2 培养基稀释法 取1∶10的供试液1mL注入2个平皿(0.5 mL/皿)或5个平皿(0.2 mL/皿)。
2.3.3 低速离心法加培养基稀释法 取1∶10供试液10 mL至无菌离心管中,500 r/min离心5 min,取上清液1 mL分别注入2个平皿(0.5 mL/皿)或5个平皿(0.2 mL/皿)。
2.3.4 低速离心法加薄膜过滤法 取1∶10供试液10 mL至无菌离心管中,500 r/min离心5 min,取上清液1 mL 薄膜过滤,冲洗 100、200、300、400、500 mL。
3 回收率测定
3.1 试验组 按2.3项下方法操作后,分别加入试验菌50~100 cfu注入同一平皿中,立即倾注琼脂培养基,待凝固后,置规定温度,细菌培养24~48 h,白色念珠菌和黑曲霉培养48~72 h,测定其菌数(薄膜过滤法取上述供试液过滤、冲洗,在最后一次冲洗液中加入试验菌50~100 cfu,过滤,按薄膜过滤法测定其菌数)。
3.2 菌液组 取试验菌50~100 cfu注入平皿中,立即倾注琼脂培养基,其余操作同3.1项。
3.3 供试品对照组 按2.3项下方法操作后,立即倾注琼脂培养基,其余操作同3.1项。
3.4 稀释剂对照组 取pH7.0无菌氯化钠-白胨缓冲液1mL和试验菌50~100 cfu,分别注入同一平皿中。考察稀释剂对试验有无干扰。该对照组各试验菌的回收菌应不低于70%。
试验组的加菌回收率(%)=(试验组平均菌落数-供试品对照组平均菌落数)/(菌液组的平均菌落数)×100%。
稀释剂对照组的加菌回收率(%)=(稀释剂对照组的平均菌落数)/(菌液组的平均菌落数)×100%。
4 结果
4.1 预试验结果 按照药典规定的5种试验菌,采用常规法测定16个厂家生产的复方丹参片的回收率,以确定敏感菌株。预试验结果见表1。
表1所见,16个厂家生产的复方丹参片,金黄色葡萄球菌采用常规法回收率几乎全部为0,表明复方丹参片对细菌抑制作用明显,确定细菌数测定选用金黄色葡萄球菌作为敏感菌株进行预试验。黑曲霉的回收率均大于70%,而白色念珠菌有6个厂家的回收率小于70%,故确定霉菌、酵母菌数测定选用白色念珠菌作为敏感菌株进行预试验。
4.2 细菌数测定方法的确定 根据预试验结果,选用金黄色葡萄球菌作为敏感菌株进行试验,以确定细菌数测定方法。按2.3项下操作,结果见表2。
由表2结果得出:要达到药典规定回收率大于70%的要求,不同厂家生产的复方丹参片需采用不同的方法:
编号E、F、G、O,需采用培养基稀释法(0.2 mL/皿);编号K,需采用低速离心加培养基稀释法0.5 mL/皿;编号 D、H、L、M、N,需采用低速离心加培养基稀释法0.2 mL/皿;编号C、J,需采用低速离心加薄膜过滤法100 mL、编号B需200 mL、编号 P需300 mL;编号I,需采用薄膜过滤法(1∶100供试液1 mL过滤)100 mL、编号A需200 mL。

表1 十六个厂家复方丹参片常规法预试验结果(n=3)
pH7.0无菌氯化钠—蛋白胨缓冲液作为稀释剂的稀释剂对照组回收率超过70%,表明稀释剂pH7.0无菌氯化钠—蛋白胨缓冲液无抑菌作用,对实验无干扰。
4.3 霉菌和酵母菌数测定方法的确定 根据预试验结果,选用白色念珠菌作为敏感菌株进行试验,以确定霉菌和酵母菌数测定方法。按2.3项下操作,结果见表3。
编号 E、F、G、J、K、L、M、N、O、P 共 10 个厂家生产的复方丹参片,白色念珠菌采用常规法回收率大于70%;编号B、D、H采用培养基稀释法0.5 mL/皿,编号 A、C、I需0.2 mL/皿其回收率也均大于70%。
4.4 细菌、霉菌及酵母菌计数方法验证 根据预试验及细菌,霉菌、酵母菌方法确定结果,取16个厂家生产的复方丹参片样品,按药典规定进行5种试验菌的加菌回收率试验验证。
细菌计数:
编号为E、F、G、O厂家的复方丹参片采用培养基稀释法(0.2 mL/皿);编号为 D、H、L、M、N 采用低速离心加培养基稀释法(0.2 mL/皿);编号为K采用低速离心加培养基稀释法(0.5 mL/皿);编号为C、J、B、P采用低速离心加薄膜过滤法(分别为100 mL、200 mL、300 mL);编号为 A、I采用薄膜过滤法(1∶100供试液1 mL过滤,分别冲洗200 mL、100 mL)。

表2 敏感菌株(金黄色葡萄球菌)回收率试验结果(n=3)
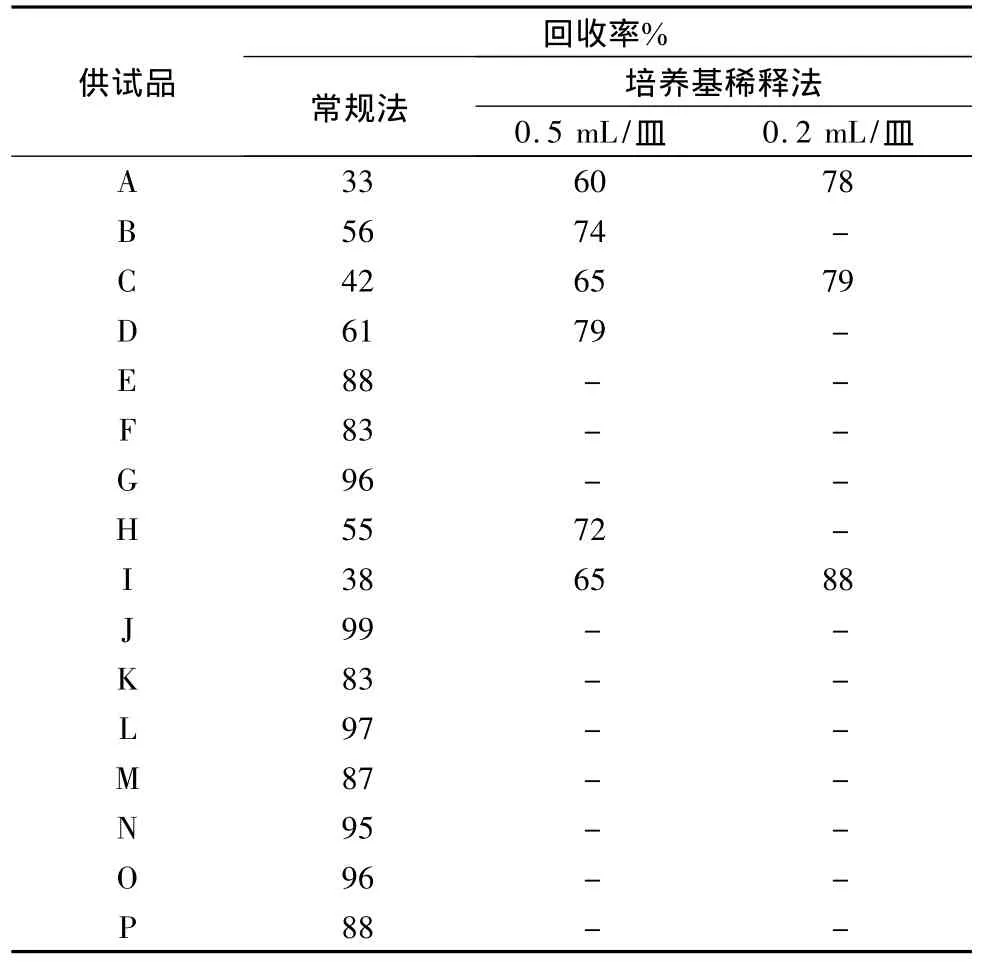
表3 敏感菌株(白色念珠菌)试验结果(n=3)

表4 16个厂家复方丹参片验证方法试验结果(n=3)
霉菌及酵母菌计数:
编号为 E、F、G、J、K、L、M、N、O、P 按常规法;编号为A、C、I按培养基稀释法(0.2 mL/皿);编号为B、D、H按培养基稀释法(0.5 mL/皿)进行加菌回收率试验。结果见表4。
16个厂家生产的复方丹参片的方法验证试验结果表明,由于其抑菌作用强弱不同,需要分别采用不同的方法进行细菌数测定、霉菌及酵母菌数测定,5种规定试验菌的回收率均大于70%,符合《中国药典》的规定,方法可行。
4.5 控制菌检查方法的验证试验结果 按药典方法,分别取16个厂家样品的1∶10供试液10 mL和1 mL含10~100 cfu的大肠埃希菌加入100 mL BL增菌液(常规法)进行控制菌大肠埃希菌验证试验;1∶10供试液1 mL和1 mL含10~100 cfu的大肠埃希菌加入10 mL胆盐乳糖发酵培养管中(常规法)进行控制菌大肠菌群验证试验,同时做相应的阴性对照菌验证试验。结果为样品试验组都检出大肠埃希菌、阴性菌对照组都未检出金黄色葡萄球菌,表明16个厂家的样品控制菌检查方法验证试验成立,实验中同时取1∶10供试液10 mL或1 mL按常规法进行控制菌检查,均未检出大肠埃希菌和大肠菌群。
5 讨论
5.1 在实验过程中,采用常规法检查时,16个厂家生产的复方丹参片供试品对照组均无菌生长,当采用培养基稀释法和薄膜过滤法检查时,一些本身染菌的样品在供试品对照组中检出染菌数。可见,在试验条件下不能有效地排除其抑菌作用,就无法检查出样品真实的污染菌数,根据2005版《中国药典》相关规定,细菌、霉菌和酵母菌计数方法验证的回收率应不低于 70%[1]附录71。从表1 ~3 可见,不同厂家生产的复方丹参片对细菌和霉菌的抑菌作用强弱不同,需要采用不同的方法去消除其抑菌作用,才能有效检出该药品污染存活的细菌数量。
5.2 从表2结果看出,16个厂家生产的复方丹参片,有4个厂家采用培养基稀释法,6个厂家采用低速离心加培养基稀释法,4个厂家采用低速离心加薄膜过滤法,另2个厂家采用薄膜过滤法(1∶100的供试液),金黄色葡萄球菌的回收率才能大于70%。复方丹参片收载在《中国药典》2005版一部,处方有丹参、三七、冰片3种中药,其中丹参、冰片有抑菌作用,其处方、工艺已确定。从实验结果得出,不同厂家生产的复方丹参片其抑菌强弱不同,尤其是对金黄色葡萄球菌抑菌作用差异显著,估计主要原因是药材产地、采收时间不同,丹参的质量也不同。
5.3 编号为A、I厂家生产的复方丹参片由于抑细菌作用太强,上述方法均不能排除其抑菌作用。《中国药典》规定[11],若没有适宜的方法消除供试品中的抑菌作用,在不影响检验结果判断的前提下,应采用能使微生物生长的更高稀释级的供试液进行方法验证试验。若验证试验符合要求,应以该稀释级供试液作为最低稀释级的供试液进行供试品检验。考虑到复方丹参片含有原生药,标准规定细菌数为10 000个/g,在不影响检验结果判断的前提下,将样品制备成1∶100的供试液,取1 mL进行薄膜过滤。
5.4 由于复方丹参片具有较强的抗菌活性,通过预试验结果,选择金黄色葡萄球菌为细菌代表,白色念珠菌为真菌代表进行细菌、霉菌方法确定试验,既节省了大量人力、物力,又能快速建立有效的微生物限度检查方法。通常,当药品生产条件发生改变(如更换产地、更换辅料和改变生产工艺等)或原检验条件发生改变时,对微生物限度检查方法应进行再验证。由于进行再验证时,药品中的活性成分未发生改变,故其抗菌谱也未改变,因此我认为再验证工作仅需针对药典规定的全部验证菌株中的最敏感菌株即可,而不必对全部菌株进行再验证。采用这种方法,即可保证检验方法的有效性,又节省了大量人力、物力,使得验证工作成为日常检验的一部分成为可能。建议药典逐渐收载各抗菌药物的最敏感验证菌株作为质控菌株,方便日常工作。
[1]中国药典[S].一部.2005:527-528.
[2]周 静,李惠芬,王洪志,等.丹参水溶性成分与脂溶性成分抑菌作用的考察[J].时珍国医国药,2008,19(9):2130.
[3]邓 婧,许晓燕,袁昌青,等.丹参水煎液对几种口腔常驻菌的体外抑菌实验[J].实用口腔医学杂志,2006,22(4):553.
[4]孙吉兰,常云亭,宋海英,等.丹参的体外抑菌作用研究[J].时珍国医国药,2003,14(12):725.
[5]朱嘉蓉,罗厚蔚.丹参酮ⅡA的抑菌活性研究[J].中国药科大学学报,2004,35(4):368.
[6]张玉兰,洪建文,罗翰宇.复方丹参片微生物限度检查方法的建立[J].中药材,2005,28(8):728.
[7]British Pharmacopoeia Commission.British Pharmacopoeia:Apendix XVI B A[S].London:The Stationery Office,2002:315.
[8]Pheur Commission.Europe Pharmacopoeia 5.2[S].Strasbourg:Pheur Commission,2005:2613.
[9]The United States Pharmacopeial Convention.U.S Pharmacopeia/National Formulary 28[S].Washington:U.S Pharmacopeia Origination Press,2005:2752.
[10]Japanese Pharmacopoeia Commission.The Japanese Pharmacopoeia[S].14th.Tokyo:Hirogawa Bookshop,2000:60.
[11]中国药典[S].一部.2010:附录81.

