动物实验替代方法与21世纪毒性测试发展策略
郭家彬,彭双清
(军事医学科学院疾病预防控制所,毒理学评价研究中心,北京 100071)
随着人们对动物保护与动物福利的关注和重视以及实验动物使用“3R”原则在全球范围内的广泛倡导与实施,动物实验受到越来越严格的限制。另一方面,经济和社会的快速发展,化学物质等有害因素暴露的种类及数量日益增多,亟待进行毒性测试与风险评估。传统的毒性测试主要依赖于大量的动物实验,其实验周期长、花费大,且由于种属差异等原因而使实验结果在预测人体毒性风险时存在较大的不确定性,已经难以满足化学物质等有害因素的评价需求。近年来,采用体外试验、低等生物和非生物载体等技术方法替代传统的动物实验已成为外源性化合物毒性测试的重要发展方向,并在毒理学领域获得快速发展和广泛应用,逐步形成了具鲜明特色的替代毒理学这一分支学科[1]。替代毒理学就是动物实验替代方法在毒理学领域的研究和应用,渗透了“3R”原则的全部内容,它不仅是动物保护与动物福利考虑的需要,也是毒理学学科发展以及社会经济发展的需要与科学要求。
1 动物实验替代方法的概述
1.1 “3R”原则与动物实验替代方法
早在1959年英国动物学家Russell和微生物学家Burch在其著作《人道主义实验技术原理》中首次系统地提出了“3R”原则,其核心内容即指减少(reduction)、替代(rep lacement)和优化(refinement)。“3R”原则旨在促进科学、合理、人道地使用实验动物,在保证实验科学性的前提下尽可能地减少实验动物的使用、减轻或消除动物痛苦,着力提高动物福利。“3R”原则自提出以来,受到欧美等发达国家和地区的高度重视,得到政府管理部门、学者和民间越来越广泛的支持。欧盟、美国和日本等多个国家和地区已制定相关法律法规以加强“3R”原则的贯彻实施。我国在2006年由国家科技部发布了《关于善待实验动物的指导性意见》,明确指出动物实验应遵循“3R”原则。
1.2 动物实验替代方法的内涵
“替代”是“3R”原则的核心内容之一。广义而言,动物实验替代方法就是指采用新的技术方法代替传统的或旧的动物实验,任何一种能够减少动物使用和/或减轻动物痛苦、提高动物福利的方法都可视为动物实验替代方法。动物实验替代的基本方法主要包括[2],①应用体外试验替代整体动物试验,如体外培养的动物或人源细胞、组织和器官等,细胞系和人组织标本等;②应用低等生物和有限知觉的生物体替代脊椎动物试验,如植物、细菌、果蝇和斑马鱼等;③应用数学、物理和化学技术方法和计算机模型等非生物手段,如利用结构-效应关系(SAR)模型预测化合物的潜在生物学效应。从替代的层次和目的而言,动物实验替代方法可分为减少性替代、替代性研究和优化性替代。减少性替代是指在保证获得等同信息甚至更多有用信息的条件下,采用新的替代方法以减少动物使用数量和/或缩短动物实验时间。如在药物急性毒性试验中,采用上下法既能获得动物半数致死剂量值(LD50),又能大大减少动物使用数量。替代性研究主要是指采用无脊椎动物或非动物实验手段替代脊椎动物实验。优化性替代主要是指在动物饲养、管理和/或试验过程中,采用新的技术方法进行优化完善,着力提高实验规范化水平和动物福利。因此,从某种程度上而言,替代从不同层面和不同角度涵盖了“3R”原则的所有内容。
1.3 动物实验替代方法的建立、验证与管理认可
动物实验替代方法是基于科学实验的需求以及动物保护与动物福利的充分考虑而设计的。一种新的动物实验替代方法首先必须具有一定的科学性、可靠性、有效性、可操作性和经济性以及应用价值,与现行的动物试验方法有较好的相关性和一致性,其结果能够较好地预测受试物的体内生物学效应[3]。在应用新的试验方法替代传统的动物实验时,必须对该方法进行适当的验证研究,以证明新方法的可信性和相关性符合特定目的,即对替代法进行验证。验证是基于某一特定目的,依据科学的程序而评价和确定新方法的可信性和相关性的过程。可信性是指在不同时间、不同实验室之间检测结果的重复性。相关性是指基于特定目的,某种方法或试验系统的科学基础和相关模型的预测能力,它反映替代法的科学意义和适用性。替代法经验证成功后递交给管理机构进行审核、批准,这一过程即为管理认可。欧盟、美国、德国、日本、荷兰、澳大利亚等国家和地区已经建立了专门的机构开展替代方法的建立、验证和管理等工作,如欧洲替代法验证中心(ECVAM)、美国替代方法验证协调委员会(ICCVAM)、德国动物实验替代方法评价研究中心(ZEBET)、日本动物实验替代方法学会(JSAAE)和荷兰国家替代法研究中心(NCA)等。截至2011年7月,已有69种动物实验替代方法获得了经济合作与发展组织(OECD)等组织的管理认可[4]。我国替代法研究起步较晚,目前尚未建立专门的替代法验证与管理认可机构。
2 21世纪毒性测试面临着严峻挑战
当前,食品和药品安全、环境污染和职业卫生等已成为国际和我国社会和经济发展所面临的重大问题。特别是在我国,近年来食品和药品安全事件以及环境污染等问题十分突出,严重影响着我国居民的身心健康和经济的可持续发展。评价外源性化学物质及物理性和生物性等有害因素对生物体,特别是人体产生的危害及其毒性作用机制是毒理学学科的主要任务。对外源性化合物或其它有害因素进行毒性测试,是评估这些有害因素暴露风险的基础。然而,在过去近40年期间,毒理学的核心测试试验方法几乎没有发生改变[5]。如何对迅速增长的化学物等有害因素进行快速、准确的毒性测试已经成为21世纪毒理学发展所面临的严峻挑战。
首先,新老化学物暴露急剧增加,毒性测试任务十分艰巨。以欧盟为例,年产量为1~100吨的化学物就超过30,000种,而人们仅对其中少数化学品获知其毒理学特征[6]。据估计,超过86%的化合物缺乏系统的毒理学数据。随着组合化学等技术的发展与应用,每天还有大量的新化学物形成,有待进行毒性测试和暴露风险评估。而高昂的动物实验费用、冗长的实验周期严重制约毒性测试的快速发展。据统计,全世界平均每年动物实验花费近140亿美元,其中近30亿用于毒理学试验。平均一个化合物的毒性测试周期为3.5年;其次,由于动物种属和个体差异,动物实验模型难以反映真实的人体反应。尽管人们熟知动物实验的局限性,但对于动物模型的准确性却鲜有报道。有研究表明,在能引起兔子发生皮肤刺激反应的化合物中仅有40%可在人体中引发类似反应[7]。类似地,一项国际验证试验表明,化合物在大鼠中的半数致死剂量(LD50)值与人体血液中的致死剂量相关性并不好(相关系数仅为0.56)[8]。值得注意的是,动物实验中所采用的动物多为遗传背景相同、均一性的动物或特定的动物模型,而实际接触化合物的人群则有可能千差万别;再次,在传统的毒性测试中,为了更好地暴露化合物的潜在毒性,所采用的剂量常常远高于人体中的实际暴露剂量,而且试验所检测的毒理学终点与评价指标可能也与临床人体试验存在较大差异。因此,这些毒性测试试验结果在预测人体毒性时很容易出现假阳性和假阴性错误。
2006年12月18日,欧盟议会和欧盟理事会正式共同通过了化学品新政策的法规草案《关于化学品注册、评估、许可和限制》,简称REACH法规。依照《REACH法规》规定,自2009年3月11日起,在欧盟范围内禁止用动物进行化妆品急性毒性、眼刺激性和过敏性试验;2013年将禁止用动物进行慢性毒性、生殖毒性和毒物代谢动力学试验。人用药品注册技术要求国际协调会(ICH)、美国食品药品监督管理局(FDA)和美国环境保护署(EPA)等部门近年来也颁布了多部相关管理法规和技术指南,明确要求或推荐采用体外试验以替代传统动物试验。这些法律法规的实施为动物保护和动物福利提供了有力保障,有些动物实验替代方法还将成为毒性测试的必然选择。
3 基于动物实验替代方法的毒性测试策略-毒理学替代法
毒理学是动物实验应用最为广泛的学科之一。近年来,动物实验替代法越来越受到国内外毒理学工作者的关注和重视,并在毒理学领域获得快速发展和广泛应用,逐步形成了基于动物实验替代方法的毒性测试新策略,即毒理学替代法。在毒理学领域,任何能够优化动物使用(如减轻或消除动物痛苦)、减少动物使用、采用非动物检测系统(如体外培养的细胞、计算机预测模型)或低等动物(如鱼、昆虫类)等技术方法开展的试验都可视为毒理学替代法,纳入替代毒理学的研究范畴[1]。毒理学替代法是“3R”原则在毒理学学科中的具体实践与应用。无论是从毒理学学科的科学发展角度还是从经济角度考虑,毒理学替代法对外源性化学物的危害性评价及管理均具有重要的意义,在减少动物使用、减少实验影响因素、缩短实验周期、降低实验成本、阐明毒性作用机制以及提高动物福利等诸多方面都较传统动物试验有着明显的优势。
针对21世纪毒性测试与毒理学发展面临的挑战和前景展望,2007年美国国家研究院(NRC)发表了一份具有里程碑意义的报告,即《21世纪毒性测试:远景与策略》[9]。该报告为未来毒性测试的发展提供了十分重要的策略参考,突出强调21世纪毒性测试的重点将由整体动物试验转向基于人类细胞、细胞系和/或细胞组分等实验动物替代方法的测试策略。未来毒性测试的主要内容包括化学物的特性分析、含毒性通路和靶向测试的毒性测试以及剂量-反应与外推模型的研究,通过这些研究进一步开展外源性化合物的危险度评价和人群与暴露资料的分析,如图1所示。毒性测试的重点关注因素包括敏感检测终点的选择与评价、细胞-反应网络、高通量与中通量方法的构建与应用、作用机制与作用模式、毒性通路以及系统生物学效应等,着力实施高通量、高灵敏度、低成本、预测能力强而且准确的毒性测试策略[9-11]。因此,未来的毒性预测将主要依赖于体外试验和基于计算机、数学等模型的非生物学试验,传统动物试验将可能被部分替代甚至完全替代。NRC这份报告自提出以来,引起了学术界、政府管理部门以及工业界等的强烈反响。美国EPA和国立卫生研究院等机构合作,迅速启动了一个重大研究计划开展相关研究。2011年3月,英国联合利华公司在中国上海召开了21世纪毒性测试策略研讨会,积极寻求包括中国在内的合作与交流。
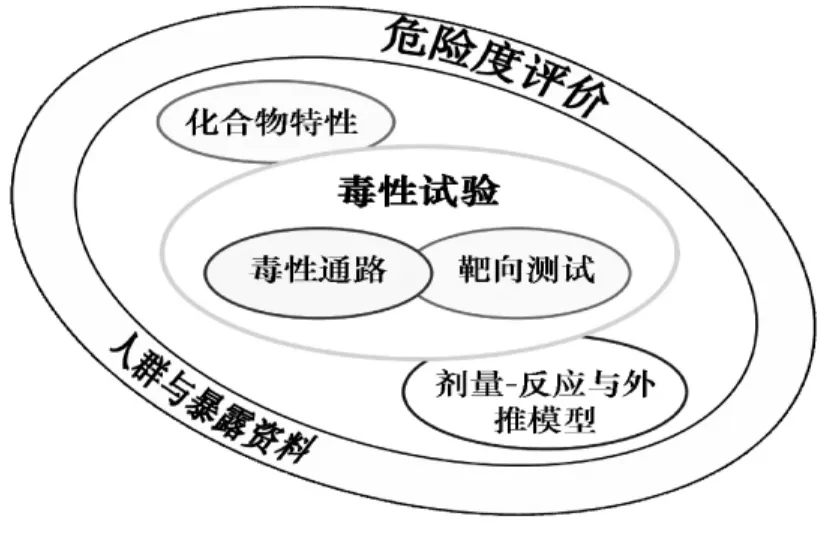
图1 NRC提出的21世纪毒性测试远景策略
4 实验动物替代方法在毒理学领域的发展与应用
近年来,动物实验替代方法在毒理学领域的发展十分迅速。毒理学替代法已经涵盖了一般毒性、靶器官毒性、遗传毒性、致癌性和局部毒性等多种毒性终点,研究手段与技术方法也从一般的组织细胞培养发展形成了成含基因组学、蛋白质组学、代谢组学、系统生物学、计算机模拟和生物信息学等多学科、多层次的综合评价体系[12]。毒理学替代法已被越来越广泛地应用于药品、新化学物、食品添加剂、农药、消毒产品、生物制品、化妆品和日用品等的毒性测试,其中有些替代方法还通过了ECVAM等权威机构的验证,并被欧盟和美国等国家和地区纳入法规管理范围。以下结合本实验室近年来开展的研究工作,列举部分毒理学替代法的研究进展与应用。
4.1 急性毒性试验
急性毒性试验对于评定化学物急性毒性效应的强弱、确定致死剂量大小有着重要意义。急性毒性试验的动物替代策略主要包括动物减少性替代和体外试验替代。减少性替代方法仍然以动物实验为主,但动物数量比传统急性毒性试验明显减少。如固定剂量法、上下法、探测剂量法、累积剂量设计法、近似致死剂量法和限量试验等。这些替代方法均可有效地减少实验动物数量。OECD已修订发布了3种检测经口急性毒性试验方法,包括急性毒性分级法、固定剂量法和上下法。研究表明,化学物体外细胞毒性与体内急性毒性之间存在正相关性,因此可利用体外试验方法对体内急性毒性进行定量预测。目前常用的体外细胞毒性检测方法有中性红摄取法、噻唑兰(MTT)法和乳酸酶漏出法等。本实验室采用MTT法检测了多种抗病毒先导化合物的细胞毒性,并通过数学模型计算获得其LD50预测值,结果显示这些预测值与体内试验获得的LD50值相似[13,14]。目前,已有2种体外试验方法通过美国ICCVAM的验证并于2010年获得OECD的管理认可,另有多种替代方法尚处在验证阶段[4]。
4.2 心血管毒性评价
心血管系统是许多外源性化合物毒性作用的重要靶器官。近年来,由心脏QT间期延长而导致的心血管毒性事件已成为新药研发失败和已上市药物撤市的主要原因之一。研究表明,QT间期延长与心肌细胞HERG离子通道抑制密切相关。为了更好地发现药物可能存在的心脏毒性风险,ICH指导原则S7B推荐采用体外试验筛选候选化合物或受试药物对HERG通道的作用,从而及时淘汰不适合继续开发的化合物或警示药品存在心脏毒性风险。本实验室采用转染人 HERG离子通道的HEK293细胞系测试了三七总皂苷和黄杨宁等传统中药或其单体致心脏毒性的潜在风险[15,16]。此外,离体心脏模型、清醒动物遥测等技术方法也获得了管理机构的认可,很大程度上减少了实验动物的使用并提高了心脏毒性测试的准确性。
4.3 胚胎干细胞模型
由于胚胎干细胞(ESC)可以在体外无限扩增并保持未分化状态,还可定向诱导分化成各种功能细胞,因而在毒性筛选、毒性靶器官的确定以及毒性机制研究等方面具有独特的巨大优势。作为一种新的毒性测试体外模型,其相关研究已成为21世纪生命科学领域的热点和重点课题。英国计划在2006年~2015年期间投入3000万英镑以建立基于ESC的体外毒性评价系统。葛兰素史克、阿斯利康和罗氏等大型制药公司也将ESC模型作为药物毒性筛选的重要策略。人胚胎干细胞(hESC)直接来源于人体,因此其测试结果具有更好的预测价值,
最近研究提示人诱导多能干细胞(iPSC)在靶器官毒性评价中具有很好的应用价值[17]。
4.4 模式动物斑马鱼
斑马鱼(Danio rerio)是一种与人类基因同源性较高的新型模式动物,其发育及细胞生物学机制与哺乳动物高度相似,且具有个体小、繁殖周期短、廉价易管理、胚胎透明可以直接观察器官发育等优点。近年来,斑马鱼已被广泛用于环境毒性检测、药物早期高通量筛选等毒性测试中。针对斑马鱼在生态环境检测中的应用,OECD专门制定了一系列基于斑马鱼的毒性测试操作指南。本实验室采用斑马鱼评价了氯丙嗪、阿霉素、5-氟尿嘧啶和异烟肼等药物以及铅等环境污染物的毒性作用,均显示出与哺乳动物有良好的相关性,后期将开展相关的验证试验以充分证明该模型的可信性和相关性。
4.5 毒理“组学”
随着后基因组时代的到来,基因组学、蛋白质组学和代谢组学等“组学”技术的发展和应用为从基因、蛋白质和代谢产物水平全面系统地开展毒性测试提供了有力的理论支持和方法学支撑,形成了毒理基因组学和毒理蛋白质组学等新兴交叉学科,为药物和环境污染物等化学物的毒性评价提供重要工具。本实验室采用全基因扫描芯片技术以及“2D”电泳和飞行质谱等蛋白学技术研究了异烟肼、利福平和阿霉素等药物以及多氯联苯等持久性污染物染毒后的基因表达谱、蛋白质组学以及代谢组学改变,为阐明这些毒物的毒性作用特征及其可能的作用机制,制定早期预测和治疗药物研发提供了重要参考[18-20]。
5 我国动物实验替代方法与毒性测试发展的思考和展望
我国实验动物替代方法研究起步较晚,与欧美等发达国家和地区相比存在较大差距,目前毒性测试仍然以大量的动物实验为主,以此外推对人体健康的可能危害与风险。近年来,虽然国内有些实验室和学者在替代毒理学领域进行了一些有益尝试和积极探索,但缺乏系统性的工作,且原创性研究较少,大部分毒理学替代法系参照或追踪欧盟、美国和日本等国家和地区的一些方法。我国部分用于药品、生物制品、化妆品、化学品以及农药等产品的安全性评价的体外检测技术方法基本是借鉴了OECD和美国FDA等国际机构发布的技术指南,这在一定程度上促进了我国实验动物替代方法的研究和应用与国际接轨,并为我国毒性测试体系的发展起到了积极的促进作用。然而,由于我国尚未建立有关实验动物替代方法的专门管理机构,国内相关工作呈自由分散状态,应用监管存在缺失甚至空白,缺乏行业标准与规范,难以对实验动物替代方法进行系统的研究、验证和管理认可以及国际协调工作。从事实验动物替代方法研究的专业人才短缺,科技投入相对不足,实验动物替代方法的应用与推广还有限。
值得欣喜的是,近年来实验动物替代方法研究得到我国政府和学者越来越多的关注和支持。“十一五”期间,在国家科技部和卫生部等部门的支持下,我国设立开展了多项针对食品、药品和农药等产品安全性评价的体外毒性检测关键技术研究。这些项目的开展对于建立形成我国实验动物替代方法研究体系、推动毒理学替代法在我国健康快速发展以及专业人才培养有着十分重要的意义。在国家支撑计划、“国家重大新药创制”科技重大专项和国家自然科学基金等项目的资助下,北京大学、军事医学科学院和中国科学院等国内高校和科研院所积极开展了毒理学替代法的相关研究与推广。2009年,我国学者出版了第一部有关替代毒理学的专著,即《毒理学替代法》,此后,还相继出版了多部实验动物替代方法相关专著。已有越来越多的学者和单位积极呼吁我国应尽早成立实验动物替代方法研究和管理的专门机构,以规范我国替代法研究、验证和管理、加强国内外合作与国际协调。可以预见的是,实验动物替代方法拥有广阔的发展前景和应用前景,但同时也是我国毒理学和相关学科工作者面临的一项任重而道远的艰巨任务。
[1]彭双清,郝卫东,伍一军.毒理学替代法[M].北京:军事医学科学出版社.2009:5-16.
[2]贺争鸣,李根平,李冠民等.实验动物福利与动物实验科学[M].北京:科学出版社.2011:678-712.
[3]Huggins J.A lternatives to animal testing:research,trends,validation,regulator acceptance[J].ALTEX.2003,20:3-61.
[4]http://www.alttox.org/ttrc/validation-ra/validated-ramethods.htm l
[5]Hartung T.Toxicology for the twenty-first century[J].Nature.2009,460(7252):208-212
[6]Lilienblum W,Dekant W,Foth H,et al.Alternative methods to safety studies in experimental animals:role in the risk assessment of chem icals under the new European Chemicals Legislation (REACH)[J].Arch Toxicol.2008,82:21-236.
[7]http://iccvam. niehs. nih. gov/docs/acutetox _ docs/Atpanelrpt06/ATpanelrpt.pdf
[8]Basketter DA,York M,McFadden JP,et al.Determination of skin irritation potential in the human 4-h patch test.Contact Dermatitis.2004,51:1-4.
[9]Krewski D,Acosta D,Andersen M,et al.Toxicity testing in the 21st century:a vision and strategy[J].J Toxicol Environ Health B.2010,13:51-138.
[10]V liet E. Current standing and future prospects for the technologies proposed to transform toxicity testing in the 21st century[J].ALTEX.2011,28:17-44.
[11]Jaworska J,Hoffmann S.Integrated Testing Strategy(ITS)-Opportunities to better use existing data and guide future testing in toxicology[J].ALTEX.2010,27:231-42.
[12]中国科学技术协会.2010~2011毒理学学科发展报告[M].北京:中国科学技术出版社.2011:16-35.
[13]刘密凤,郭家彬,彭双清.体外方法在药物急性毒性评价中的应用[J].毒理学杂志.2007,21:235-238.
[14]刘密凤,彭双清,陈显红等.抗艾滋病候选药物DCK系列化合物毒性评价[J].中国新药杂志.2007,16(5):370-373.
[15]Zhao J,Wang Q,Xu J,Liu G,et al.Cyclovirobuxine D inhibits the currents of HERG potassium channels stably expressed in HEK293cells[J].Eur J Pharmacol.2011,660:259-267.
[16]徐江,彭双清,翁谢川.hERG钾离子通道表达系统的建立及其对药物致QT间期的影响[J].2007,21:325.
[17]Van Wobus AM,Löser P.Present state and future perspectives of using pluripotent stem cells in toxicology research[J].Arch Toxicol.2011,85:79-117.
[18]Liao Y,Peng SQ, Zhang LS. Gene expression profile of isoniazid liver-injured rat using cDNA microarray[J].Zhongguo Yi Xue Ke Xue Yuan Xue Bao.2009,31:308-314.
[19]Shuai Y,Guo J,Dong Y,et al.Global gene expression profiles of MT knockout and wild-type mice in the condition of doxorubicin-induced cardiomyopathy[J].Toxicol Lett.2011,200:77-87.
[20]Liao Y,Peng SQ,Yan XZ,et al.Metabonomic profile of urine from rats administrated with different treatment period of rifampin[J].Zhongguo Yi Xue Ke Xue Yuan Xue Bao.2008,30:696-702.
- 中国比较医学杂志的其它文章
- 小鼠胶原诱导性关节炎模型的建立及其免疫学变化研究
- 抑郁症动物模型的转换研究

