抑郁症动物模型的转换研究
白晓宇,杜冠华
(北京协和医学院 中国医学科学院 药物研究所 国家药物筛选中心,北京 100050)
抑郁症是以情绪低落、兴趣丧失、思维迟缓、自责自罪、饮食睡眠紊乱等症状为主要特征的一种慢性易复发的异质性精神疾病[1]。抑郁症的自杀自残率较高,约为15% ~20%[2],其发病率也较高,被形象地称为“心灵感冒”,意指经常出现的心境障碍[3]。据世界卫生组织预测,2020年抑郁症将成为“全球疾病负担”排名第二的重大疾病[4]。因此,针对抑郁症的诊治刻不容缓,现有的抗抑郁药物虽然疗效肯定,但起效慢、治疗不彻底,这不仅降低了病人的依从性,还增加了其自杀的危险性[5]。随着新型抗抑郁药物的临床需求日益严峻,抑郁症的发病机制也在不断被阐明,然而创新抗抑郁药的研制仍未有革命性的突破[6]。2004年,FDA颁布的《关键路径计划纲要》白皮书中提出,精神疾病药物研发停滞的重要原因就是动物模型的实验结果与临床实验的吻合度较低[7]。可见,提高抑郁症动物模型的临床预测效度,从而推动创新抗抑郁药物的研发,并且借助于临床预测效度高的抑郁症的动物模型,深入研究抑郁症潜在的发病机制,是目前创新抗抑郁药物研发迫切需要突破的瓶颈。
1 抑郁症的临床诊断
目前,抑郁症的临床诊断主要依据一些权威的精神疾病的分类体系如《国际疾病伤害及死因分类标准》(ICD)和美国的《精神障碍的诊断统计手册》(DSM)以及《中国精神疾病分类方案与诊断标准》(CCMD)中所描述的抑郁症的客观症状指标而进行[8,9]。在我国,抑郁症的诊断标准主要依据《中国精神疾病分类和诊断标准》第三版(CCMD-3)进行,具体的诊断标准见表 1[10]。此外,在心理咨询中,也往往使用抑郁症的自评量表,如《贝克抑郁问卷》、《Zung自评量表》、《汉密尔顿抑郁量表》(HAMD)及《蒙哥马利抑郁量表》(MADS)等评定抑郁症的严重程度,从而进行抑郁症状的筛查,流行病学调查和疗效评估,其有效性已得到证实。从现有的诊断和评价方法来看,抑郁症的临床诊断目前主要停留在医生对患者症状的观察和测评,以及患者自述其病症的严重程度等描述型的判断层面,尚未涉及到和病因相关的诊断标准,即深入到进行抑郁病变指标测定的检测层面[11]。这也是目前抑郁症临床误诊率高以及抑郁症动物病理模型和临床抑郁患者之间不能进行高效转换的重要原因。

表1 《中国精神疾病分类和诊断标准》关于抑郁症的诊断标准
2 抑郁症的动物模型
2.1 动物模型和行为学测试的区别
在利用动物实验评价候选抗抑郁药物活性的过程中,往往由于混淆动物模型和行为学测试的概念和使用范畴,降低抗抑郁药物的临床有效性[12]。鉴此,首先需阐明的一个问题,即为动物模型和行为学测试的区别。
“模型”通常是指,对动物进行神经生化或者环境行为等因素的处理,使之能够模拟出人的某种疾病。病理模型是疾病症状和病理病因多元素的集合,既包括自变量元素,即不同的病理模型的制备方法不同,又包括因变量元素,即由于不同的制备方法,继而导致动物在行为、神经、分子等产生相应的病理改变[13]。行为学测试则是为了评价特定药理活性的化合物而设计的筛选实验。与动物模型不同,“行为学测试”是行为评价的单元素集合,即通过评价化合物对不同的行为学测试引发的预期结果影响,来筛选出具有特定活性的化合物[14]。此外,病理学模型中采用的往往是发生特定病变的动物,行为学测试中采用的动物通常是正常的。
由此,常见的抗抑郁药物的筛选实验如小鼠悬尾实验、强迫游泳实验、颅内自身刺激(ICSS)实验、新奇环境诱导下的食欲减退实验(NIH)、获得性无助实验等属于行为学测试的范畴。慢性温和应激实验、社会挫败实验等能够通过社会、环境刺激使动物出现类似于抑郁的症状,以及一些结合抑郁症的发病机制定向培育和繁殖的转基因动物模型High DPAT Sensitive(HDS)大鼠、Fawn Hooded(FH)大鼠等属于本文要讨论的抑郁症动物模型的范畴。
2.2 抑郁症动物模型的评价指标
通常利用表面效度(face validity)、结构效度(construct validity)、预测效度(predictive validity)这三个效度对动物模型进行综合评价[15]。表面效度是指现象的相似性,指动物模型中动物的情绪表现应类似于人类相应的情绪表现,测量的指标中应包括相应的情绪障碍。结构效度是指动物模型建立在一个合理的构想上,即动物模型应该和人类的情绪障碍具有相似的原因、行为反应和共同的神经生物学机制。此外,情绪障碍的生理基础必须是相似的,包括交感神经系统的反应模式、下丘脑-垂体-肾上腺皮质轴的反应性,脑内相关神经递质的类型及变化趋势,细胞信号系统的参与模式和疾病是否有相同的神经生物学机制等。预测效度是指模型对
于相应情绪障碍有效的经典药物的反应性和选择性,反应性灵敏,选择型强的动物模型预测效度高[16]。
2.3 抑郁症动物模型与临床抑郁症的相关性
迄今,已有20多种方法可以用作抑郁症动物模型的制备,初步分为药物诱导的模型、社会环境应激模型、脑损伤模型、基因改变的遗传模型等类型。关于特定抑郁症动物模型的相关介绍,国内外的综述繁多,在此就不详细阐述各个模型的特征。结合抑郁症的临床诊断标准,和动物模型的评价指标,下文将对现有的抑郁症动物模型与临床抑郁症的相关性进行讨论。
2.3.1 药物诱导的模型
药物诱导的抑郁症动物模型,由于制备简单,时间短,耗用人力少等优点,在国内广泛使用。这类模型能够模拟出一定的“抑郁样”症状,但动物模型的病理机制局限,临床预测效度不高[17],详见表2。

表2 药物诱导的抑郁症动物模型与临床抑郁症的相关性
2.3.2 社会环境应激的模型
社会环境应激模型是通过一系列多变和不可预见的社会环境的应激,模拟人在生活中所遇到的各种困难,从而制备抑郁症的病理模型。其中慢性不可预知性温和应激模型(chornic unpredictive mild stress,CUMS),效度较高,应用最广。快感缺失是抑郁症的核心症状,CUMS模型采用糖水消耗量及糖水偏爱百分比的改变等评价指标,代表动物快感缺失的程度,具有一定的结构效度。但如果单纯利用糖水偏爱评价动物的抑郁程度,也易出现假阳性结果。例如雌性大鼠表现出快感缺乏的分裂现象,即对蔗糖水摄入减少,但对蔗糖水的偏好不变[18],这一点值得注意。除快感丧失外,CUMS模型动物还表现出性欲减退、侵犯攻击能力缺陷、社会交往能力下降、脑电图的改变等与临床抑郁症患者相似的症状,病症持续时间较长,约为3周,与临床病程标准一致,具有较好的表面效度。与临床治疗相似,抗抑郁药物通常治疗3~4周后,才能逆转CUMS动物快感消失的症状,相比其他模型,该模型的临床预测效度较高[19,20]。
2.3.3 基因改变的遗传模型
抑郁症具有高度的遗传性,约占总发病率的40% ~50%[21]。因此,基因改变的抑郁症动物模型与遗传型抑郁症有一定的相关性。随着转基因技术的不断发展,基因改变的遗传模型的种类渐增,但其有效性仍需要进一步确证[22]。常见的一些基因改变的遗传模型有Fawn-Hooden(FH)嗜酒大鼠、W isterKyoto(WKY)大鼠、糖皮质激素受体基因突变的小鼠模型等,见表2。利用基因改变的遗传模型结合慢性不可预知温和应激模型,对于遗传型抑郁症的治疗具有一定的应用前景。
2.3.4 脑损伤的模型
常见的脑损伤抑郁症动物模型为嗅球切除模型。该模型表面效度较高,病理生理学改变与人类抑郁相似度高,但造模过程中动物死亡率较高,临床预测效度较低,因此常用于抗抑郁药的次筛以及作用机制的研究。
综上所述,能够在表面效度、结构效度、预测效度等评价指标均具有高度有效性的抑郁症动物模型很少,那么,如何才能提高抑郁症动物模型临床预测的有效性呢?

表3 基因改变的遗传型抑郁症动物模型
3 抑郁症动物模型的转换研究
3.1 转化医学-提高动物模型的临床预测效度
转化医学(translational medicine)或称为转化研究(translational research),是 2003年由美国 EA.Zerhouni在NIH路线图计划(NIH Roadmap)中提出的[23]。其早期的经典含义是,将医学生物学基础研究成果迅速有效的转化成为临床实际应用的理论、技术、方法和药物,成为实验室到病房(bench to bedside,简称B2B)密切联系的桥梁。近年来,它已发展成为医学研究的一个分支,为了在基础研究与临床医学之间建立更直接的联系。它的研究模式也从起初的“基础—临床”单向模式开放为“基础-临床和临床-基础”双向(two-way)模式,以及“基础-基础-临床“以及“非医学-基础或临床医学”的多向(multi-way)模式[24,25]。它提倡以患者为中心(“patient-driven”),从患者的需求出发,以人为本,将临床迫切需要解决的问题,及时反馈到实验室,深入研究,从而使实验室研究的成果,迅速有效的应用于临床实践,使科学技术能够迅速有效的转化为生产力[26]。将转化医学的研究模式应用于药物研发过程中,打破基础医学、药物研发、临床医学之间的屏障,能缩短新药从实验室进入临床的过程,能够最终使患者更快地受益于生命科学的研究成果,已经成为未来新药研发的引擎[27,28]。
动物模型作为药物研发过程中不可缺少的环节,对于评价创新药物的有效性、安全性有着重要意义。精神疾病药物研发过程中一个不容忽视的阻碍就是,使用不合理的动物模型,动物模型得到的实验结果和临床应用的结果差异较大[29](图2A)。因此,如果能够将转化医学的思想应用于动物模型的建立和评价,缩短动物模型和临床疾病表现的疾病特征差异,使动物模型在行为表现、发病机制、基因遗传等多方面与临床抑郁症最大化吻合,动物模型的临床预测效度也会随之提高果。
3.2 生物标志物(biom arkers)—动物模型转换研究的信使
2009年,Wehling M等提出了将“转化医学”理论应用于创新药物临床前研究的实践体系,并针对该体系建立评分系统,分值的大小体现了不同的组成部分在转换研究体系中的重要程度[30]。其中,最重要的部分就是生物标志物(biomarkers)。那么,何谓生物标志物?在不同的研究领域,其定义不同。临床疾病的生物标志物,特指是在疾病发生和治疗过程中,一类能够反映机体所处的生物学状态变化的可以被客观测定的生化指标[31]。简言之,对于某类临床疾病,其生物标记物主要包括诊断标记物和治疗标记物两部分。诊断标记物的变化揭示了疾病的产生和消失,治疗标记物的改变则反映出疾病治疗的效果。对于不同的个体,其疾病的生物标志物有可能不同,因此对于生物标记物的研究,将推动 21 世 纪 3P 医 学 (prediction,prevention,personalization)的发展[32-34]。
尽管生物标志物在不同的个体间会有所差异[28],但近年来随着影像学、基因组学、蛋白组学、代谢组学等技术的不断发展,疾病的某类生物标志物在不同的动物种属间,即临床患者和动物病理模型二者间具有相似的变化规律和可比性。这类生物标志物有望成为转换研究的“信使”,架起动物病理模型和临床疾病的快速转换通道[35,36]。
3.3 抑郁症的生物标志物
关于抑郁症的生物标志物,目前尚处于探索发现阶段。Lin and Chen在进行如何预防抑郁症的研究中发现,抑郁症的易感性有与 FKBP5,GRIK1,GRIK4,GRIN2A,HTR2A,KCNK2六种基因的单核苷酸多态性(SNPs)相关,而CREB1,GRIA3,GRIK2等基因的SNPs与抑郁症患者自杀倾向相关[37],分子影像学的结果显示,脑组织白质密度过高的人更容易患重症抑郁症[38,39];青年抑郁症的易感人群与5HTT基因的SNP相关。以上抑郁症的诊断标记物的发现,可用于抑郁症易感和自杀人群的预防治疗。
此外,大量的研究表明,外周组织血管中的神经营养因子(BDNF)、胰岛素样因子(IGF-1)、炎症因子IL-1等是临床抑郁症患者治疗过程和抑郁症动物病理模型病变过程中共同存在的生物标志物,监控治疗的进展[40](详见图1)。Heath D Schmidt等人提出了“biomarker panel”的概念,认为抑郁症本身存在异质性的病理特征,造成了疾病的产生和治疗过程中,多个生物标志物共同作用的结果[40]。接收者操作特征(ROC曲线)的结果亦表明,单一生物标志物对于抑郁症治疗反应的灵敏度低,而对于“biomarker panel”进行综合评价,则显著提高了灵敏度[41]。

图1 临床发现的抑郁症的Biomarker Panel(摘自参考文献34)
3.4 抑郁症动物模型转换研究的策略
3.4.1 综合监控抑郁症的生物标志物
在抑郁症动物模型的建立和评价中,如果能够综合测定反映临床抑郁症患者诊治效果的生物标志物的变化,缩短临床抑郁症和基础抑郁症病理模型的潜在的病理特征差异,提高抑郁症动物模型的临床预测效度(图2B)。使动物模型在行为表现、发病机制、基因遗传等多方面与临床抑郁症最大化吻合,体现了将抑郁症从“临床”向“基础”的转换,动物模型的临床预测效度也会随之提高果。
3.4.2 联合应用多个抑郁症动物模型
现有的抑郁症动物模型能够完全符合表面效度、结构效度、预测效度标准的很少。因此在掌握各个抑郁症模型的病理特症的基础上,基于具体研究的目的,联合应用多个抑郁症动物模型,进行表面效度、结构效度、预测效度的互相补充和完善,使动物模型的表面效度、结构效度、预测效度的总分提高。例如,针对抑郁症的基因遗传的动物模型,结合一系列社会、环境等不可预知应激,更贴近于临床中抑郁症易感人群接受不可控的社会环境的压力后患抑郁症的情形。
4 展望
综上所述,监控抑郁症动物模型与临床抑郁症患者相关的生物标志物的变化,是进行抑郁症动物模型转换研究的关键步骤。然而,目前对于抑郁症生物标志物的研究尚处于起步阶段,仍需要进一步的确证工作,这也成为了目前抑郁症治疗领域的研究热点之一。相信随着大量抑郁症生物标志物的确证,不仅能够推动抑郁症的临床诊断由“症状描述”水平向“生物标志物检测”水平深入,提高抑郁症患者的诊治效果;而且有助于构建与临床预测效度高的抑郁症动物模型。合理应用多个临床预测效度较高的抑郁症动物模型,击破精神疾病药物研发的绊脚石,创新抗抑郁药物药物的研发成功率定能更上一个台阶。
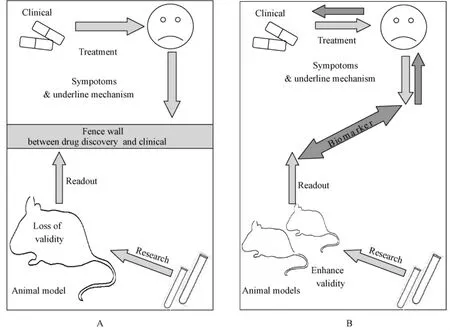
图2 抑郁症动物模型的转换研究
[1]Fava M,Kendler KS.Major depressive disorder.Neuron.2000.28(2):335-41.
[2]Kessler RC,Berglund P,Dem ler O,et al.Lifetime prevalence and age-of-onset distributions of DSM-IV disorders in the National Comorbidity Survey Replication[J].Arch Gen Psychiatry,2005,62:593-602.
[3]江开达.抑郁症的诊断与治疗[J].医学与哲学(临床决策论坛版),2010:12-13+23.
[4]Murray CJ,Lopez AD.Alternative projections of mortality and disability by cause 1990-2020:Global Burden of Disease Study[J].Lancet,1997,349:1498-504.
[5]王真真,张有志,宫泽辉,等.抑郁症治疗的新靶点和新策略[J].中国药理学与毒理学杂志,2010:364-370.
[6]Agid Y,Buzsaki G,Diamond DM,et al.How can drug discovery for psychiatric disorders be improved?[J].Nat Rev Drug Discov,2007,6:189-201.
[7]McArthur R,Borsini F.Animal models of depression in drug discovery:a historical perspective[J].Pharmacol Biochem Behav,2006,84:436-52.
[8]ICD-10.International Statistical Classification of Diseases and Related Health Problems.10th Revision[J].1994.
[9]DSM-IV-TR.Text revision of the Diagnostic and Statistical Manual of Mental Disorders.4th Revision[J].2000.
[10]中华医学会精神科学会.《中国精神障碍分类与诊断标准》(CCMD-3)[J].2001:50-51.
[11]van Praag HM,de Kloet ER,van Os J.Stress,the Brain and depression[J].2004.
[12]Frazer A,Morilak DA.What should animal models of depression model?[J].Neurosci Biobehav Rev,2005,29:515-23.
[13]Cryan JF,Slattery DA.Animal models of mood disorders:Recent developments[J].Curr Opin Psychiatry,2007,20:1-7.
[14]Pollak DD,Rey CE,Monje FJ.Rodent models in depression research:classical strategies and new directions[J].Ann Med,2010,42:252-64.
[15]Willner P.The validity of animal models of depression[J].Psychopharmacology(Berl),1984,83:1-16.
[16]张连峰,秦川.比较行为学基础[J].2010,7:168-169.
[17]Kobayashi T,Hayashi E,Shimamura M,et al.Neurochemical responses to antidepressants in the prefrontal cortex of m ice and their efficacy in preclinical models of anxiety-like and depressionlike behavior:a comparative and correlational study[J].Psychopharmacology(Berl),2008,197:567-80.
[18]Baker SL,Kentner AC,Konkle AT,et al.Behavioral and physiological effects of chronic mild stress in female rats[J].Physiol Behav,2006,87:314-22.
[19]W illner P.Validity,reliability and utility of the chronic mild stress model of depression:a 10-year review and evaluation[J].Psychopharmacology(Berl),1997,134:319-29.
[20]W illner P.Chronic mild stress(CMS)revisited:consistency and behavioural-neurobiological concordance in the effects of CMS[J].Neuropsychobiology,2005,52:90-110.
[21]张均田,张庆柱,张永祥.神经药理学[M]:人民卫生出版社,2008:312.
[22]Porsolt RD.Animal models of depression:utility for transgenic research[J].Rev Neurosci,2000,11:53-58.
[23]Zerhouni E.Medicine.The NIH Roadmap[J].Science(80-),2003,302:63-72.
[24]Honey K.Translating medical science around the world[J].J Clin Invest,2007,117:2737.
[25]Keramaris NC,Kanakaris NK,Tzioupis C,et al.Translational research:from benchside to bedside[J].Injury,2008,39:643-50.
[26]Guan JJ.Translational medical science:the medical science beneficial to patients[J].Basic Clin Med,2008,8:785-788.
[27]Wehling M.Drug development in the light of translational science:shine or shade?[J].Drug Discov Today,2011.
[28]刘昌孝.转换医学在新药研究开发中的应用[J].现代药物与临床,2010:321-326.
[29]Einat H,Manji HK.Cellular plasticity cascades:genes-tobehavior pathways in animal models of bipolar disorder[J].Biol Psychiatry,2006,59:1160-71.
[30]Wehling M.Assessing the translatability of drug projects:what needs to be scored to predict success?[J].Nat Rev Drug Discov,2009,8:541-6.
[31]Perlis RH.Betting on biomarkers[J].Am J Psychiatry,2011,168:234-6.
[32]Hocquette JF.Where are we in genom ics?[J].J Physiol Pharmacol,2005,56Suppl 3:37-70.
[33]Issa AM.Personalized medicine and the practice of medicine in the 21st century[J].Mcgill J Med,2007,10:53-7.
[34]Morabia A,Costanza MC.W hat is this thing called preventive medicine(II)?[J].Prev Med,2008,47:1-2.
[35]Wendler A,Wehling M.The translatability of animal models for clinical development:biomarkers and disease models[J].Curr Opin Pharmacol,2010,10:601-6.
[36]Rupniak NM.Animal models of depression:challenges from a drug development perspective[J].Behav Pharmacol,2003,14:385-90.
[37]Lin E,Chen PS.Pharmacogenom ics with antidepressants in the STAR*D study[J].Pharmacogenom ics,2008,9:935-46.
[38]Papakostas GI,Iosifescu DV,Renshaw PF,et al.Brain MRI white matter hyperintensities and one-carbon cycle metabolism in non-geriatric outpatients with major depressive disorder(Part II)[J].Psychiatry Res,2005,140:301-7.
[39]Papakostas GI,Fava M.Predictors,moderators,and mediators (correlates)of treatment outcome in major depressive disorder[J].Dialogues Clin Neurosci,2008,10:439-51.
[40]Schm idt HD,Shelton RC,Duman RS.Functional Biomarkers of Depression:Diagnosis,Treatment,and Pathophysiology.LID - 10.1038/npp.2011.151 [doi] [J].Neuropsychopharmacology,2011.
[41]Kraemer HC,Schultz SK,Arndt S.Biomarkers in psychiatry:methodological issues[J].Am J Geriatr Psychiatry,2002,10:653-9.

