DPP Ⅳ基因影响卵巢癌细胞生物学行为的机制探讨
王忠民 卢永科
(1 大连妇产医院妇二科,辽宁 大连 116033;2 大连医科大学毒理学研究所,辽宁 大连 116021)
卵巢肿瘤是女性生殖器常见的肿瘤之一,其中恶性卵巢癌约占10%,居女性生殖器恶性肿瘤的第3位,而上皮性卵巢癌是妇产科恶性肿瘤中主要的死亡原因。卵巢癌患者一方面由于卵巢的盆腔解剖特点,加之目前缺乏特异性的诊断方法,造成了早期发现的困难性,所以卵巢癌在临床经常是潜行的,在确诊时已近晚期。发生远处转移的晚期病例虽然通过提高手术技巧可以做到最大程度的肿瘤细胞减灭术同时结合包括铂类、紫杉醇类以及众多二线化疗药物在内的综合治疗手段,但是卵巢癌患者的5年生存率仍然很低[1]。卵巢癌发生转移的主要方式是直接种植播散、淋巴结和血行转移。如能抑制和治疗卵巢癌的远处转移对提高5年生存率是有意义的。随着分子生物学和肿瘤基础研究的飞跃发展,使人们认识到肿瘤最终是一种基因病。基于此认识人们可以从分子和基因水平探索卵巢癌的病因和发病机制并寻找卵巢癌的诊断和治疗方法。人类DPP Ⅳ基因定位于2q24,约90kb,含26个外显子。它编码766个氨基酸的多肽链,相对分子质量约110×103的跨膜糖蛋白[2]。随着研究的深入,发现DPP Ⅳ基因在肿瘤进展中起重要作用[3,4],但是其具体作用机制研究比较少。我们此次探讨DPP Ⅳ基因抑制卵巢癌细胞系恶性行为的可能机制。
1 材料与方法
1.1 实验材料
细胞系:HO-8910PM卵巢癌细胞系是来自于人类卵巢浆液性乳头状囊腺癌,购于中科院典型培养物保藏委员会细胞库;将真核表达载体PcDAN3.1(+)和全长野生型DPP Ⅳ基因通过阳离子脂质体转染HO-8910PM卵巢癌细胞系,分别命名为HOPcDAN和HODPP Ⅳ细胞。HODPP Ⅳ细胞高表达DPP Ⅳ基因,以上细胞转染及建立均由本实验室完成。HO-8910PM细胞系培养于RPMI 1640培养液中,其中含10%FCS、100U/mL青霉素和100μg/mL链霉素。HOPcDAN和HODPPⅣ细胞培养于上述培养液,另外还加入400μg/mLG418维持压力筛选。3种细胞均置于37℃的5%浓度CO2孵育箱中培养。
侵袭小室(Mill cell Chamber)购于BD公司。
1.2 试剂
碘化丙啶(PI)购于北京岳泰生物公司;吖啶橙购于上海聚源生物科技有限公司;G418购于Invitrogen公司;凋亡DNA梯形检测试剂盒(TACS Apoptotic DNA Laddering Kit,Trevigen,Inc);兔抗人Bcl-2和Fas单克隆购于Sigma公司;人工基质胶(Matrigel)购于北京大学医学院病理学教研室。
1.3 方法
1.3.1 流式细胞(FCM)法测定不同卵巢癌细胞系的凋亡率及细胞周期
HO-8910PM、HOPcDNA和HODPP Ⅳ细胞分别取5×104个制备成单细胞悬液,经PBS漂洗两次后离心,100目筛网过滤离心。加入PI工作液0.5mL(工作浓度10μg/mL),室温避光放置30min后,利用流式细胞仪检测。检测前以标准荧光微球调整仪器的变异系数,使其稳定在2%范围内。检测时收集2×104个细胞,荧光强度以对数级放大,光散射数据存盘。数据利用Macintosh 650计算机上的Modifit软件分析。利用设门的方法(横坐标前向角,纵坐标侧向角)将坏死细胞框除,计算细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.3.2 吖啶橙染色观察细胞凋亡现象
3种细胞分别取5×104个制备成单细胞悬液,经PBS漂洗两次后离心,100目筛网过滤离心。盖玻片放置于6孔培养板中,分别加入3种经过上述方法处理的细胞悬液,置于37℃,5%CO2培养箱中培养24h,使HO-8910PM、HOPcDNA和HODPP Ⅳ细胞爬行于玻片后,PBS液漂洗3次,每次3min。吸净PBS液后将配制好的吖啶橙溶液滴于盖玻片上,直接反转,放于洁净盖玻片上,荧光显微镜观察,摄片。
1.3.3 DNA Ladder 测定
实验方法严格按TACS Apoptotic DNA Laddering Kit操作说明进行。
1.3.4 透射电镜观察
透射电镜标本制作参考文献[5]。
1.3.5 Wester blot 检测Fas/Bcl-2基因表达
具体操作参考文献[6]。采用TAKARA公司提供的Image Master ED Elite V3.01分析软件对Wester blot图像进行光密度扫描,计算DDP IV/β-actin比值,用以比较各细胞DDP IV基因蛋白表达水平差异。
1.3.6 不同卵巢癌细胞增殖
取HO-8910PM、HOPcDNA和HODPP Ⅳ卵巢癌细胞,以8000个细胞/200μL/孔 分别接种于96孔培养板,同时与试验孔平行设不加细胞只加培养液的空白对照孔,从接种后第24h开始每种细胞每天取6孔,采用MTT法检测细胞活性。选492nm波长,在酶标仪上测定各孔吸光度(absorbance A492值),取6孔平均值记录结果,以时间为横轴,A492值为纵轴绘制细胞生长曲线,连续测定7d。
1.3.7 细胞体外黏附试验
具体操作参考文献[7]。
1.3.8 体外细胞侵袭测定
细胞侵袭性测定使用Matrigel侵袭小室,具体操作参考文献[8]。
1.3.9 体外细胞趋化能力测定
方法步骤与体外侵袭力测定相同,只是侵袭小室的滤膜不用人工基质胶覆盖。
1.4 统计学分析
每个细胞结果均重复6次。计数资料以百分比表示,计量资料以表示。利用SPSS10.0统计软件包进行统计分析。计量资料多样本均数间的两两比较采用单向方差分析(One-way ANOVA),计数资料多样本间比较采用χ2检验,P<0.05为差异有显著性。
2 结 果
2.1 不同细胞系的凋亡率及细胞周期
HO-8910PM、HOPcDNA和HODPP Ⅳ细胞在细胞周期G1期前均出现亚二倍体凋亡峰。但是HODPP Ⅳ细胞的凋亡峰更明显。HODPPⅣ细胞凋亡率显著高于HO-8910PM、HOPcDNA细胞(P<0.05);HO-8910PM和HOPcDNA细胞凋亡率比较无显著性差异(P>0.05)。具体数值见表1和图1。
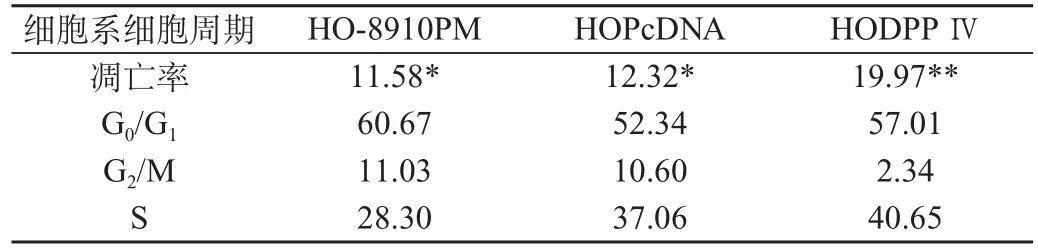
表1 3种细胞的凋亡率及细胞周期的变化(%)
2.2 吖啶橙染色细胞凋亡形态
HO-8910PM和HOPcDNA细胞未发生凋亡时细胞核为均匀黄色或黄绿色荧光,核内RNA为红色,细胞质为桔红色或红色;当HODPPⅣ细胞发生凋亡时,细胞膜包裹部分细胞质和部分细胞核组成成分从细胞上分离,形成典型的凋亡小体。或细胞膜仅包裹部分细胞质从细胞上分离,形成不典型的凋亡小体。见图2、图3。
2.3 细胞凋亡的DNA梯形图
HO-8910PM和HOPcDNA细胞未发生凋亡时电泳后无梯形条带出现,HODPP Ⅳ细胞发生凋亡时电泳后可出现明显的梯形条带,见图4。
2.4 透射电镜观察凋亡形态
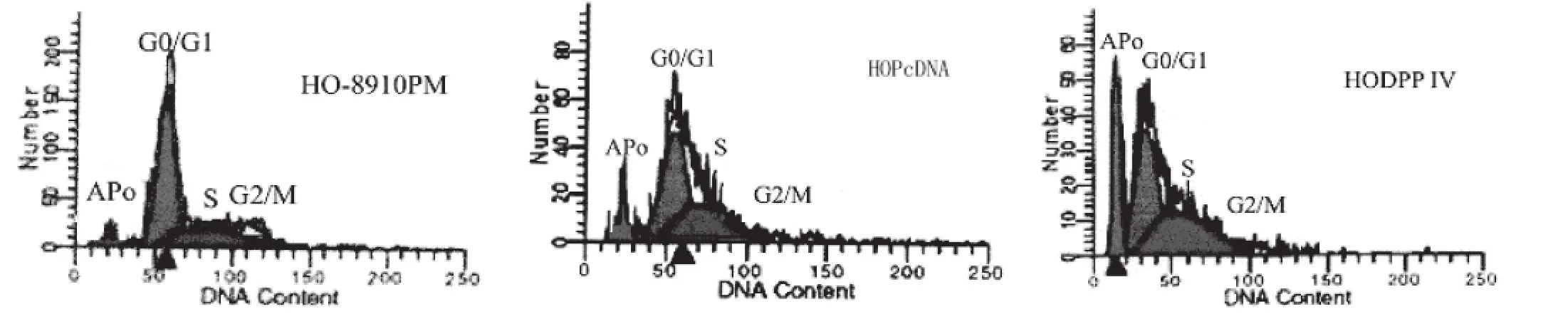
图1 3种细胞亚二倍凋亡峰及细胞周期变化

图2 荧光显微镜下HO-8910PM、HOPcDNA细胞未发生凋亡(10×40)

图3 荧光显微镜下HODPP Ⅳ细胞发生凋亡(10×40)
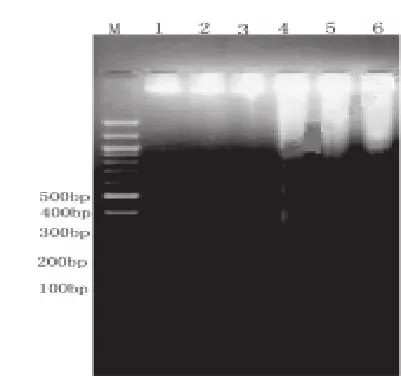
图4 HO-8910PM、HOPcDNA和HODPPⅣ细胞DNA梯形图检测
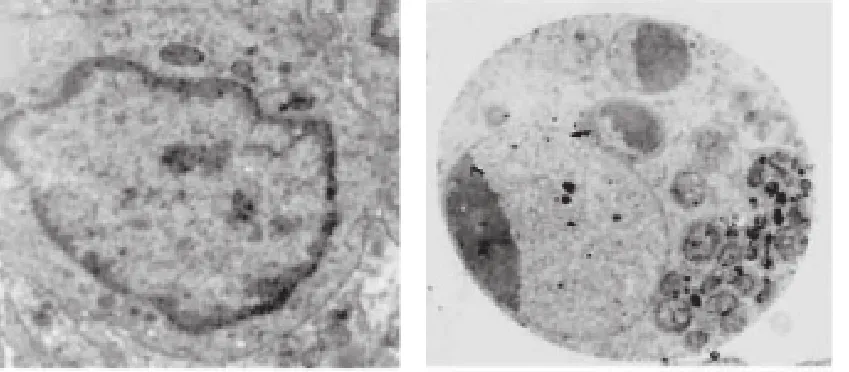
图5 透射电镜下HO-8910PM、HOPcDNA细胞未发生凋亡(上)及HODPP Ⅳ细胞发生凋亡的形态(下)(×6000)
在透射电镜可见:当HODPP Ⅳ细胞发生凋亡时,细胞体积变小,细胞浆浓缩,线粒体轻度肿胀,细胞浆内见空泡增多;细胞膜保存完整,细胞膜表面微绒毛和伪足减少或消失;细胞膜出现出芽、出泡现象。细胞核浓缩和边集甚至发生破碎(图5)。
2.5 Fas/Bcl-2基因蛋白表达水平
HODPP Ⅳ细胞Fas基因蛋白表达水平明显高于HOPcDNA和HO-8910PM细胞(P<0.05);HOPcDNA细胞和HO-8910PM细胞比较无差异(P>0.05)。HO-8910PM和HOPcDNA细胞Bcl-2基因蛋白表达水平明显高于HODPP Ⅳ细胞(P<0.05);HO-8910PM和HOPcDNA细胞比较无差异(P>0.05)。见图6、图7。
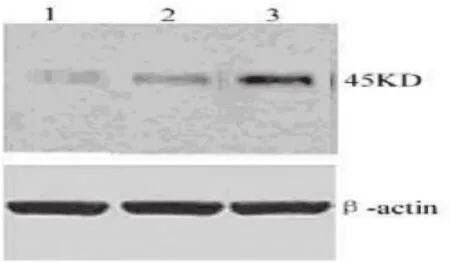
图6 Wester blot检测Fas基因表达水平
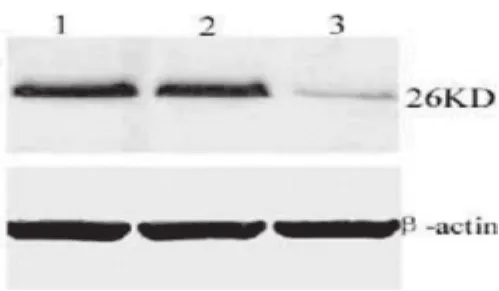
图7 Wester blot检测Bcl-2基因表达水平
2.6 细胞增殖曲线
所有细胞在前4d均处于缓慢的增殖状态,4d后3种细胞才开始进入相对较快的增殖状态。HO-8910PM和HOPcDNA细胞增殖速度比较无显著性差异(P>0.05);而HODPP Ⅳ细胞在7d内的增殖速度始终低于HO-8910PM和HOPcDNA细胞,统计分析有显著性差异(P<0.01),见图8。

图8 不同细胞系增殖曲线
2.7 体外细胞侵袭性测定
HO-8910PM、HOPcDNA和HODPP IV细胞侵袭到膜下和侵袭小室下室的平均细胞数分别为(138.67±3.06)、(136.00±3.61)和(61.33±3.06)。HO-8910PM与HOPcDNA细胞系比较无显著性差异(P=0.912);HODPP Ⅳ细胞显著低于HO-8910PM和HOPcDNA细胞(P<0.001)。
2.8 体外细胞移动性测定
HO-8910PM、HOPcDNA和HODPP Ⅳ细胞系侵袭到膜下和侵袭小室下室的平均细胞数分别为(204.67±2.89)、(208.00±9.64)和(125.67±6.43)。HO-8910PM和HOPcDNA细胞系比较无显著性差异(P=0.944); HODPP Ⅳ细胞显著低于HO-8910PM和HOPcDNA细胞(P=0.001;P=0.002)。
2.9 不同细胞系的黏附试验
HO-8910PM、HOPcDNA和HODPP IV细胞系黏附细胞数分别为(144.33±4.73)、(140.67±3.22)和(72.33±3.22)。HO-8910PM和HOPcDNA细胞系比较无显著性差异(P=0.28); HODPP IV细胞显著低于HO-8910PM和HOPcDNA细胞(P<0.001)。
3 讨 论
细胞表面表达的DPP Ⅳ基因最初作为T细胞激活分子,目前认为是免疫系统细胞激活的普遍标志物。DPP Ⅳ组织分布比较广泛,但是在不同组织之间表达差别很大。在一些肿瘤细胞DPP Ⅳ的高表达与肿瘤细胞的侵袭力呈正相关性[2,9-12]。我们在前期工作中也得出相同结论[13]。为了研究DPP Ⅳ基因的高表达对高转移能力的卵巢癌细胞系生物行为的影响,我们利用阳离子脂质体转染法将人类全长野生型DPP Ⅳ基因转染到人类卵巢癌细胞系HO-8910PM细胞中,经G418压力筛选后克隆出1株高表达DPP Ⅳ基因的卵巢癌细胞系命名为HODPPⅣ,用于卵巢癌细胞中DPP IV基因功能的研究。结果显示,在体外的研究中发现转染了DPP Ⅳ基因的HODPP Ⅳ细胞与母系HO-8910PM、HOPcDNA细胞系比较,其细胞增殖能力、黏附性、移动性和侵袭性显著降低。研究表明DPP Ⅳ基因的高表达和其蛋白产物的高活性有抑制肿瘤细胞恶性表型的作用。
细胞凋亡(apoptosis)又称细胞程序性死亡(programmed cell death,PCD),是指细胞在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的过程。它是一个主动的,高度有序的,基因控制的,一系列酶参与的过程。由于它在保证多细胞生物的健康生存过程中扮演着关键角色,对个体的正常发育及细胞凋亡紊乱在病理学研究中的重要作用,引起了人们对其机制和组分的广泛而深入地研究。实验过程中我们发现一种很有趣的现象,光镜下母系HO-8910PM细胞和HOPcDNA细胞大多数细胞为不规则多边形,细胞呈铺石状排列,核大、深染,核仁清晰,染色质颗粒粗,核分裂相易见;而HODPPⅣ细胞呈现圆形和椭圆形,细胞核明显缩小,大部分细胞相互接触,呈现较为紧密排列状生长,且细胞增殖、侵袭和转移能力明显降低。为了研究此现象发生的原因,本研究尝试应用了多种方法从不同层面探讨细胞凋亡是否在其中起作用。结果显示转染了DPP Ⅳ基因并高表达DPP Ⅳ基因的HODPP Ⅳ细胞在细胞各个不同增殖期均出现了明显的凋亡现象;同时在高表达DPP Ⅳ基因的HODPP Ⅳ细胞中凋亡促进基因Fas高表达,而凋亡抑制基因Bcl-2却明显低表达。国外学者[4]在研究中也发现了类似现象。本研究结果提示凋亡机制是DPP Ⅳ基因抑制高转移潜能卵巢癌细胞系HO-8910PM恶性行为的机制之一。
综上所述,DPP Ⅳ基因在各种良、恶性肿瘤中具有很多生物学功能。由于DPP Ⅳ基因与肿瘤的相关性是在近年才被关注,因此相关的研究资料有限,在这里尚无法完全的剖析和解释其在恶性肿瘤的发生、发展和侵袭转移的分子生物学机制。目前国际上许多学者正致力于研究DPP Ⅳ基因的表达水平及其酶的活性在各种组织环境中的不同生理学作用。虽然DPP Ⅳ基因是一个有用的诊断和预后的指标,但是目前尚未有关将诱导或抑制DPP Ⅳ基因表达作为治疗手段的报道,但是随着DPP Ⅳ基因在恶性肿瘤转化和侵袭转移机制中生物学作用的逐渐明确,有望在准确地理解DPP Ⅳ基因生物学特性的基础上,找到治疗恶性肿瘤的新的途径和方法。
[1] Weide R,Arndt M,Pandorf A,et al.Ovarian cancer treatment reality in northern Rheinland-Pfalz (Germany).Suboptimal surgical treatment as a possible cause for inferior survival[J].Onkologie,2007,30(12): 611-617.
[2] Havre PA,Abe M,Urasaki Y,et al.The role of CD26/dipeptidyl peptidase IV in cancer[J].Front Biosci,2008,13: 1634-1645.
[3] Ghersi G,Zhao Q,Salamone M,et al.The protease complex consisting of dipeptidyl peptidase IV and seprase plays a role in the migration and invasion of human endothelial cells in collagenous matrices[J].Cancer Res,2006,66(9): 4652-4661.
[4] Yu DM,Wang XM,McCaughan GW,et al.Extraenzymatic functions of the dipeptidyl peptidase IV-related proteins DP8 and DP9 in cell adhesion,migration and apoptosis[J].FEBS J,2006,273(11):2447-2460.
[5] 蔡文琴.现代实用细胞与分子生物学实验技术[M].北京:人民军医出版社,2003:222-230.
[6] Sambrook J,Fritsch EF,Maniatis.T著.金冬雁,黎孟枫,侯云译.分子克隆实验指南[M].2 版.北京:科学出版社,1992:768-798.
[7] Ghersi G,Dong H,Goldstein LA,et al.Regulation of fibroblast migration on collagenous matrix by a cell surface peptidase complex[J].J Biol Chem,2002,277(32): 29231-29241.
[8] Kajiyama H,Kikkawa F,Suzuki T,et al.Prolonged survival and decreased invasive activity attributable to dipeptidyl peptidaseⅣ over expression in ovarian carcinoma[J].Cancer Research,2002,62(10): 2753-2757.
[9] Ożóg J,Jarząb M,Pawlaczek A,et al.Expression of DPP4 gene in papillary thyroid carcinoma[J].Endokrynol Pol,2006,57(Suppl A):12-17.
[10] Masur K,Schwartz F,Entschladen F,et al.DPPIV inhibitors extend GLP-2 mediated tumour promoting effects on intestinal cancer cells[J].Regul Pept,2006,137(3): 147-155.
[11] Roesch A,Wittschier S,Becker B,et al.Loss of dipeptidyl peptidase IV immunostaining discriminates malignant melanomas from deep penetrating nevi[J].Mod Pathol,2006,19(10): 1378-1385.
[12] Taniguchi K,Takano T,Miyauchi A,et al.Differentiation of follicular thyroid adenoma from carcinoma by means of gene expression profiling with adapter-tagged competitive polymerase chain reaction[J].Oncology,2005,69(5): 428-435.
[13] 王忠民,卢永科,韩莹等.不同恶性行为卵巢癌细胞系CD26/DPP IV基因的表达[J].中国医学科学院学报,2005,27(2): 205-210.

