食品动物细胞色素P450的研究进展
刘兆颖,伍 勇(综述),孙志良(审校)
(湖南农业大学动物医学院湖南省兽药工程技术研究中心,长沙410128)
细胞色素P450酶(cytochrome P450,CYP)是一复杂的多酶体系,CYP多肽链的分子量因动物种属不同而异。CYP酶系的特异性及底物重叠性,大部分是由于存在大量CYP同工酶,这些酶的氨基酸序列具有高度同源性,可归于同源蛋白质。食品动物CYP是指参与食品动物(猪、牛、羊、鸡、鱼等)机体内各种外源物质,如兽药、饲料添加剂、环境污染物等异物代谢转化的P450酶系的总称。研究食品动物细胞色素P450,有利于指导兽医临床合理用药,避免中毒和药物的相互作用;指导新兽药设计与剂型改进;也有利于指导残留分析和残留监控,保障食品安全和消费者的健康。因此,食品动物中CYP的研究越来越受到国内外的重视。目前,研究人和实验动物CYP的报道较多,而研究食品动物中CYP相对很少,且大部分研究只证明了CYP在食品动物中的表达和活性,而与兽药的联系不紧密。在此将国内外有关食品动物中细胞色素P450酶的影响因素,几种细胞色素P450同工酶在食品动物中的表达和活性等方面的研究进展予以综述,为兽药的CYP进一步研究提供重要的基础。
1 CYP1A
CYP1A除参与有机环境污染物的生物转化外,一些兽药也可经该酶代谢,如阿苯哒唑、噻苯哒唑、甲苯哒唑、咖啡因和雌二醇,CYP1A能活化一些多环芳香烃和聚氯联(二)苯等前致癌物。猪体内CYP1A同工酶虽然证实它可被β-萘黄酮或多氯联苯所诱导,但目前尚未进行测序研究[1,2]Western杂交发现猪、牛和羊的CYP1A与人的CYP1A2抗体无交叉反应,但与抗鼠CYP1A1/2 IgG有很强的交叉反应[3]。猪的 CYP1A蛋白与抗兔CYP1A1/2有较弱的交叉反应[4]。用 CYP1A的特征底物和Western杂交发现:牛肝中的 CYP1A活性很高,与绵抗大鼠CYP1A1存在很高的交叉反应,并推测牛中可能存在两种CYP1A同工酶[5]。CYP1A亚家族可被植物中的许多营养素所诱导[6],因此,牛中高表达的CYP1A可能与此有关。目前,从鸡胚肝中纯化和确定了四氧二苯二氧杂环己二烯诱导的两个CYP,一个命名为CYP1A4,具有乙氧-9-羟基异吩噻唑-O-脱乙基酶和芳香烃羟化酶的活性;另一个命名为CYP1A5,具有四氧二苯二氧杂环己二烯诱导的花生四烯酸的环氧化和他莫昔芬的4-羟化,但没有乙氧-9-羟基异吩噻唑-O-脱乙基酶和芳香烃羟化酶的活性[7-8]。并对鸡的CYP1A进行了克隆和表达[9]。鱼的CYP1A基因可作为评价水生环境污染的生物标志物,但是,鱼的CYP1A在不同品种之间的序列相似性不高CYP1A抗体在不同鱼物种间的交叉反应很低。目前,从雌雄同体鱼中克隆了CYP1A的cDNA序列,并在大肠埃希菌中重组表达成功[10]。
2 CYP2A
目前,从猪肝微粒体中分离、纯化了CYP2A,并用免疫染色分析N-末端的20个氨基酸序列,发现有14个氨基酸与人的CYP2A6相同(70%)[11]。并且研究发现猪个体之间存在很大的CYP2A代谢差异引起这差异的原因并不是猪中存在CYP2A多态性而是由于转录调控[12],该基因在小猪中有1620 bp和1795 bp两条 cDNAs(GenBank accession number AY380866),长的或野生型cDNA与猪CYP2A19序列同源(GenBank accession number AB052255),该基因编码的蛋白有99%与CYP2A19一致,即494个氨基酸中有493个是一样的;短的cDNA与普通猪CYP2A19序列相似,该基因编码487个氨基酸,前面466个中有464个与普通猪CYP2A19一样,409个与人的CYP2A6,其他的氨基酸都不同。普通猪和小猪的野生型CYP2A包含6个底物识别位点,而短的CYP2A只有前5个底物识别位点。
3 CYP2C
从猪的小肠cDNA文库中转录了CYP2C42基因,该基因是由327个氨基酸编码的开放读码框架,并不是全长的克隆。Zaphiropoulos等[4]用反转录-聚合酶链反应方法从排卵前的滤泡中得到了5条cDNA克隆,以cDNA为模板扩增,得到5个DNA双链,分别命名为CYP2C32、CYP2C33、CYP2C34、CYP2C35、CYP2C36。从猪肝微粒体中分离、纯化了CYP2C,并用免疫染色分析N-末端的20个氨基酸序列,发现有10个氨基酸与人的CYP2C9相同(50%)[11]。Baader等[13]克隆了鸡的第一个CYP2C亚家族cDNA,命名为CYP2C45,在发现该基因前,认为鸡中CYP2H1是CYP2C的类似物,苯巴比妥能诱导CYP2C45 mRNA增加,诱导的机制与CYP2H1基因的一个264 bp苯巴比妥反应增强单位相似[14],即在2.6 kb片段中有一个CYP2H1苯巴比妥反应增强单位的核因子1位点和同向重复核受体结合位点。
4 CYP2D
牛的CYP2D蛋白已克隆,与人的CYP2D6相比,核苷酸序列只有不到7%的差别。目前,从猪的小肠cDNA文库中已转录了CYP2D25基因[15],在猪的肝微粒体中也分离了CYP2D25,该蛋白77%以上的序列与人的CYP2D6相同,并催化一些共同的底物,如普萘洛尔、丁呋洛尔、右美沙芬和托特罗定[2]。而人的CYP2D6不能催化维生素D的25-羟化[16]。Sakuma等[15]总结了不同种属的 CYP2D同工酶与人的CYP2D6核苷酸和氨基酸序列的一致性(表1)。
5 CYP2E
CYP2E1主要参与一些低分子质量异物的代谢活化。小猪的CYP2E1已经分离纯化、cDNA克隆和测序,猪和小猪的CYP2E1由496个氨基酸组成,比人的少两个残基。猪和小猪的CYP2E1结构上只有细微的差别,即第346位的氨基酸不同,猪的是缬氨酸,小猪的是天冬氨酸,而人的是谷氨酸,这样,小猪的CYP2E1跟人的更相似[17]。CYP2E1的结构是CYP中最保守的酶之一,在不同种属之间,将近80%的氨基酸序列是一致的[16],因此,许多动物都有相似的催化特征。猪与人的CYP2E1结构上的主要区别是底物识别[18],猪在该区域的两个氨基酸是His92和Asn95,而人的都是天冬氨酸。

表1 其他动物CYP2D同工酶与人CYP2D6核苷酸和氨基酸序列的比较
6 CYP3A
CYP3A是异物代谢中最重要的CYP,参与的底物相当广泛。Western杂交发现猪、牛和羊的CYP3A蛋白与抗人的CYP3A4 IgG有较强的交叉反应,但与抗鼠CYP3A1 IgG的交叉反应较弱。在V79中国仓鼠细胞中表达了牛的全长CYP3A cDNA序列,该蛋白能使睾酮包括6β在内的许多位置的羟化,也能被CYP3A抑制剂酮康唑所抑制[19]。van't Klooster等[20]用抗鼠CYP3A1的单克隆抗体检测到牛后线粒体液一条免疫反应蛋白。并有研究者从绵羊中纯化了CYP3A蛋白,该蛋白能被醋竹桃霉素诱导,催化红霉素、氯丙嗪、氯苯那敏和溴己新的 N-脱甲基化[21]。目前,从猪的小肠 cDNA文库中已转录了CYP3A29基因,从猪肝微粒体中分离、纯化了CYP3A29,并用免疫染色分析N-末端的20个氨基酸序列,发现有12个氨基酸与人的 CYP3A4相同(60%)。不同种属的CYP3A同工酶与人的CYP3A4核苷酸和氨基酸序列的比较见表2。
7 CYP4A
CYP4A包含许多同工酶,主要催化各种脂肪酸的ω和ω-1氧化,包括月桂酸、花生四烯酸和前列腺素[22]。比较猪、牛、山羊和绵羊肝微粒体的12-月桂酸羟化酶的活性,发现羊肝中的12-月桂酸羟化酶的活性很高。猪的CYP4A21在底物特异性和结构特征上与其他的CYP4A不同,它是CYP4A中唯一催化脱氧鹅胆酸的 6α-羟化,参与胆汁酸的合成CYP4A21有 95% 的基因序列与 CYP4A24和CYP4A25相同,大小约13 kb,有12个外显子,并且研究表明猪的CYP4A21和CYP4A24的基因都是从一个遗传基因复制而来,其5'末端高度一致,主要不同的是6~8外显子之间的核苷酸序列[23]。
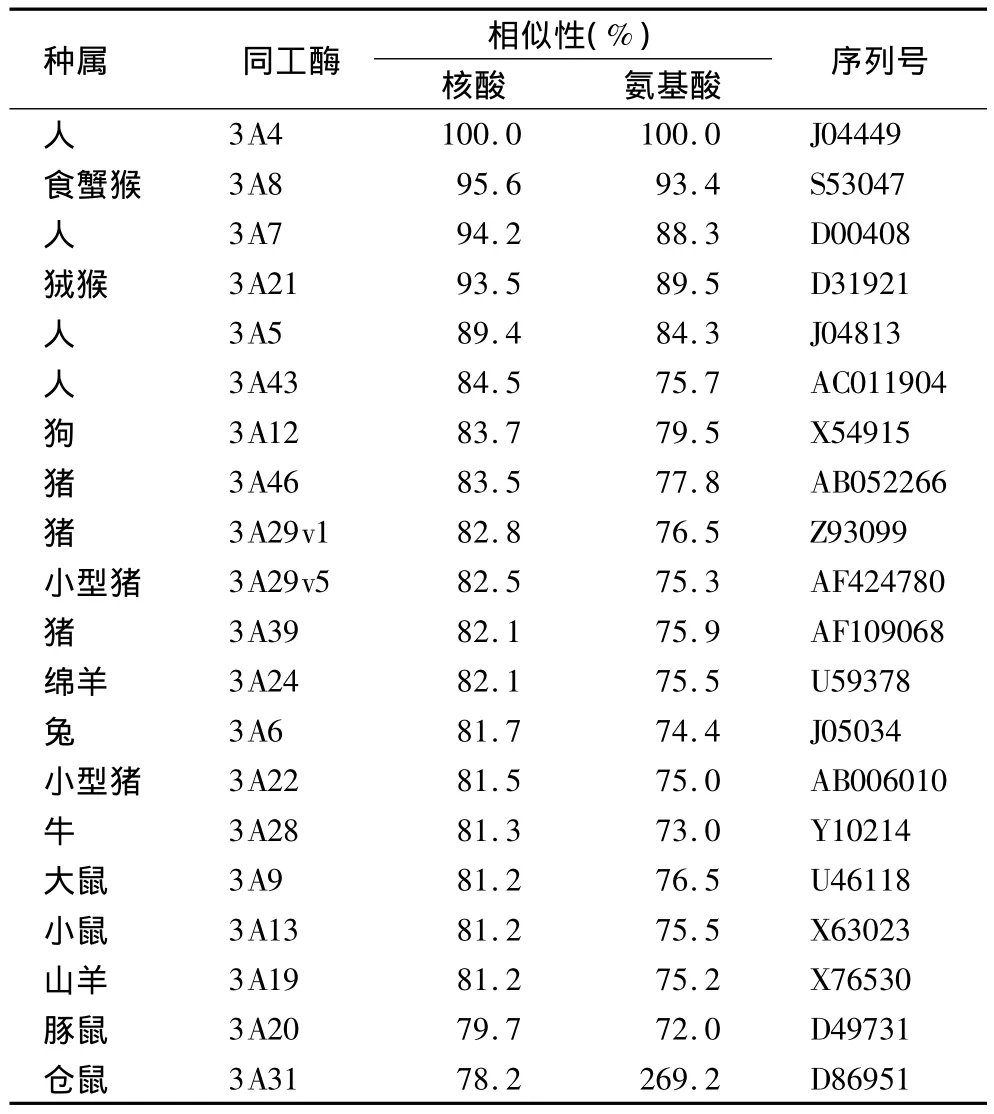
表2 其他动物CYP3A同工酶与人CYP3A4核苷酸和氨基酸序列的比较
8 展望
目前对食品动物细胞色素P450酶的研究还只停留在代谢酶序列种属差异比较、活性及含量测定等常规研究上,而对CYP参与兽药代谢,CYP作用的分子机制、表达调控及结构与功能的关系及翻译后修饰等领域的研究有待进一步深入。随着生物学、分子生物学、医药学、畜牧业及分子药理学、药效学、毒理学等相关学科的发展和新仪器新技术的出现,先进实验技术和检测技术也在不断地增加,药物代谢酶及相关学科领域必将有广阔的发展前景。目前,细胞色素P450等代谢酶的分子生物学研究已深入到基因表达的调控,使对酶的结构进行剪裁从而改变其活性进而改变药物的代谢过程,并应用于药物代谢研究领域成为可能。同时由于蛋白质组学及其他新技术的发展,CYP基因的调控机制及CYP结构和功能关系,脂溶性CYP晶体结构模拟将成为今后兽药代谢酶的研究热点。
[1] Lu C,Li AP.Species comparison in cytochrome P450 induction: effects of dexamethasone,omeprazole,and rifampine on P450 isoforms 1A and 3A in primary cultured hepatocytes form man,Sprague-Dawley rat,minipig,and Beagle dog[J].Chem-Biol Interact,2001,134(3):271-281.
[2] Myers MJ,Farrell DE,Howard KD,et al.Identification of multiple constitutive and inducible hepatic cytochrome P450 enzymes in market weight swine[J].Drug Metab Dispos,2001,29(6): 908-915.
[3] Eltom SE,Schwark WS.CYP1A and CYP2B1,two hydrocarbon-in
ducible cytochromes P450,are constitutively expressed in neonate and adult goat liver,lung and kidney[J].Pharmacol Toxicol, 1999,85(2):65-73.
[4] Zaphiropoulos PG,Skantz A,Eliasson M,et al.Cytochrome P450 gene expression in porcine ovaries:identification of novel forms for gene conversion,and evolutionary relationships[J].Biochem Biophys Res Comm,1995,212(2):433-441.
[5] Sivapathasundaram S,Magnisali P,Goldham NG,et al.A study of the expression of the xenobiotic-metabolising cytochrome P450 proteins and of testosterone metabolism in bovine liver[J].Biochem Pharmacol,2001,62(5):635-645.
[6] Ioannides C.Effect of diet and nutrition on the expression of cytochromes P450[J].Xenobiotica,1999,29(2):109-154.
[7] Kanetoshi A,Ward AM,May BK,et al.Immunochemical identity of the 2,3,7,8-tetrachlorodibenzo-p-dioxin and β-naphthoflavone-induced cytochrome P-450 arachidonic acid epoxygenases in chick embryo liver:distinction for the ω-hydroxylase and the phenobarbital-induced epoxygenase[J].Mol Pharmacol,1992,42 (6):1020-1026.
[8] Kupfer D,Mani C,Lee CA,et al.Induction of tamoxifen 4-hydroxylation by 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD),β-naphthoflavone(βNF),and-phenobarbital(PB)in avian liver:identification of P450TCDDAA as catalyst of 4-hydroxylation induced by TCDD and βNF[J].Cancer Res,1994,54(12):3140-3144.
[9] Gilday D,Cannpn M,Yutzey K,et al.Molecular cloning and expression of two novel avian cytochrome P450 1A enzymes induced by 2,3,7,8-tetrachlorodibenzo-p-dioxin[J].J Biol Chem,1996 271(51):33054-33059.
[10] Kim IC,Kim YJ,Yoon YD,et al.Cloning of cytorome P4501A (CYP1A)genes from the hermaphroditc fish Rivulus marmoratus and the Japanese medaka Oryzias latipes[J].Mar Environ Res 2004,58(2/5):125-129.
[11] Soucek P,Zuber R,Anzenbacherova E,et al.Minipig cytochrome P450 3A,2A and 2C enzymes have similar properties to human analogs[J].BMC Pharmacol,2001,12(1):11.
[12] Skaanild MT,Friis C.Porcine CYP2A polymorphisms and activity[J].Basic Clin Pharmacol Toxicol,2005,97(2):115-121.
[13] Baader M,Gnerre C,Stegeman JJ,et al.Transcriptional activation of cytochrome P450 CYP2C45 by drugs is mediated by chicken xenobiotic receptor(CXR)interacting with a phenobarbital response enhancer unit[J].J Biol Chem,2002,277(18):15647-15653.
[14] Handschin C,Meyer UA.A conserved nuclear receptor consensus sequence(DR-4)mediates transcriptional activation of the chicken CYP2H1 gene by phenbarbital in a hepatoma cell line[J].J Biol Chem,2000,275(18):13362-13369.
[15] Sakuma T,Shimojima T,Miwa K,et al.Cloning CYP2D21 and CYP3A22 cDNAs from liver of miniature pigs[J].Drug Metab Dispos,2004,32(4):376-378.
[16] Guengerich FP.Comparisions of catalytic selectivity of cytochrome P450 subfamily enzymes from different species[J].Chem-Biol Interact,1997,106(3):161-182.
[17] Baranova J,Anzenbacherova E,Anzenbacher P,et al.Minipig cytochrome P450 2E1:comparison with human enzyme[J].Drug Metab Dispos,2005,33(6):862-865.
[18] Gotoch O.Substrate recognition sites in cytochrome P450 family 2 (CYP2)proteins inferred from comparative analyses of amino acid and coding nucleotide sequences[J].J Biol Chem,1992,267(1) 83-90.
[19] Natsuhori M,van Raak M,Ligtenberg M,et al.Isolation of a bovine full length cytochrome P450(CYP3A)cDNA sequence and its functional expression in V79 cells[J].Environ Toxicol Pharmacol 1997,3(2):17-24.
[20] Van't Klooster GA,Blaauboer BJ,Noordhooek J,et al.Cytochrome P450 induction and metabolism of alkoxyresorufins,ethylmorphine and testosterone in cultured hepatocytes from goats,sheep and cattle[J].Biochem Pharmacol,1993,46(10):1781-1790.
[21] Pineau P,Galtier P,Bonfils C,et al.Purification of a sheep liver cytochrome P450 from the P450ⅢA gene subfamily.Its contribution to the N-dealkylation of veterinary drugs[J].Biochem Pharmacol,1990,39(5):901-909.
[22] Okita RT,Okita JR.Cytochrome P450 4A fatty acid omega hydroxylases[J].Curr Drug Metab,2001,2(3):265-281.
[23] Lundell K.Cloning and expression of two novel pig liver and kidney fattey acid hydroxylases[cytochrome P450(CYP)4A24 and CYP4A25][J].Biochem J,2002,363(Pt 2):297-303.
