新诊断 2型糖尿病患者周围神经病变临床分析
胡燕华 毛德祥
新诊断 2型糖尿病患者周围神经病变临床分析
胡燕华 毛德祥
糖尿病周围神经病变(DPN)是糖尿病最常见的并发症之一,是糖尿病足的主要危险因素。神经肌电图(NCV)检查是诊断 DPN的多种方法中最客观、敏感可靠的方法,常被作为“金标准”[1,2]。本研究的目的在于了解 2型糖尿病患者的DPN发生相关的因素,期望通过控制这些相关危险因素达到防止疾病发生发展目的。
1 资料与方法
1.1 资料和分组 选择 2008年 5月至 2009年 5月临床确诊为 2型糖尿病的患者 182例,男 106例,女 76例,年龄 25~75岁,平均(55±5)岁。分为 DPN组和非 DPN组。非 DPN组 137例,DPN组 45例。
1.2 研究方法和检测指标 记录入选患者性别、年龄、身高、体重、收缩压(SBP)、舒张压(DBP)、高血压病程,计算体重指数(BMI)。进行口服葡萄糖耐量试验(OGTT)、胰岛素释放试验。空腹血糖(FPG)和餐后 2h空腹血糖(2hPG)测定采用葡萄糖氧化酶法,胰岛素与尿白蛋白(UAlb)测定采用放射免疫分析法(北京北方生物技术研究所,批内差异 <6%、批间差异 <5%)。糖化血红蛋白(HbA1c)测定采用 BIO-RAD公司糖化血红蛋白仪。血清胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及血清尿酸(UA)测定仪器为日立 7100生化仪。
胰岛素抵抗指数(HOMA-IR)的计算:HOMA-IR=FPG×FIns/22.5。胰岛 β细胞功能指数(HOMA-β)的计算:HOMA-β=FIns×20/(FPG-3.5)。 HOMA-IR、HOMA-β为非正态分部,取其自然对数。对UAlb作对数转换。
神经功能运用采用日本光电 NeuropackFourMini型诱发电位/肌电图仪进行检测。神经传导速度测定均采用表面电极,检查时测定双上肢正中、尺神经、下肢腓总、腓肠、胫神经,刺激强度为按照能引出符合肌肉运动动作电位或者感觉神经动作电位最大波幅后重复 3次,直到波形波幅不再变化为止。分析神经的运动传导速度(MCV)、感觉传导速度(SCV)、以及运动和感觉的波幅(CAMP、SNAP)。神经损害的判断标准参考文献值[2]。
1.4 统计学方法 应用 SPSS11.0统计学软件,计量资料以±s表示,两组间均数比较采用 t检验。有统计学意义的危险因素再行多因素 Logistic回归分析。
2 结果
本研究共检出 DPN患者 45例,DPN患病率为 24.8%,DPN组的年龄、SBP和 HbA1c均显著高于非 DPN组(P值 <0.05),其余各项指标的差异均无统计学意义,见表 1。
将年龄、SBP和 HbA1c纳入多因素 Logistic回归分析,结果表明,HbA1c(OR=1.288,95%CI为 1.065~1.325,P=0.006)是 DPN的危险因素。
表 1 DPN组与非DPN组的临床资料比较(±s)
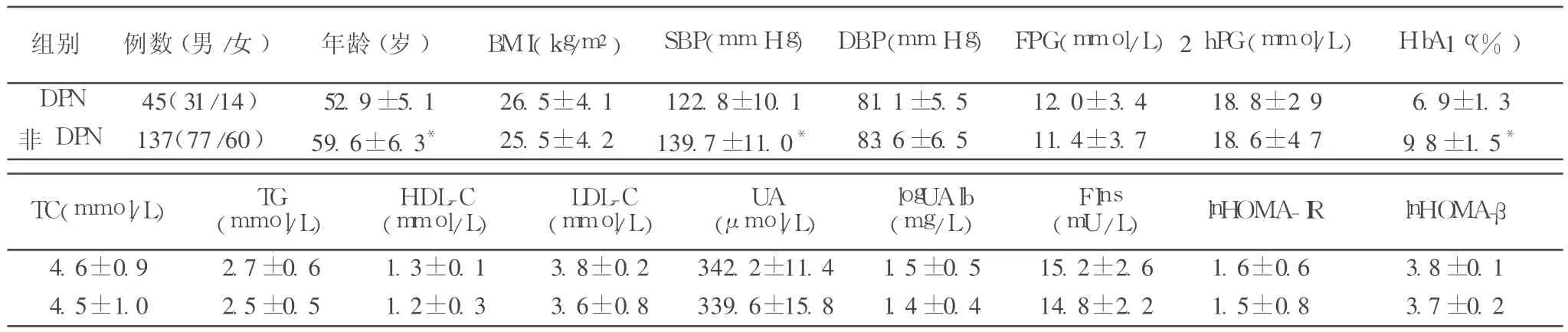
表 1 DPN组与非DPN组的临床资料比较(±s)
注:与 DPN比较,*P<0.05
组别 例数(男/女) 年龄(岁) BMI(kg/m2)SBP(mmHg)DBP(mmHg)FPG(mmol/L)2hPG(mmol/L)HbA1c(%)DPN 45(31/14) 52.9±5.1 26.5±4.1 122.8±10.1 81.1±5.5 12.0±3.4 18.8±2.9 6.9±1.3非 DPN 137(77/60) 59.6±6.3* 25.5±4.2 139.7±11.0* 83.6±6.5 11.4±3.7 18.6±4.7 9.8±1.5*TC(mmol/L) TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)UA(μmol/L)logUAlb(mg/L)FIns(mU/L) lnHOMA-IR lnHOMA-β 4.6±0.9 2.7±0.6 1.3±0.1 3.8±0.2 342.2±11.4 1.5±0.5 15.2±2.6 1.6±0.6 3.8±0.1 4.5±1.0 2.5±0.5 1.2±0.3 3.6±0.8 339.6±15.8 1.4±0.4 14.8±2.2 1.5±0.8 3.7±0.2
3 讨论
我国糖尿病的患病率逐年增加,DPN是糖尿病重要的微血管并发症之一,DPN有多种形式,最常见的是对称性复发性神经病,可累及感觉、运动及自主神经,以感觉神经受累为主,可导致患者发生严重的感觉缺失、疼痛、难治溃疡等,最终可能导致截肢。神经电生理检查有助于DPN的早期诊断,本研究中初诊糖尿病患者经神经电生理确认损害 24.8%,糖尿病患者在临床有神经损害症状以前就已经有明确的电生理损害依据。通过电生理检查手段,有利于糖尿病神经损伤早期发现,及时治疗[3,4]。
DPN是以高血糖为共同特征的一组神经损伤性疾病,其发病机制和临床表现不尽相同,较为公认的观点是血管病变、代谢因素及免疫因素参与DPN的发生[5]。多项研究表明,糖尿病患者的糖、脂肪、蛋白代谢紊乱通过不同的机制造成微血管功能障碍及其直接对神经细胞的毒性作用参与 DPN的形成,三者相互作用,相互影响。有文献报道[6],随着病程延长,糖尿病患者 NCV异常率逐渐增加,DPN发生率呈增高趋势。
糖基化就是葡萄糖通过非酶促反应结合到蛋白质的氨基上,一旦形成,不可逆转,它代表过去 6~10周的整体血糖水平,是评价血糖控制情况和预测并发症的指标。影响 HbA1c水平的因素有红细胞的寿命和血糖水平。HbA1c检测在过去 20余年中已成为测定长期血糖水平的金标准,基于目前认识到 HbA 1c水平升高可增加糖尿病微血管甚或大血管并发症的可能性,故临床医师采用HbA 1c测定结果来指导临床治疗,并且HbA1c检测已成为评价糖尿病管理的基石[7]。DCCT研究发现,糖尿病患者如果能将 HbA1c水平控制在合适的范围内,糖尿病并发症发生率将大大降低。
长期高血糖与 DPN的发病及其严重程度有关,高血糖可引起神经血管屏障的破坏,产生神经组织自身免疫性损伤。近来的研究显示[8],高糖条件下氧自由基生成增加,而超氧化物歧化酶生成减少,导致机体抗氧化作用减弱。过量生成的氧自由基可直接损伤神经组织的蛋白质、核酸和脂质,干扰线粒体呼吸链,造成神经结构和功能损害。因而纠正糖代谢异常对预防 DPN具有重要意义。HbA 1c是检测简便、重复性好的早期代谢紊乱标志,临床医师可用作评价血糖控制情况和预测并发症的指标,正如本研究证实,HbA1c是DPN的危险因素之一。
[1] Lu B,Yang Z,Wang M,et al.High prevalence of diabetic neuropathy in population-based patients diagnosed with type 2 diabetes in the Shanghaidowntown.Diabetes Res Clin Pract,2010Mar 30.
[2] 贾伟平,沈琴,包玉倩等.糖尿病周围神经病变的检测方法及其诊断价值的评估.中华医学杂志 2006,86(38):2707-2710.
[3] Sosenko JM.The prevalence ofdiabetic neuropathy according to ethnicity.Curr Diab Rep,2009,9(6):435-439.
[4] Obrosova IG.Diabetic painful and insensate neuropathy:pathogenesis and potential treatments.Neurotherapeutics,2009,6(4):638-647.
[5] Freeman R.Not all neuropathy in diabetes is of diabetic etiology:differential diagnosisofdiabetic neuropathy.Curr Diab Rep,2009,9(6):423-431.
[6] Kolla VK,Madhavi G,Pulla Reddy B,et al.Association of tumor necrosis factor alpha,interferon gamma and interleukin 10 gene polymorphismswith peripheral neuropathy in South Indian patientswith type 2 diabetes.Cytokine,2009,47(3):173-177.
[7] Norlinah MI,Hamizah R,Md Isa SH,et al.The effects of shortterm,rapid glycemic control on the peroneal nerve function and serum VCAM-1 and AGE in type 2 diabetic patients in Malaysia.Indian JMed Sci,2009,63(4):131-138.
[8] Sugimoto K,Yasujima M,Yagihashi S.Role of advanced glycation end products in diabetic neuropathy.Curr Pharm Des,2008,14(10):953-961.
223001淮安市清河区淮西社区卫生服务中心

