耐酸性脂肪酶产生菌的筛选及酶学性质研究
王 琰 张志敏 王 斌 万 一
耐酸性脂肪酶产生菌的筛选及酶学性质研究
王 琰 张志敏 王 斌 万 一
从西安市周边及秦巴山区采集的165份土样中,分离筛选到200余株脂肪酶产生菌(包括细菌、霉菌及酵母等);通过酸性三丁酸甘油酯平板法筛选到10株耐酸性的脂肪酶菌株,对其中一株酶活较高的真菌FL002进行酶学性质初步研究;经18S rDNA的克隆与序列分析,初步鉴定FL002为地霉属(Galactomyces geotrichum)。结果表明,目前已经初步建立了具有陕西特色的微生物脂肪酶菌种库,建立了酸性脂肪酶产生菌的筛选模型;从FL002菌中获得的脂肪酶具有耐高温和耐酸特性,该菌及该菌产生的脂肪酶有望应用于饲料行业。
白地霉;脂肪酶;耐高温;耐酸;饲料
脂肪酶(lipase E.C.3.1.1.3)是一种分解脂肪的酶类,在食品、化工、医药、皮革、生物能源等工业领域已获得广泛应用。近几年,脂肪酶在非水相酶学的研究中取得进展,使其成为应用最广泛的生物催化剂之一。脂肪酶广泛存在于动植物和微生物,其中微生物脂肪酶以其用途广、易于大规模生产及纯化等优点而成为工业脂肪酶的重要来源[1-4]。地霉属(Galactomyces geotrichum)微生物是脂肪酶的重要生产菌,目前,从地霉菌中分离到20多种脂肪酶,部分已形成商品化的酶制剂[5-6]。不同来源的脂肪酶在选择性上有所不同,其中地霉属脂肪酶大多具有良好的立体选择性、较高的转化率和稳定性等优点,因而在手性化合物、生物柴油、芳香酯的制备以及饲料用酶制剂的开发等方面受到广泛关注[7-8]。
近年来,酶制剂一直是国内外动物营养研究的热点之一。它们在饲料工业中的有效应用使得饲料工业和养殖业安全、高效、环保和可持续发展成为可能。研究发现,微生物脂肪酶可提高断奶仔猪的生产性能,减轻断奶仔禽、仔畜的营养应激[9]。在饲料中添加外源性脂肪酶能补充动物特殊生理阶段内源酶的不足,提高饲料脂肪的消化;同时,对动物体内内源消化酶的分泌有一定的促进作用,并有利于营养物质的消化分解和吸收利用[10]。另外,脂肪酶水解脂肪产生的脂肪酸还能抑制消化道内有害微生物的生长。因此,脂肪酶作为酶制剂在饲料行业中有着广泛的研究潜力和应用前景,但目前在国内外还处于起步阶段。
本研究是从西安市周边地区及秦巴山区采集的土样中,筛选微生物脂肪酶产生菌,建立具有陕西特色的脂肪酶菌种库,为脂肪酶的开发和应用奠定基础。针对脂肪酶在饲料行业应用中存在的问题,筛选具有温度耐受性的酸性脂肪酶产生菌,并对获得的脂肪酶的部分酶学性质进行研究,为该菌以及该菌产生的脂肪酶应用于饲料行业奠定基础。
1 材料
1.1 土样采集
从西安周边油脂厂、化工厂、花生地、油菜地及秦巴山区等地采集到富含油污的土壤样本165份,供分离使用。
1.2 菌株和质粒
由本实验室分离、保存的脂肪酶产生菌株共200余株;E.coli DH5α为本实验室保存;pGM-T质粒为克隆载体,购自TIANGEN公司。
1.3 培养基
细菌和真菌富集培养基、平板初筛培养基以及复筛培养基参考 Gao L 等(2004)[11]。
1.4 酶和试剂
Taq酶和DNA Marker购自Takara公司;胰蛋白胨、酵母粉、琼脂糖,购自Oxoid公司;三丁酸甘油酯购自上海晶纯实业有限公司;聚乙烯醇(PVA)[平均聚合度(1 750±50)]购自上海国药集团;橄榄油为慕氏初榨特级橄榄油,其他试剂均为国产分析纯;离心柱型普通琼脂糖凝胶DNA回收试剂盒、pGM-T连接试剂盒购自TIANGEN公司。
2 方法
2.1 脂肪酶产生菌株的筛选
初筛:采用透明圈平板法筛选脂肪酶产生菌株,操作步骤参考恽丽红等(2008)[12]。
复筛:将初筛纯化后的菌种接于发酵培养基中,30℃、200 r/min摇床培养48 h,检测酶活性。
2.2 脂肪酶活力测定
采用橄榄油乳化液水解滴定法,操作步骤参照国标 GB/T23536—2009。
2.3 酸性脂肪酶菌株的筛选
采用酸性三丁酸甘油酯平板鉴定法,即以三丁酸甘油酯乳化液(1%),LB培养基和琼脂(1.8%),用pH值5.0的乙酸-乙酸钠缓冲液制成平板,在平板中打孔(直径约3 mm),每孔加入20 μl脂肪酶菌株培养液,置于30℃恒温培养箱,定时观察并测量孔周围的透明圈大小。根据菌株是否生长以及菌株透明圈的大小对菌株进行性质分类,以获得耐酸性及在酸性条件下具有脂肪酶活性的菌株。
将在酸性三丁酸甘油酯平板上生长并且透明圈较大的菌株接种于发酵培养基中,30℃、200 r/min摇床培养48 h,离心收集发酵液上清,检测脂肪酶活性。
2.4 脂肪酶粗品的制备
将FL002菌株发酵培养48 h,12 000 r/min离心10 min,收集发酵液上清;往上清液中加入研磨成粉末的硫酸铵至20%饱和度,4℃放置过夜,于4℃下12 000 r/min离心20 min;弃沉淀,收集上清,向上清液中加入硫酸铵粉末至70%饱和度,收集沉淀;用去离子水溶解沉淀,透析处理后冷冻干燥,所得粉末即为脂肪酶粗酶粉。
2.5 脂肪酶酶学性质初步研究
2.5.1 脂肪酶最适反应温度及温度稳定性
称取0.50 g粗酶粉溶解于pH值7.5的磷酸缓冲液中,使溶液中酶活力在25 U/ml左右,制备成脂肪酶样品。脂肪酶的最适温度是在20~60℃范围内,每隔5℃检测脂肪酶的活力。
温度稳定性是将上述脂肪酶样品在25℃、30℃、35℃、40℃水浴中分别保温48 h,每隔6 h测定其相对酶活力。
2.5.2 脂肪酶最适pH值及pH值稳定性
最适pH值是将上述脂肪酶样品加入到一定pH值(4.0~8.5,以0.5为梯度)的缓冲液体系中,在最适作用温度下,测定不同pH值下的脂肪酶活力。
pH值稳定性是脂肪酶在不同pH值的缓冲液中,40℃保温1 h后,在最适作用温度下,测定脂肪酶的相对酶活力。
2.5.3 金属离子和表面活性剂对酶活力的影响
将上述脂肪酶样品分别加入终浓度为10 mM的KCl、MnCl2、FeSO4、CuCl2、CaCl2、ZnCl2、NiCl2、EDTA 和0.1%的 Tween-80、Gum Arabic、PVA、SDS、Triton 100溶液中,40℃下保温1 h后,测定脂肪酶活力,计算相对酶活。
2.6 菌株的鉴定
2.6.1 18S rDNA片段的PCR扩增
提取FL002菌株的基因组DNA[13]。采用真菌18S rDNA 通用引物(SP1:5-CAACCTGGTTGATCCTGC-3;SP4:5-CTTCCTCTAAATGATCAAG-3),以基因组 DNA为模板扩增18S rDNA。PCR条件为:95℃变性5 min;94 ℃、40 s,55 ℃、40 s,72 ℃、2 min,40 个循环;72 ℃延伸10 min,4℃保存。扩增产物通过1.0%琼脂糖凝胶电泳检测。
2.6.2 18S rDNA的克隆和序列分析
PCR产物经纯化试剂盒回收后,连接于pGM-T载体上,转化至感受态细胞E.coli DH5α中[14]。在NCBI中应用BLAST程序对序列同源性进行比对,得到与之同源性较高的序列,采用Clustal X 1.8进行多序列匹配排序,并通过Mega 4.0软件对菌株FL002及其近缘属种进行遗传距离分析。
3 结果
3.1 脂肪酶菌种库的初步建立及酸性脂肪酶菌株的筛选
将165份不同来源的土样进行平板初筛后,得到200余株脂肪酶产生菌,其中细菌约127株,霉菌87株,酵母15株。
通过酸性三丁酸甘油酯平板法对脂肪酶菌种库进行筛选,得到10株能够在pH值为5.0的酸性平板上生长并且有明显水解圈的菌株;将以上10株菌按2%的接种量接于发酵培养基中,30℃、150 r/min培养48 h后,测定发酵液上清的脂肪酶活性,其中FL002菌株的酶活最高,达到75.50 U/ml,作为进一步研究对象。
3.2 脂肪酶的酶学性质
3.2.1 酶作用的最适温度及热稳定性
在20~60℃,间隔为5℃的不同温度下进行酶活测定,结果表明,该酶在20~35℃酶活力随着温度的升高而增大,35℃时酶活力达到最高,40℃酶活力达到最高酶活的90%,超过40℃酶活力迅速下降(见图1)。

图1 酶的最适作用温度
将 FL002脂肪酶样品在 25、30、35、40 ℃水浴中分别保温48 h,每隔6 h按前述方法测定酶活力,以不经处理的酶活力为100%,其余所得酶活力折算成百分数,取6 h和48 h两时间点对保温时间作图(如图2)。从图2中可以看出,该酶在40℃保温6 h不失活,在40℃保温48 h仍保留80%左右的酶活力,表明该脂肪酶具有一定的热稳定性。

3.2.2 酶作用的最适pH值及pH值稳定性
配制8种从pH值 4~8.5,间隔为0.5~1个pH值单位的缓冲液,按照酶活力测定方法,测得相同酶液在不同pH值条件下的酶活力。如图3,此酶的最适作用pH值在6.5。取酶液与不同pH值(4~8.5)的缓冲液以l:5的比例混合,在40℃时保温1 h,再将酶液调回到最适pH值,测定酶活,以最适反应pH值下保温所得的酶活力为100%,其余折合成其剩余酶活力的百分数。结果表明,此酶在pH值6.0~8.5之间比较稳定,在pH值6.0时作用1 h后,仍能保持80%以上的酶活,故此酶有一定的酸度耐受性(如图4)。
3.2.3 金属离子和表面活性剂对脂肪酶的影响
FL002脂肪酶在10 mM的金属离子和0.1%的表面活性剂溶液中作用1 h后,脂肪酶活力变化结果见图5。其中发现,微量Cu2+和Ni2+对酶活力有明显抑制作用,Fe2+和Ca2+有一定的抑制作用,金属螯合剂EDTA对酶活也有抑制作用,其它金属离子对该酶活力影响不大,表明该酶可能是一个金属酶。表面活性剂中,0.1%的Triton 100对该酶的活力有明显增强作用(酶活提高到150.79%),而0.1%的SDS对酶活有强烈的抑制作用(酶活降低至3.17%),PVA和 Gum Arabic对酶活有一定的抑制作用。

图3 酶反应的最适pH值

图4 酶的pH值稳定性

图5 金属离子、表面活性剂及EDTA对脂肪酶活性的影响
3.3 FL002菌株的18SrDNA遗传系统进化树分析
将FL002菌株的18S rDNA序列应用BlAST程序进行同源性比对,发现其18S rDNA序列和多数Galactomyces geotrichum的同源性为99%;利用Clustal X 1.8和Mega 4.0软件对菌株FL002及其近缘属种进行遗传距离分析,构建系统进化树如图6。进化树上FL002和Galactomyces geotrichum属于同一簇,因此,可将FL002初步鉴定为Galactomycesgeotrichum。
4 讨论
本研究主要针对陕西地区及秦巴山区,筛选微生物脂肪酶产生菌,建立具有陕西特色的脂肪酶菌种库,该库中包括了细菌、真菌以及酵母等众多类型的菌株,为筛选具有不同特性的脂肪酶产生菌及其脂肪酶提供了一个良好的平台,对于脂肪酶多种用途的开发有很大的实用价值。本文采用酸性三丁酸甘油酯平板法,从目前建立的菌种库中成功地筛选出耐酸性的脂肪酶菌株。该方法的建立为进一步筛选具有其它性质的脂肪酶或脂肪酶产生菌提供借鉴。
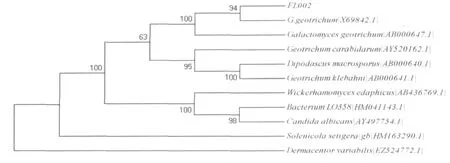
图6 菌株FL002依据18S rDNA建立的遗传进化树
脂肪的消化主要发生在十二指肠和小肠,在到达作用位点之前,添加到饲料中的酶制剂首先要经过胃的酸性环境[10]。因此,饲料用脂肪酶必须对胃肠道的酸性条件有一定耐受性,并且在内源酶作用位点的pH值范围内具有较高的活性。FL002脂肪酶在pH值6.5酶活力最高,在pH值6.0~8.5之间作用1 h仍具有80%以上的酶活力,因此,在消化道pH值范围内损失的酶活性较小,比较适合用于饲料的外源酶制剂。家禽体内温度约为40℃,在40℃时该脂肪酶具有90%的酶活力,在40℃作用6 h酶活力没有损失,作用48 h后仍能保持80%的脂肪酶活性,说明在畜禽体内就体温而言比较适合该脂肪酶发挥作用。动物体内含有多种必需矿物元素,它们在动物机体代谢中具有重要作用。本研究发现,10 mM的Fe2+和Ca2+对脂肪酶活性有一定程度的抑制作用,其中Cu2+和Ni2+对脂肪酶的抑制相对明显,这与其他属脂肪酶的酶学性质研究报道有所不同。如黑曲霉脂肪酶活性受多种金属离子的抑制,而对Ca2+有明显的依赖性[15],而在另外一些关于脂肪酶性质研究中也有类似于本文所得到的实验结果,表明了不同物种所产脂肪酶在性质上的不同特点[16]。0.1%的SDS对该脂肪酶活性有强烈的抑制作用,而0.1%的Triton-100对该脂肪酶活性有明显的激活作用,Tween 80对该脂肪酶活性基本没有影响,更低浓度金属离子及表面活性的增强或抑制作用有待进一步研究。
目前,脂肪酶在禽、猪、羊、牛饲料中的国内外研究表明,添加该酶释放出的脂肪酸,可提高油脂饲料原料的能量利用率,增加和改进饲料的风味和香味,改善家畜的食欲。脂肪酶还可清除植物性饲料原料中的脂质抗营养因子,弥补幼禽幼畜消化道内源脂肪酶的不足,缓解“仔猪早期断奶综合症”[17]。Dierick等[18]用4种中链脂肪酶组合进行的水解试验表明,释放的中链脂肪酸对消化道主要有害微生物的生长具有显著的抑制作用,起到类似抗生素的作用。据推测,脂肪和脂肪酶的合理组合可能起到降低仔猪饲料中抗生素使用量的作用,使饲料应用更为安全、高效。因此,耐酸性脂肪酶或脂肪酶产生菌作为饲料添加剂在动物养殖中具有很好的应用前景。本文研究的耐酸性脂肪酶经鉴定属于地霉,该菌株应用于饲料有自己的优势,即其菌体蛋白营养价值很高[3]。基于这种现状,对饲料用脂肪酶研究进行一些探索性的工作,从而推动其在饲料工业中的应用,也是一件非常有意义的工作。
[1] 施巧琴.碱性脂肪酶的研究I菌株的分离和筛选[J].微生物学通报,1981(8):108-110.
[2] 彭立凤,赵汝淇,谭天伟.微生物脂肪酶的应用[J].食品与发酵工业,2000,26(3):68-73.
[3] 马凯,刘光全,李金霞,等.基于26S rDNA D1/D2区序列分析的15株白地霉分子分类学研究微生物学报[J].微生物学报,2007,47(2):359-362.
[4] 温建新,施碧红,吴伟斌,等.脂肪酶产生菌Bacillus subtilis FS321的分离鉴定及其产酶条件的初步优化[J].食品与发酵工业,2008,34(2):37-41.
[5] 邱勇隽,许建和.固定化根霉脂肪酶的性质及在手性酯拆分中的应用[J].应用与环境生物学报,2001,7(5):469-473.
[6] 宋欣,曲音波,叶寒青,等.具脂肪酶和酯酶活性酵母菌的选育和酶学性质初步研究[J].应用与环境生物学报,1999,5(6):628-631.
[7] Saxena R K,Ghosh P K,Rani Gupta,et al.Microbial lipase:Potential biocatalysts for the future industry[J].Curr.Sci.,1999,77(1):101-115.
[8] Romero M D,Calvo L,Alba C,et al.Enzymatic synthesis of isoamyl acetate with immobilized Candida antarctica lipase in nhexane[J].Enzym&Microb.Techonl.,2005,37(1):42-48.
[9] 王海燕,李富伟,高秀华.脂肪酶的研究进展及其在饲料中的应用[J].饲料工业,2007,28(6):14-17.
[10] 时本利,王剑英,付文友,等.微生物脂肪酶对断奶仔猪生产性能的影响[J].饲料博览,2010(3):1-3.
[11] Gao L,Xu J H,Li X J,et al.Optimization of Serratia marcescens lipase production for enantioselective hydrolysis of 3-phenylglycidic acid ester[J].J.Ind.Microbiol.Biotechnol.,2004,3(1):525-530.
[12] 恽丽红,蔡宇杰,金永生,等.产低温脂肪酶非极端细菌的筛选、产酶发酵及粗酶性质研究[J].生物技术,2008,18(4):56-59.
[13] Cheng Hairong,Jiang Ning.Extremely rapid extraction of DNA from bacteria and yeasts[J].Biotechnology Letters,2006,28(1):55-59.
[14] Sambrook J,Russell D W.Molecular Cloneing:A Laboratory Manual 3rd ed[M].New York:Cold Spring Harbor Laboratory Press,2001.
[15] 舒正玉,杨江科,闰云君.黑曲霉F044脂肪酶的分离纯化及酶学性质研究[J].生物工程学报,2007,23(1):96-100.
[16] Sharma R,Soni S K,Vohra R M.Purification and characterization of a thermostable alkaline lipase from a new thermophilic Bacillus sp.RSJ-1[J].Process Biochem.,2002,37(10):1075-1084.
[17] 杨玉芝,孙秀玉,李燕舞,等.微生物脂肪酶与饲料营养[J].畜牧与兽医,2006,38(8):30-32.
[18] N A Dierick,J A Decuypere,K E Molly.The combined use of triacylglycerols containing medium-chain fatty acids(MCFAs)and exogenous lipolytic enzymes as an alternative for nutritional antibiotics in piglet nutrition[J].Livestok Production Science,2002,75(2):129-142.
Screening of a sour-resistant strain and properties of lipase
Wang Yan,Zhang Zhimin,Wang Bin,Wan Yi
More than 200 strains producing lipases were screened from a hundred and sixty-five oily soil in Xi'an suburbs and Qinba mountain area,Shaanxi Province,which included bacteria,moulds and yeasts;Ten sour-resistant strains were screened through glyceryl tributyrate plate,one of them that has a higher lipase activity was researched.It was identified as galactomyces geotrichum,by its morphological and 18S rDNA sequences.On the basis of above experiments,a Shaanxi characteristic library of strains producing lipases and the method for screening sour-resistant strains were established.The strain FL002 and its enzyme,which is both heat-resistant and sour-resistant,are expected to be used in the industry of forage.
galactomyces geotrichum;lipase;heat-resistant;sour-resistant;forage
Q556
A
1001-991X(2011)10-0029-05
王琰,陕西省微生物研究所,710043,陕西省西安市西影路76号。
张志敏、王斌、万一(通讯作者),单位及通讯地址同第一作者。
2011-02-14
陕西省科学院青年基金项目支持[2009k-27]
(编辑:高 雁,snowyan78@163.com)

