配合物[Ho2(bpdc)3·(H2O)4]·5H2O的合成及晶体结构研究
吕天一, 周长民, 王钰淇, 宋 潇, 熊 刚, 于 菀, 孙亚光
(1.沈阳化工大学应用化学学院,辽宁沈阳110142;
2.沈阳产品质量监督检验院,辽宁沈阳110032)
金属基配位化合物的设计与合成已成为当前化学研究中一个热门的研究领域[1-2].由于他们具有丰富多彩的拓扑结构,以及其常表现出奇特的光、电、磁、催化及吸附等方面的性质引起人们的广泛关注[3-6].芳香环或氮杂环二元羧酸是构筑无机-有机杂化晶体工程的良好配体,在适当的条件下,它们可与过渡金属离子或稀土金属离子形成如配位共价键[7]、π-π堆积[8]、氢键[9]的弱作用等,形成一维、二维和三维结构的新颖化合物[10-12].本文以六水合硝酸钬和2,2’-联吡啶-6,6’二羧酸与四氯合铂酸钾在水热条件下反应,得到了具有超分子网状结构的配合物[Ho2(bpdc)3·(H2O)4]·5H2O.
1 实验部分
1.1 试剂与仪器
六水合硝酸钬、2,2’-联吡啶-6,6’-二羧酸、四氯合铂酸钾均为分析纯试剂.元素分析使用Finnigan EA 1112元素分析仪;用Bruker Smart CCD X-射线单晶衍射仪进行晶体结构测定;结构分析经SHELX97软件包完成.配合物的晶体结构均采用直接法解析,并且用最小二乘法F2精修.
1.2 配合物的合成
称取0.1 mmol的四氯合铂酸钾、0.4 mmol的六水合硝酸钬和0.6 mmol的2,2’-联吡啶-6,6’-二羧酸加入盛有10 mL水的25 mL聚四氟乙烯内胆中,在空气中搅拌约10 min,将内胆放入到不锈钢反应釜中,在120℃干燥箱放置24 h,以5℃/h梯度降至室温,得到粉红色晶体.C36H36Ho2N6O21元素分析结果[实验分析结果(计算值)(质量分数/%)]:C,35.2(35.48);H,2.99(2.97);N,6.92 (6.89);O,27.10(27.09).红外光谱(KBr):3 414 (s),1 682(s),1 593(s),1 552(w),1 427(s),1 373(m),1 307(s),1 248(m),1 143(m), 1 127(w),1 108(w),1 024(m),939(m),865 (m),816(m),768(s),690(m)cm-1.
1.3 配合物的晶体测定
取0.3 mm×0.3 mm×0.3 mm的粉红色晶体于Bruker Smart CCD型 X-射线单晶衍射仪上,用石墨单色化的Mo Kα(λ=0.071 073 nm)辐射光源,在3.03°≤θ≤25.02°范围内,ω/2θ方式扫描,在温度为293(2)K下共收集到衍射点23 680个,其中独立衍射点14 219个,晶体结构用直接法解出,对全部的非氢原子的坐标及各面异性参数进行全矩阵最小二乘法修正.氢原子的位置由理论加氢得到,并使用固定的各向异性热参数加入结构精修.其晶体学数据为:三斜晶系,P-1空间群,晶胞参数a=1.341 6(3)nm,b= 1.605 9(3)nm,c=1.943 2(4)nm,α=100.82 (3)°,β=93.58(3)°,γ=92.07(3)°,Z=4,V= 4 099.2(14)×10-3nm3,μ=3.926 mm-1,F(000)=2 382,-13≤h≤15,-19≤k≤19,-21≤l≤23,R1=0.074,wR2=0.140 7[I>2σ (I)],R1=0.130 2,wR2=0.161 1(all data),差值电子密度最高峰和最低峰分别为1.292×103e/nm3和-1.692 3 e/nm3.
2 结果与讨论
在试验0设计之初预期得到钯与稀土的异核金属配位化合物,四氯合铂酸钾并未出现在配合物结构中.配合物主要键长见表1,键角见表2.配合物的晶体结构见图1.在整个结构中共包含4个钬离子的结构单元,其中 Ho(1)和Ho(2)配位方式相同,Ho(3)和Ho(4)配位方式相同,键长、键角略有不用(见表1、表2),这里只列出Ho(1)、Ho(3)的分子结构.由图1可以看出:在配合物中Ho(1)与2个2,2’-联吡啶-6,6’-二羧酸的4个氮原子和4个羧酸基团上的4个氧原子形成一个八配位四方反棱柱体,配位原子O(1)、O(3)、O(6)和O(7)与N(1)、N(2)、N(3)和N (4)分别形成2个近似四方形,构成了一个四方反棱柱体,来自2个不同配体的4个羧基上的氧原子与钬原子夹角 O(1)—Ho(1)—O(6) 89.9°,O(3)—Ho(1)—O(7)90.4°,说明2个配体之间几乎相互垂直.
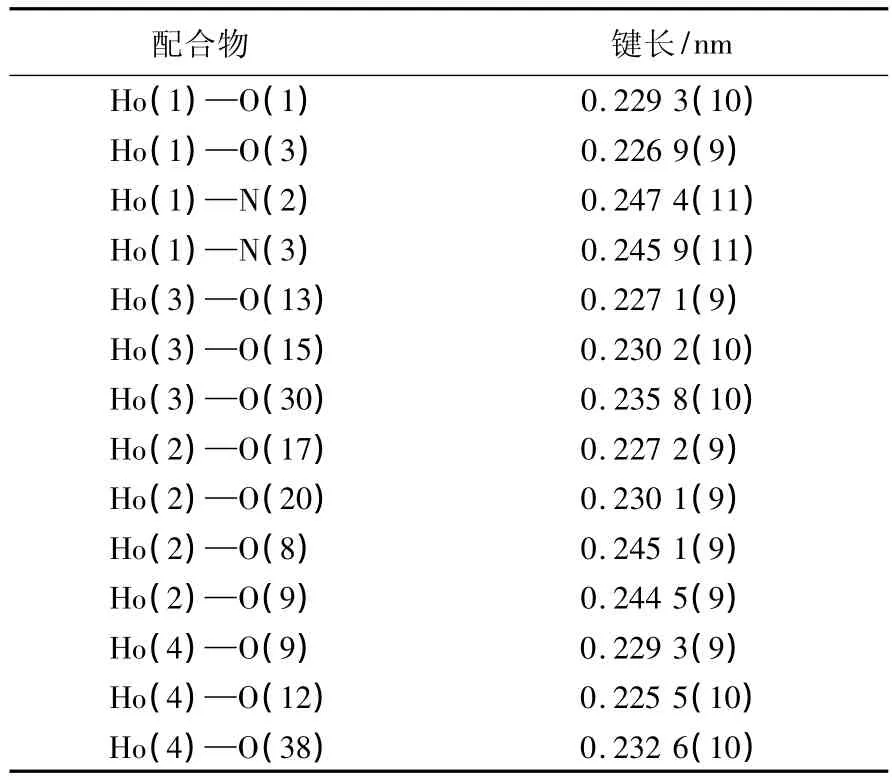
表1 配合物的重要键长Table 1 Selected bond lengths

表2 配合物重要键角Table 2 Selected bond angles


图1 配合物的分子结构Fig.1 The structure of the complex
Ho(3)与2,2’-联吡啶-6,6’二羧酸2个氮原子和2个二羧酸配体上的2个氧原子及4个配位水分子形成一个八配位四方反棱柱体,配位原子O(13)、O(15)、N(11)和N(12)与O(30)、O(35)、O(36)和O(37)分别形成2个近似四方形,构成一个四方反棱柱体,O(13)—Ho(3)—O(15)161.0°,O(13)—Ho(3)—N(11)67.2°,N(11)—Ho(3)—N(12)64.1°,N(12)—Ho(3)—O(15)66.8°,它们之和为359.1°,说明配体与钬离子配位时发生轻微扭曲.钬离子与配位水分子中氧原子键长Ho(3)—O(37)0.233 0 nm,Ho(3)—O(35)0.234 1 nm,Ho(3)—O(30) 0.235 8 nm,Ho(3)—O(36)0.236 5 nm.
配合物通过Ho(4)结构单元中羧基氧与游离水产生氢键作用(O(33)—O(11)=0.275 54 nm,O(33)—O(10)=0.276 77 nm)形成一维链状结构,它们进一步通过羧基的氧原子与结晶水产生氢键作用(O(29)—O(41)=0.275 10 nm,O(29)—O(4)=0.282 91 nm,O(2)—O(28)= 0.275 47 nm,O(28)—O(31)=0.273 27 nm,O(18)—O(38)=0.267 44 nm),连接Ho(1)、Ho(3)、Ho(2)结构单元,形成二维网状结构,如图2所示.配合物进一步通过羧基的氧原子与结晶水形成的氢键(见表3)与π-π堆积作用形成三维空间网状结构(见图3),面对面π-π堆积苯环质心距离分别为0.359 0 nm与0.362 7 nm.

表3 配合物的重要氢键Table 3 Selected hydrogen bond

图2 化合物通过氢键作用形成的二维结构Fig.2 Two-dimensional structure of the complex bonded by hydrogen bonds
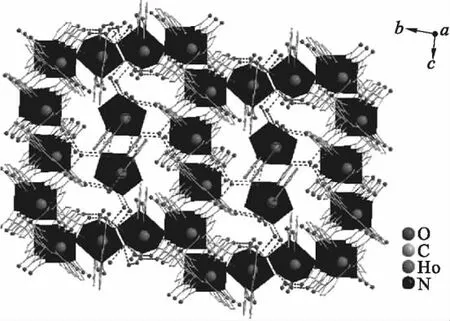
图3 配合物通过氢键与π-π堆积作用形成的三维网状结构Fig.3 3D network of the complex via hydrogen bonds and π-π stacking interactions
3 热质量分析
配合物的热质量分析曲线如图4所示,配合物的第一次质量损失出现在110~150℃,应失去结晶水及配位水,残余86.89%(理论残余值86.76%),在进一步加热的情况下,明显的质量损失出现在150~410℃,对应失去有机配体,410℃以后没有明显质量损失,最终残余物残留率30.73%,表明分解成Ho2O3(理论值30.82%).

图4 配合物的热质量曲线Fig.4 Thermal analysis curves of the complex
4 结论
实验合成了以弱相互作用方式连接的具有超分子结构特征的配合物[Ho2(bpdc)3· (H2O)4]·5H2O.X-射线单晶衍射分析表明:配合物之间依靠氢键弱相互作用与π-π堆积作用连接成三维网状超分子结构.
[1] Moulton B,Zaworotko M J.From Moleculesto Crystal Engineering:Supramolecular Isomerism and Polymorphismin Network Solids[J].Chem.Rev.,2001,101(6):1629-1658.
[2] Sun X M,Li Y D.Synthesis and Characterization of Ionexchangeable Titanate Nanotubes[J].Chem-Eur J.,2003,9:2229-2238.
[3] Chen W,Wang J Y,Chen C,et al.Photoluminescent Metal-organic Polymer Constructed from Trimetallic Clusters and Mixed Carboxylates[J].Inorg. chem.,2003,42(4):944-946.
[4] Kim Y,Suh M,Jung D Y.Crystal Structure and Spectorscopic Study of Novel Two-and Three-dimensional Photoluminescent Eu(Ⅲ)Adipate Compounds[J].Inorg.Chem.,2004,43(1):245-250.
[5] Li Xiao-Ju,Wang Xin-Yi,Song Gao,et al.Two Three-dimensional Metal-organic Frameworks Containing One-dimensional Hydroxyl Carboxylate Mixed Bridged Metal Chains:Syntheses,Crystal Structures,and Magnetic Properties[J].Inorg. Chem.,2006,45(4):1508-1516.
[6] Sudik A C,Cote A P,Anntek G,et al.A Metal-organic Framework with a Hierarchical System of Pores and Tetrahedral Building[J].Angew.Chem. Int.Ed.,2006,45(16):2528-2533.
[7] Ghosh A K,Ghoshal D,Lu T H,et al.Novel Solidstate Molecular Self-assemblies of Manganese(Ⅱ) Constructed with Flexible-ligands:Influences of π-π and C—H...π Interactions on their Crystal Packing[J].Crystal Growth&Design,2004,4(4):851-857.
[8] Moghimi A,Alizadeh R,Shokrollahi A,et al.First Anionic 1,10-Phenanthroline-2,9-dicarboxylate Containing Metal Complex Obtained from a Novel 1∶1 Proton-transfer Compound:Synthesis,Characterization,Crystal Structure,and Solution Studies[J].Inorg.Chem.,2003,42(5):1616-1624.
[9] Pantos G D,Pengo P,Sanders J K M.Hydrogenbonded Heliacl Organic Nanotubes.Angew[J]. Chem.Int.Ed.,2007,46(1/2),194-197.
[10]SUN Ya-guang,GU Xiao-fu,GAO En-jun,et al. Synthesis and Crystal Structure of a Two-dimensional Framework Supermolecular Complex[Mn (phen)(DPZDA)(H2O)]·2H2O[J].Chinese J. Struct.Chem.,2006,25(12):1431-1434.
[11] Sun Ya-guang,Gao En-jun,Wei De-zhou.Construction of Two-dimensional Supramolecular Structure Containing Water Tetramer and Octamer[J]. Inorg.Chem.Communications,2007,10(4):467 -470.
[12]GU Xiao-fu,SUN Ya-guang,GAO En-jun,et al. Synthesis and Crystal Structure of a 2D Coordination Polymer:[Nd2(PDB)2(CH3COO)2(H2O)3][J].Chinese J.Syruct.Chem.,2008,27(1):112-116.
- 沈阳化工大学学报的其它文章
- PbS-TiO2异质结/电纺纤维复合材料的制备与可见光催化降解甲基橙

