一种胸腺肽α1的原核表达方法
朱政斌
(湖南理工学院 化学化工学院, 湖南 岳阳 414006)
胸腺肽α1(Tα1)是动物胸腺素组分5(TF5)的主要活性组分, 是其中活性最强的组分之一[1]. 它是一种新型免疫调节因子, 通过诱导干细胞转化为成熟淋巴细胞, 刺激淋巴系统, 提高机体免疫功能. 临床上应用胸腺肽α1提高T细胞的免疫功能[2], 治疗病毒性肝炎和延缓某些老年病的发生与发展. 胸腺肽α1还有抗感染、抗病毒和抗肿瘤的功效, 尤其对癌症的免疫性治疗也具有一定的作用[3~8]. 组织提取胸腺肽α1受材料来源限制, 工作量大、成本高, 难以实现工业化生产. 目前国外已将其肽合成产品应用于临床, 对肿瘤、乙肝、丙肝及免疫缺陷等的治疗研究已取得了良好的效果. 但采用化学合成的方法成本较高, 并且存在消旋问题. 采用基因工程表达的方法是一种可行的思路, 目前国内外在表达方法的研究主要集中在融合表达[9]或者串联表达[10], 而且大多没有考虑胸腺肽α1的N端乙酰化的问题. 军事医学科学院方宏清[11]等通过构建胸腺肽α1-内含肽表达载体和Rim J表达载体, 将两载体共转BL21, 从而解决了N端乙酰化问题, 但该方法在生产过程中会产生C端部分修饰问题, 导致产率下降. 而Roman S[12]等则通过表达与化学方法酰化相结合实现了胸腺肽α1的生产.
弹性蛋白样多肽(ELP, elastin-like polypeptide)是一种对环境温度敏感的人造基因工程蛋白聚合物[13],其结构主要由五肽重复序列单元构成, 源自于弹性蛋白的疏水区域. ELP具有一个相变温度, 当环境温度低于相变温度时, ELP高度可溶, 而当环境温度高于相变温度时, ELP聚合沉淀. ELP的这一特性在生物医学材料, 抗肿瘤药物的靶向运输等方面体现了较好的优势. David W Wood[14,15]工作组运用ELP蛋白的特性以及内含肽的酶切活性, 建立了一种可用于蛋白生产的方法, 该方法可以获得不含任何序列标签的目标蛋白, 并且不需要色谱进行分离纯化, 大大降低了蛋白生产过程中的生产成本.
考虑到方宏清等的方法在生产过程中能够实现胸腺肽α1的N端乙酰化, David W Wood等的方法能实现蛋白质无色谱分离纯化, 本文在方宏清和David W Wood等工作的基础上, 通过构建Tα1-Gly-ELP蛋白表达载体和Rim J蛋白表达载体, 共转BL21菌株, 建立了一种无需色谱和亲和纯化的胸腺肽α1的生产方法,实现了胸腺肽α1的低成本生产.
1 材料与方法
1.1 材料
1.1.1 质粒、菌种与试剂
E.coli DH5α, BL21, Top10等菌种为本室自行保持, pACYCDuet1, pET41a(+)为本室自行保存, 限制性内切酶为NEB公司产品, 生化试剂为Sigma公司产品.
1.1.2 基因合成与引物设计
委托上海生工生物工程有限公司合成基因和引物序列如下:
Tα1-Gly序列:
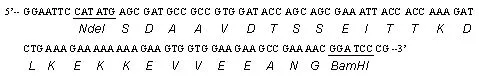
ELP序列:
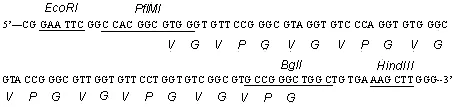
Rim J引物:
RimJ-F: GGAATTC CATATG TTT GGC TAT CGC AGT AAC
RimJ-R: CGG GGTACC TTA GCG GCC GGG CGT CCA
1.2 方法
1.2.1 载体构建
Tα1-Gly-(ELP)n-pET41 a(+)载体构建. 将合成的ELP人工基因进行退火, 载体和ELP人工基因进行EcoRI和HindIII双酶切, 构建ELP-pET41 a(+), 抽提质粒部分进行PflMI和BglI双酶切, 部分PflMI单酶切,双酶切收集的小片段插入单酶切线性化的质粒, 构建成(ELP)2-pET41 a(+), 如此重复构建(ELP)n-pET41 a(+); 将人工合成的Tα1-Gly序列进行退火, 并与构建的(ELP)n-pET41 a(+)进行NdeI和EcoRI双酶切, 连接反应构建Tα1-Gly-ELP[V5-10]-pET41 a(+), Tα1-Gly-ELP[V5-20]-pET41 a(+), Tα1-Gly-ELP[V5-30]-pET41 a(+), Tα1-Gly-ELP[V5-40]-pET41 a(+), Tα1-Gly-ELP[V5-50]-pET41 a(+), Tα1-Gly-ELP[V5-60]-pET41 a(+),Tα1-Gly-ELP[V5-70]-pET41 a(+)表达载体, 转入BL21菌株. RimJ-pACYCDuet载体构建见文[11], 将构建的RimJ-pACYCDuet转入BL21.
1.2.2 目的基因的表达
将菌种接种到普通LB培养基中, 30℃, 210rpm培养约10h, 收集菌体作为种子, 将种子接种至200mL自诱导表达培养基中, 37℃, 210rpm培养约12h后收集菌体, 将收集的菌体用缓冲液重悬, 冰浴条件下超声破菌, 低温离心收集上清, 将收集上清加热至50℃, 离心收集沉淀, 收集沉淀用预冷的缓冲液溶解后离心收集上清, 收集上清加热至50℃, 离心收集沉淀, 如此反复3~4次.
1.2.3 目标蛋白羟胺裂解
目标蛋白羟胺裂解方法根据文献[6]进行改进, 采用组氨酸缓冲液, pH9.0, 40℃裂解6h, 裂解完毕加热至50℃后离心收集上清, 将收集的上清进行色谱分析和质谱检测.
2 结果
2.1 载体的构建
将人工合成的ELP基因退火并进行EcoRI和HindIII双酶切, 回收片段, 将pET41 a(+)进行EcoRI和HindIII双酶切, 回收线性化载体片段, 进行连接构建ELP-pET41 a(+), 将ELP-pET41 a(+)载体进行PflMI和BglI双酶切, 回收小片段, 将ELP-pET41 a(+)载体进行PflMI单酶切并脱磷, 回收线性化载体, 进行连接,构建(ELP)2-pET41 a(+), 如图1所示构建(ELP)n-pET41 a(+), 将构建的一系列载体进行PCR检测, 用1.5%的琼脂糖胶进行检测, 结果如图2所示(其中lane1: ELP[V5-10]; lane2: ELP[V5-20]; lane3: ELP[V5-30];lane4: ELP[V5-40]; lane5: ELP[V5-50]; lane6: ELP[V5-60]; lane7: ELP[V5-70]). 将上述构建的一系列载体进行NdeI和EcoRI双酶切, 切除载体的融合标签, 将人工合成的Tα1基因进行退火并进行NdeI和EcoRI双酶切, 回收酶切片段并与线性化载体进行连接构建Tα1-Gly-(ELP)n-pET41 a(+). 抽提大肠杆菌DNA, PCR扩增RimJ基因, PCR产物进行NdeI和KpnI双酶切, 同时将pACYCDuet载体进行NdeI和KpnI双酶切, 回收线性化载体与RimJ基因进行连接构建RimJ-pACYCDuet载体并测序证实载体构建正确, 将RimJ-pACYCDuet载体和Tα1-Gly-(ELP)n-pET41 a(+)载体共转BL21, 筛选阳性克隆.
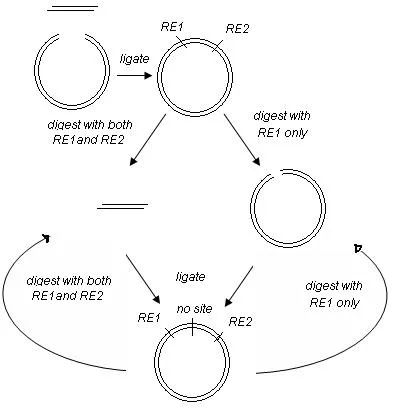
图1 载体构建示意图

图2 构建载体PCR检测

图3 蛋白的诱导表达与纯化
2.2 重组融合蛋白表达
在相同条件下表达Tα1-Gly-ELP[V5-10], Tα1-Gly-ELP[V5-20], Tα1-Gly-ELP[V5-30], Tα1-Gly-ELP[V5-40], Tα1-Gly-ELP[V5-50], Tα1-Gly-ELP[V5-60], Tα1-Gly-ELP[V5-70], 对这一系列表达载体表达蛋白进行纯化, 收集融合蛋白, 测定蛋白量, 结果如图3B所示. (图3A为蛋白诱导表达结果: lane1: Tα1-Gly-ELP[V5-40]诱导表达; lane2: Gly-ELP[V5-40]非诱导表达. 图3B为蛋白诱导表达纯化结果: lane1:Tα1-Gly-ELP[V5-10]; lane2: Tα1-Gly-ELP[V5-20]; lane3: Tα1-Gly-ELP[V5-30]; lane4: Tα1-Gly-ELP[V5-40];lane5 Tα1-Gly-ELP[V5-50]; lane6 Tα1-Gly-ELP[V5-60]; lane7: Tα1-Gly-ELP[V5-70]). 通过计算Tα1的含量,表明Tα1-Gly-ELP[V5-40]表达获得的Tα1含量最高. Tα1-Gly-ELP[V5-40]表达可以获得240mg/L的融合蛋白表达量.
2.3 目的蛋白羟胺裂解
文[16]显示羟胺裂解可能导致谷氨酰胺和天冬酰胺的酰胺被修饰, 采用组氨酸缓冲液可以有效抑制酰胺修饰. 本试验通过采用组氨酸缓冲液进行羟胺裂解, 裂解完成后升温至50℃, 离心收集上清, 上清液进行反相高效液相色谱分析与质谱检测, 结果如图4、5所示. 从图4可知, 上清液基本只含目的肽, 从图5可知, 目的肽为分子量3108的多肽, 与预期一致. 1L发酵液经过细菌破碎, 变温沉淀, 羟胺裂解, 变温沉淀, 上清液脱盐等步骤获得目标多肽29.5mg. 采用羧肽酶Y结合MALDI-TOF MS技术测定纯化多肽的羧基端氨基酸序列, 测定了12个氨基酸残基, 氨基酸序列为-K-E-K-K-E-V-V-E-E-A-E-N, 结果如图6所示,与预期结果一致.

图4 裂解上清的RP-HPLC图

图5 胸腺肽α1的质谱分析
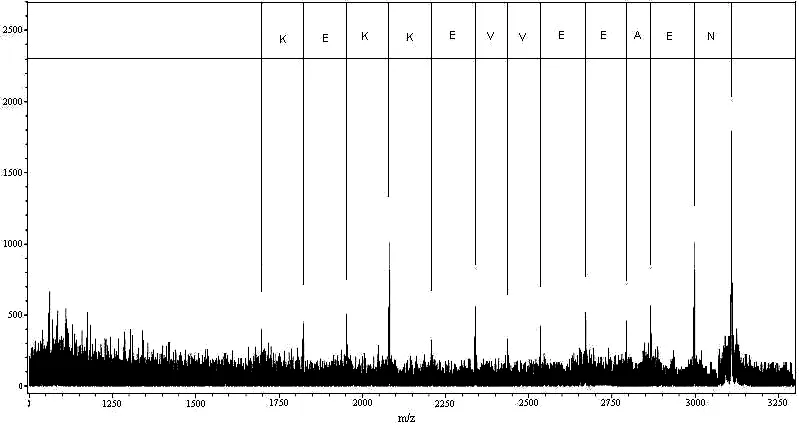
图6 羧肽酶Y结合质谱对胸腺肽α1的C端测序图
3 讨论
Tα1作为一种免疫增强剂, 在临床上应用广泛. 目前市场上提供的Tα1产品无论是进口产品还是国产产品均是通过化学合成, 价格昂贵. 国内外对用基因工程方法生产Tα1进行了大量的研究. Tα1是小肽, 采用基因工程方法生产小肽主要采用串联表达方法或者融合表达方法, 采用串联表达方法主要问题是表达获得串联蛋白后的处理较困难, 而采用融合蛋白表达方法的主要问题是目标蛋白在融合蛋白中的含量较低. 由于第一种方法不能生产N端乙酰化肽, 所以只能采用第二种方法.
在构建表达载体时, 我们选择了人工合成基因, 选择大肠杆菌偏爱的密码子, 以提高表达效率. 由于要进行N端乙酰化修饰, 所以将Tα1构建在N端. ELP融合蛋白主要是利用了ELP在较低温度时为可溶状态,在较高温度时形成纳米的特点, 这样可以很简便地把融合蛋白从蛋白混合物中分离纯化出来而不需要使用亲和纯化. 从图4反相HPLC分析图谱结果可知, 变温沉淀上清液中基本只含目标产物, 说明基本不需要使用色谱系统进行纯化, 是一种低成本的生产蛋白的方法. 运用基因工程表达蛋白, 其主要生产成本在蛋白纯化, 所以选择ELP融合蛋白生产Tα1是一种可行的策略.
采用羟胺裂解则由于羟胺本身毒性比较低, 裂解效率较高, 通过控制反应条件可以完全克服副反应,而且裂解时间较酶解时间大大缩短, 并且成本远比酶成本低. 本方法也没有采用文[15]方法, 该文采用内肽酶的方法, 但本实验生产的是小肽, 如果增加一个内肽酶, 则小肽在融合蛋白质中所占的比重更小, 不利于提高产量, 而且C端会出现部分修饰现象. 通过实验, 我们发现采用本方法生产Tα1, 1L培养基可以生产纯度为98%的目标多肽29.5mg.
采用ELP融合蛋白方法生产Tα1, 表达量较高, 并且下游纯化简便易行, 为基因工程方法大规模生产Tα1打下了基础.
[1]Low TL, Goldstein A. The chemistry and biology of thymosin II: Amino acid sequence of thymosin alpha 1 and polypeptide beta[J]. J Biol Chem, 1979,254(3): 987~995
[2]Hadden J W. Aspects of the immunopharmacology of thymosin αl [J]. Clinical and Applied Immunology Reviews, 2001, 1: 187~191
[3]Amarapurkar D, Das H S. Thymosin alpha in the treatment of chronic hepatitis B: an uncontrolled open-label trial [J]. Indian J Gastroenterol, 2002, 21(2):59~61
[4]Lau G K, Nanji A, Hou J, et al. Thymosin-alpha1 and famciclovir combination therapy activates T-cell response in patients with chronic hepatitis B virus infection in immune-tolerant phase [J]. Viral Hepat, 2002, 9(4): 280~287
[5]Anfreone P, Cursaro C, Gramenzi A, et al. In vitro effect of thymosin alpha1 and interferon alpha on Th1 and Th2 cytokine synthesis in patients with chronic hepatitis C [J]. J Viral Hepat, 2001, 8:194~201
[6]Moscarella S, Buzzelli G, Romanelli RG, et al. Interferon and thymosin combination therapy in navie patients with chronic hepatitis C: preliminary results[J]. Liver, 1998, 18:366~369
[7]Rasi G, Terzoli E, Izzo F, et al. Combined trement with thymosinα1 and low-dose interferon-alpha after dacarbazine in advanced melanoma[J]. Melanoma Res, 2000, 10 (1):1~4
[8]Enrico G, Francesca P, Paola S V, et a1. Thymosin RI in combination with cytokines and chemotherapy for the treatment of cancer [J]. International Immunopharmacology, 2003, 3(8): 1145~1150
[9]Sun Z Y, Zhu ZH H, Chen J Y, et a1. Express, purification and Characterization of Recombinant Human Thymosin α1[J]. Journal of Nanjing University(Natural Sciences), 2004, 40 (1): 49~57
[10]JIN Ming-fei, XU Wei-don, HUANG Jin, et a1. High Level Prokaryotic Expression of Thymosin od by Gene Repeats [J]. China Biotechnology, 2007, 27(1): 11~15
[11]Hongqing Fang , Xu Zhang, Lin Shen. RimJ is responsible for Nα-acetylation of thymosin α1 in Escherichia coli [J]. Appl Microbiol Biotechnol (2009)84: 99~104
[12]Roman S. Esipov1, Vasily N. Stepanenko, Ksenia A. Beyrakhova, et a1. Production of thymosin α1 via non-enzymatic acetylation of the recombinant precursor [J]. Biotechnol. Appl. Biochem. (2010)56:17~25
[13]Ashutosh Chilkoti, Matthew R. Dreher, Dan E. Meyer. Design of thermally responsive, recombinant polypeptide carriers for targeted drug delivery [J].Advanced Drug Delivery Reviews 54 (2002): 1093~1111
[14]Mahmoud Reza Banki, Liang Feng, David W Wood. Simple bioseparations using self-cleaving elastin-like polypeptide tags[J]. Nature Methods. (2005)9:659~661
[15]Wan-Yi Wu, Courtney Mee, Filomena Califano. Recombinant protein purification by self-cleaving aggregation tag[J]. Nature Protocols. (2009)1:2257~2262
[16]ZHANG Ying, LIU Yu-le , TIAN Bo. The Change of Fusion hIL -11 Cutting Site and Purification of rh IL -11 [J]. Chin. J. Biochem. Mol. Biol. 2000, l(16): 6~9

