乙型肝炎病毒e抗原的生物学功能及血清学转换的免疫学基础
闻玉梅
复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032
乙型肝炎病毒(hepatitis B virus,HBV)基因组的读码框架共编码4类抗原蛋白,即包膜抗原〔HBV表面抗原(hepatitis B virus surface antigen,HBsAg)包括S区编码的小s抗原、PreS2/S编码的中s抗原、PreS1/PreS2/S区编码的大s抗原〕、核心抗原(hepatitis B virus core antigen, HBcAg)、x抗原(hepatitis B virus x antigen,HBxAg)及可分泌的e抗原(hepatitis B virus e antigen,HBeAg)。HBeAg是PreC/C基因编码,经修饰后可在细胞内存在并分泌至细胞外,可从感染者血清中测及的一种HBV抗原标志。HBeAg早在1972年由Magnius与Espmark发现并报道[1]。他们应用琼脂双扩散方法检测不同HBsAg(当时为Australian Antigen)阳性者血清时,发现除a、d、r等血清型外,额外出现一条沉淀带,命名为e抗原。随后Hoofnagle等[2,3]发现HBeAg与肝炎相关,而HBeAg消失后出现抗HBe则与肝功能恢复相关,从而奠定了检测HBeAg及抗HBe的临床意义。
1 HBeAg的分子生物学研究
随着对HBV基因组研究的深入,以及用细胞转染技术分析HBeAg的分子结构与功能,发现HBV PreC基因编码肽段将C基因编码多肽转至细胞内膜结构,经修饰后导致HBeAg分泌[4]。HBV PreC mRNA编码的PreC/C蛋白约212个氨基酸(相对分子质量为25×103,称P25)。这一蛋白经过2次修饰,首先氨基端19个氨基酸作为信号肽将PreC/C蛋白转位至内质网,随即该肽被信号肽酶切除,成为P22,即在PreC端仍保留10个氨基酸;然后羧基端约30个氨基酸可能在高尔基复合体中被去除,从而获得一个成熟的HBeAg,其相对分子质量为16×103~17×103(P16~17),由149或154个氨基酸组成[5]。虽然HBeAg大部分氨基酸与HBcAg氨基酸序列相同,但两种蛋白的折叠形式不同,因此生物学特性也不同。HBeAg是可分泌的可溶性蛋白,而HBcAg可聚合成核心颗粒,从而适合于将前基因组包装在其中,并开始基因组的复制。核心颗粒聚合依赖的是2个C蛋白各自61位半胱氨酸形成的二硫键。C蛋白以羧基端富有碱性精氨酸的部分与带负电荷的前基因组RNA相互作用而包裹病毒核酸。由于HBeAg PreC残留末端的-7位半胱氨酸(以羧基端的第1位氨基酸计算)能与自身61位半胱氨酸(Cys-7-Cys61)形成二硫键,因此无法如C蛋白那样形成二聚体并最终组成核心颗粒;加上HBeAg羧基端缺少富含精氨酸的部分,不能形成二聚体,也不能与核酸结合,因此HBeAg的功能与HBcAg完全不同。虽然HBcAg与HBeAg在高级结构(蛋白构型)有很多不同,但HBcAg第80位氨基酸左右的构型与HBeAg第80位氨基酸左右的构型还是相同的。因此,用变性的HBcAg免疫获得的多克隆抗体只能用于蛋白免疫印迹法识别HBeAg(因2种蛋白的相对分子质量不同),而不能用于其他血清学反应。如果用于临床检测,还需用不同的抗体检测不同的抗原。
2 HBeAg的生物学及医学意义
2.1 HBeAg的功能
最早临床医学家发现HBeAg与肝炎进展相关,而抗HBe出现往往是病情好转的迹象。随后发现这一现象主要在北欧及北美患者中存在,而在地中海、非洲和东亚地区有少部分患者虽然HBeAg阴性、抗HBe阳性,但持续低度的血清HBV DNA阳性(103~105copies/ml),肝脏炎症反应依然持续[6]。有学者认为这些炎症反应表现为肝内点状坏死病变,可能是因自身免疫所致[7]。另有学者认为,HBeAg阴性/抗HBe阳性患者血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)正常>12个月为非活动性携带组,而ALT>1.5倍正常上限应与HBeAg阳性一样列为活动性肝病组。经过长期随访发现,在亚洲血清HBV DNA<300 copies/ml患者发生肝癌的概率仅为HBV DNA>105copies/ml患者的1/10(前者为1.30%,后者为14.89%)。因此,如血清HBV DNA>103copies/ml或104copies/ml,即使HBeAg阴性/抗HBe阳性也应进一步治疗,以防止肝癌的发生[9]。
1989年,Carman等首次报道慢性乙型肝炎患者血清中存在PreC区1 896位核苷酸由G向A的点突变,导致该区出现终止密码子,致不表达HBeAg[10]。当时认为这一突变仅限于重症肝炎患者,但以后发现这一突变在不同病情、不同种族患者中均存在[11]。此外,在基础核心启动子区(basal core promoter,BCP)发现,各种突变可致HBeAg表达下降,其中T1762A和G1764A双突变最为常见。这些突变株可表现为HBeAg阴性或低度HBeAg阳性。屠红于1997年通过斑点杂交法快速检测我国446份乙型肝炎患者血清,研究抗HBe阳性患者中出现PreC终止密码子的突变情况。发现上海47.4%、成都75.0%、武汉78.9%,而海口仅17.6%。标本中相当一部分患者中突变株与野生株共存[12]。上述结果说明,早在20世纪我国抗HBe阳性乙型肝炎患者中已含有一定比例的HBeAg阴性毒株。这些毒株可能在抗HBe的免疫压力下,又未能及时被抗病毒药物抑制,逐渐增多,在准种中占上风,而可能成为主流毒株。
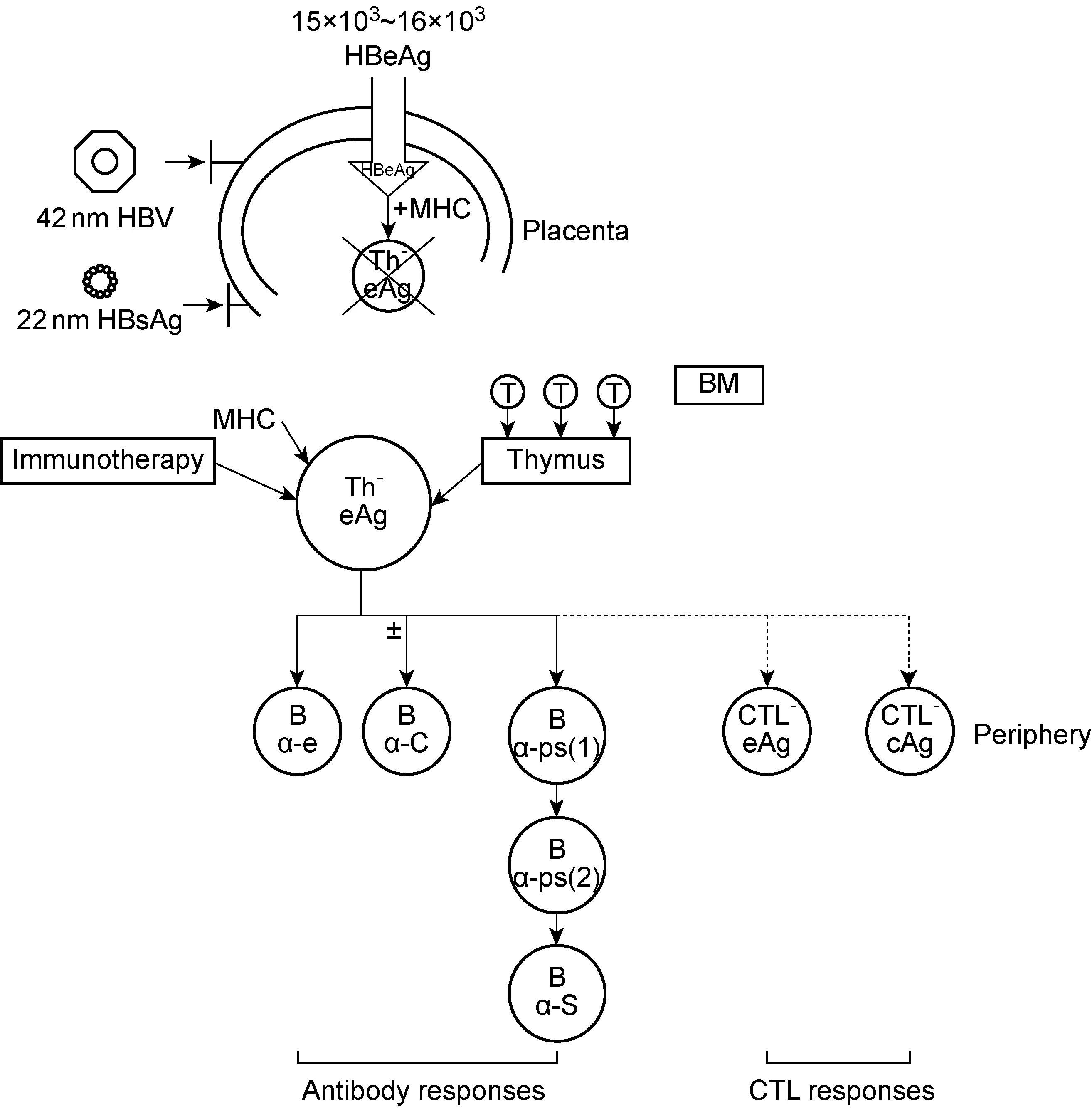
图1 HBeAg造成免疫耐受及引起免疫应答的机制示意图Fig.1 Schematic plot of mechanism of immune tolerance and immune response caused by HBeAg
2.2 HBeAg在母婴传播中受到广泛重视
如图1所示,一般认为HBeAg或其衍生肽可能通过胎盘而抑制甚至清除胎儿体内HBeAg特异的T辅助细胞(T helper cell,Th细胞)。但是到一定年龄或在一定条件下,通过骨髓及胸腺的补充,或通过免疫调控治疗,HBeAg特异的Th细胞有可能恢复功能。这就是某些患者可自发出现HBeAg血清学转换,或经过治疗获得HBeAg血清学转换的机制。HBsAg和HBeAg双阳性母亲娩出的婴儿如不以疫苗免疫阻断,婴儿HBV感染概率曾被高估为90%[8]。目前主张对HBsAg和HBeAg双阳性母亲娩出的婴儿,应采用HBV疫苗加乙型肝炎免疫球蛋白进行主动与被动免疫,有效降低婴儿HBV感染率。现已明确,HBsAg和HBeAg双阳性母亲娩出的婴儿易感染HBV与这类孕妇血清中HBV滴度高有关。有研究显示,在产前3个月用核苷类药物抑制孕妇血清中HBV DNA可有效降低婴儿HBV感染率。但孕妇分娩后是否应继续抗病毒治疗、是否适宜哺乳等,仍需进一步研究。
2.3 HBeAg调控免疫的功能
HBeAg和HBcAg Th细胞表位的识别是相互交叉的,而HBeAg因其相对分子质量小,能以完整HBeAg形式或衍生肽经胎盘进入胎内。又由于HBeAg阳性孕妇娩出的婴儿HBV感染率高,因此学者们重点研究了HBeAg是否为一种导致免疫耐受的耐受原。Milich等用HBeAg阳性转基因鼠研究HBeAg的免疫调节作用,发现血清中的HBeAg可选择性致HBeAg和HBcAg特异性Th1细胞缺失或低下,有利于HBV的持续存在[13]。其后,Chen等进一步报道,在TCRXHBc/HBeAg双重及多重转基因鼠中,血清表达HBeAg阻止HBcAg的血清学转换,即不出现抗HBc。结果显示,HBeAg可能作为T细胞的耐受原而调控胞内HBcAg的免疫应答[14]。
近年来,学者们研究了HBeAg调控天然免疫的作用,发现HBeAg阳性乙型肝炎患者的外周血白细胞和肝脏细胞的Toll样受体2(Toll-like receptor 2,TLR-2)表达下降,并对多种TLR配体的应答下降。将正常人外周血细胞与HBeAg共孵育后再用TLR-2和TLR-4配体刺激,产生的肿瘤坏死因子α(tumor necrosis factor α,TNF-α)明显降低,提示可抑制重要的炎症应答因子[15]。最近Lang等报道,HBeAg可影响Toll样/白细胞介素1受体(Toll/interleukin 1 receptor,TIR)与TLR的相互作用,从而可特异抑制TIR介导的一些促炎症反应转录因子,如核因子κB(nuclear factor κB,NF-κB)与β干扰素(interferon β,IFN-β)的启动子[16]。这些研究揭示了HBeAg可调控天然免疫,从而与发病及病毒持续相关。
3 HBeAg血清学转换的免疫学基础
在临床治疗乙型肝炎中,HBeAg的血清学转换(血清中HBeAg消失,出现抗HBe)已作为一项重要指标。究其原因,是HBeAg血清学转换反映机体免疫功能的改善,而血清HBV DNA水平仅代表病毒被抑制、复制水平下降。
3.1 HBcAg与HBeAg诱生的Th细胞类型
为研究HBcAg和HBeAg在诱生体液免疫及细胞免疫方面有无不同,Milich曾用2种不同免疫原分别免疫小鼠。结果发现,HBcAg免疫并不需要佐剂,可诱导IgG2a和 IgG2b亚类抗HBc,无IgG1或IgG3抗体。相反,HBeAg需加佐剂免疫,并诱生IgG1亚类抗体及低效价IgG2a/IgG2b抗体。在细胞因子方面,HBcAg的Th细胞主要产生IL-2和IFN-γ,而HBe免疫后主要诱生IL-4。结果证明,2种抗原虽然在Th细胞识别的氨基酸一级结构上有大部分相同并有交叉,但分别诱生的Th细胞则根据2种抗原性的不同而诱生不同类型的应答[17]。研究者在急、慢性乙型肝炎患者中还发现,HBcAg和HBeAg共有的CD4+T细胞表位主要在1~25和61~85位氨基酸,其他如21~45、41~65、81~105位氨基酸也具有免疫表位作用,并认为HBcAg和HBeAg特异的CD4+T细胞与清除病毒相关[18]。
3.2 HBcAg与HBeAg的免疫原性比较
为研究HBcAg和HBeAg的特异免疫原性,Milich分别研究了2种重组抗原在pH 7.2与pH 9.6条件下的不同稳定性。HBcAg在2种pH值时均稳定。在pH 9.6时,HBeAg只表现HBeAg的特异抗原性;在pH 7.2时,则同时表达HBcAg和HBeAg的抗原性。由此可利用不同pH条件下的HBeAg来分别研究两者的免疫原性。用pH 7.2的HBeAg(HBeAg 7.2)或pH 9.6的HBeAg(HBeAg 9.6)分别免疫小鼠,发现HBcAg的免疫原性显著高于HBeAg 7.2或HBeAg 9.6。在去胸腺小鼠中发现,HBcAg可在无Th细胞条件下直接激活B细胞产生抗体,而HBeAg(pH 9.6)在裸鼠中不能诱生抗HBe,反映HBeAg必须依赖Th细胞才能产生抗体,因此HBcAg是T细胞依赖性及非T细胞依赖性抗原,而HBeAg是T细胞依赖性抗原(表1、2)。此外,用这2种抗原免疫获得的单克隆抗体相互无交叉抑制应答,显示 HBcAg与HBeAg诱生抗体的表位不同。
表1HBcAg与HBeAg的免疫原性比较
Tab.1ComparisonofimmunogenicitybetweenHBcAgandHBeAg

FeatureHBcAgHBeAgLocalizationCytosolicSecreted/cytosolicCytotoxic T lymphocyte target+Cross-reactive with HBeAg+ CytosolicAntibody responseHigh (non-cross-reactive with HBeAg)(TI/TD)Comparatively low (TD)T proliferationHigh (cross-reactive with HBeAg)LowTh subsetTh1-likeTh2/Th1-likeImmunoregulation-+ Neonatal tolerance-+ Cross regulates HBcAgAntigen presentation via Ag-MHC class II pathway-+
表2裸鼠的实验结果
Tab.2Studiesinnudemice[19]
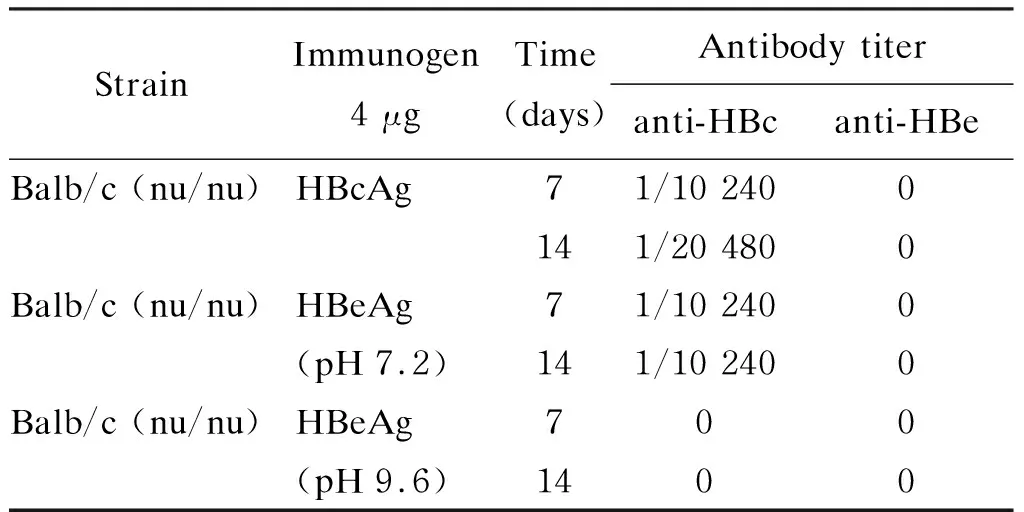
StrainImmunogen4 μgTime(days)Antibody titeranti-HBcanti-HBeBalb/c (nu/nu)HBcAg71/10 2400141/20 4800Balb/c (nu/nu)HBeAg 71/10 2400(pH 7.2)141/10 2400Balb/c (nu/nu)HBeAg 700(pH 9.6)1400
Anti-HBc and anti-HBe were determined by solid phase enzyme-linked immunosorbent assay (ELISA).
3.3 HBeAg血清学转换的意义
迄今为止,人们认为慢性乙型肝炎患者恢复的最关键环节是提高特异性细胞免疫(CD4+与CD8+细胞)及天然免疫(自然杀伤细胞、巨噬细胞、细胞因子等)。HBV表达的HBsAg和HBeAg都是T细胞依赖性抗原,而HBcAg因可组成颗粒性结构,是T细胞依赖性及非T细胞依赖性抗原。因此,乙型肝炎患者虽然细胞免疫低下,体内可出现抗HBc,但很少出现抗HBe或抗HBs。临床病程中当患者HBeAg阴转的同时出现抗HBe则显示机体的细胞免疫有所好转。目前,多数治疗乙型肝炎的制品均以HBeAg血清学转换为疗效终点。本实验室进行的复合物型治疗性疫苗的临床研究也以HBeAg血清学转换为治疗终点[19,20]。当患者血清中HBsAg消失并出现抗HBs,则反映机体的免疫功能显著好转或治愈。HBeAg血清学转换虽然有可能发展至HBsAg血清学转换,但也有患者可因免疫功能降低而再度转为抗HBe阴性,HBeAg转阳。单独HBeAg消失而未出现抗HBe,可能是因为HBV被抑制而致相应分泌蛋白降低或消失,主要反映病毒被抑制,并不能反映免疫功能好转。在部分乙型肝炎患者中,可因PreC或C启动子区有突变而致HBeAg阴转或下降,从而转为HBeAg阴性肝炎。因此,在出现HBeAg血清学转换时,应同时检测血清HBV DNA是否下降(<103copies/ml)及ALT是否恢复正常,以全面考核疗效。
4 结语
综上所述,HBeAg的功能与特点总结如下:①HBeAg是具有耐受原与免疫原双重作用的可分泌性蛋白。②HBcAg比HBeAg免疫原性强,因B细胞更易于呈递颗粒性核心抗原的表位。③分泌型HBeAg造成免疫耐受可致HBcAg特异Th1细胞型应答缺失,或转为Th2细胞型应答。HBcAg的细胞免疫主要为Th1细胞型,而HBeAg主要为Th1/2细胞型。HBeAg可致Th1细胞凋亡,交叉调控对HBcAg的Th细胞应答。④PreC蛋白可调控HBeAg。⑤内源性表达的HBeAg经加工及主要组织相容复合物(major histocompatibility complex,MHC)Ⅱ类分子呈递,方可激活HBcAg/HBeAg CD4+细胞,并可能引起细胞杀伤,而胞内HBcAg无此功能。⑥HBeAg可作用于天然免疫,如TLR-2、TLR-4和TLR-7(有争论)。⑦HBeAg的耐受可自然消失或被免疫调控后逆转。抗HBe的出现需要T细胞协同。因此,HBeAg消失、抗HBe出现反映机体T细胞功能有所改善。
[1] Magnius LO, Espmark JA. New specificities in Australia Antigen positive sera distinct from the Le Bouvier determinants [J]. J Immunol, 1972, 109(5): 1017-1021.
[2] Hoofnagle JH, Dusheiko GM, Seeff LB, Jones EA, Waggoner JG, Bales ZB. Seroconversion from hepatitis B e antigen to antibody in chronic type B hepatitis [J]. Ann Intern Med, 1981, 94(6): 744-748.
[3] Trepo CG, Magnius LO, Schaefer RA, Prince AM. Detection of e antigen and antibody: correlation with hepatitis B surface and hepatitis B core antigen, liver disease, and outcome in hepatitis B infections [J]. Gastroenterology, 1976, 71(5): 804-808.
[4] Ou JH, Laub O, Rutter JW. Hepatitis B virus gene function: the precore region targets the core antigen to cellular membranes and causes the secretion of the e antigen [J]. Proc Natl Acad Sci USA, 1986, 83(6): 1578-1582.
[5] Wang J, Lee AS, Ou JH. Proteolytic conversion of hepatitis B virus e antigen precursor to end product occurs in a post endoplasmic reticulum compartment [J]. J Virol, 1992, 65(9): 5080-5093.
[6] Lok ASF, Hadziannois SJ, Weller IVD. The contribution of low level HBV replication to continuing inflammatory activity in patients with anti-HBe positive chronic hepatitis B infection [J]. Gut, 1984, 25(11): 1283-1287.
[7] Thomas HC, Montano L, Goodall A, Koning R, Oladapo J, Wiedman KH. Immunological mechanisms in chronic hepatitis B infection [J]. Hepatology, 1982, 2(Suppl): 112S-121S.
[8] Milich DR, Liang Jt. Exploring the biological basis of hepatitis B e antigen in hepatitis B virus infection [J]. Hepatology, 2003, 38(5): 1075-1086.
[9] Zacharakis G, Koskinas J, Kotsiou S, Tzara F, Vafeiadis N, Papoutselis M, Maltezos E, Sivridis E, Papoutselis K. The role of serial measurement of serum HBV DNA levels in patients with chronic HBeAg(-) hepatitis B infection: association with liver disease progression. A prospective cohort study [J]. J Hepatol, 2008, 49(6): 884-891.
[10] Carman WF, Jacyna MR, Hadziyannis S, Karayiannis P, McGarvey MJ, Makris A, Thomas HC. Mutation preventing formation of hepatitis e antigen in patients with chronic hepatitis B infection [J]. Lancet, 1989, 2(8663): 588-591.
[11] Tur kaspa R, Klein A, Aharonson S. Hepatitis B virus precore mutants are identical in carriers from various ethnic origins and are associated with a range of liver disease severity [J]. Hepatology, 1992, 16(6): 1338-1342.
[12] Tu H, Xioang SD, Trepo C, Wen YM. Frequency of hepatitis B virus e-minus mutants varies among patients from different areas of China [J]. J Med Virol, 1997, 51(2): 85-89.
[13] Milich DR, Chen HK, Hughers JL, Jones JE. The secreted hepatitis B precore antigen can modulate the immune response to the nucleocapsid: a mechanism for persistence [J]. J Immunol, 1998, 160(4): 2013-2021.
[14] Chen MT, Billaud JN, Sällberg M, Guidotti LG, Chisari FV, Jones J, Hughes J, Milich DR. A function of the hepatitis B virus precore protein is to regulate the immune response to the core antigen [J]. Proc Natl Acad Sci USA, 2004, 101(41): 14913-14918.
[15] Visvanathan K, Skinner NA, Thompson AJ, Riordan SM, Sozzi V, Edwards R, Rodgers S, Kurtovic J, Chang J, Lewin S, Desmond P, Locarnini S. Regulation of Toll-like receptor-2 expression in chronic hepatitis B by the precore protein [J]. Hepatology, 2007, 45(1): 102-110.
[16] Lang T, Lo C, Skinner N, Locarnini S, Visvanathan K, Mansell A. The hepatitis B e antigen (HBeAg) targets and suppresses activation of the Toll-like receptor signaling pathway [J]. J Hepatology, 2011, 55(4): 762-769
[17] Milich DR, Schödel F, Hughes JL, Jones JE, Peterson DL. The hepatitis B virus core and e antigens elicit different Th cell subsets: Antigen structure can affect Th cell phenotype [J]. J Virol, 1997, 71(3): 2192-2201.
[18] Jung MC, Diepolder HM, Spengler U, Wierenga EA, Zachoval R, Hoffmann RM, Eichenlaub D, Frösner G, Will H, Pape GR. Activation of a heterogeneous hepatitis B (HB) core and e antigen-specific CD4+T-cell population during seroconversion to anti-HBe and anti-HBs in hepatitis B virus infection [J]. J Virol, 1995, 69(6): 3358-3368.
[19] Xu DZ,Zhao K,Guo LM, Li LJ, Xie Q, Ren H, Zhang JM, Xu M, Wang HF, Huang WX, Bai XF, Niu JQ, Liu P, Chen XY, Shen XL, Yuan ZH, Wang XY, Wen YM. A randomized controlled phase IIb trial of antigen-antibody immuogenic complex therapeutic vaccine in chronic hepatitis B patient [J]. PLoS One, 2008, 3(7): e2565.
[20] Wang XY, Zhang XX, Yao X, Jiang JH, Xie YH, Yuan ZH, Wen YM. Serum HBeAg sero-conversion correlated with decrease of HBsAg and HBV DNA in chronic hepatitis B patients treated with a therapeutic vaccine [J]. Vaccine, 2010, 28(51): 8169-8174.

