免疫预防阻断乙型肝炎病毒母婴传播效果的观察
张磊,桂希恩,曹倩,吴丽珍,热孜艳·伊斯拉夫,宗黎黎,王小萍
1. 武汉大学中南医院感染科,武汉 430071; 2. 湖北通城县妇幼保健院,通城 437400; 3. 新疆伊宁市妇幼保健院,伊宁 835000; 4. 湖北巴东县妇幼保健院,巴东 444300; 5. 湖北孝感市孝南区妇幼保健院,孝感 432100
乙型肝炎是危害我国人民健康的重大传染病。20世纪90年代后,随着乙型肝炎病毒(hepatitis B virus,HBV)疫苗的广泛使用及对医源性感染预防管理的加强,我国HBV表面抗原(hepatitis B virus surface antigen,HBsAg)携带率已由9.75%(1992年)降至7.18%(2006年)[1]。母婴传播仍然是我国HBV感染的重要传播途径。目前,我国预防HBV母婴传播的措施尚不规范,报道的预防效果也不一致[2-5]。为此,本研究随访观察了不同免疫方法阻断的667例HBsAg阳性孕妇及其婴儿在阻断HBV母婴传播中的效果及影响因素,现报道如下。
1 材料和方法
1.1 研究对象
以2008~2009年在湖北省通城县、巴东县及孝感市孝南区妇幼保健院,武汉大学中南医院及新疆维吾尔自治区伊宁市妇幼保健院分娩的HBsAg阳性孕妇667例及其婴儿为研究对象。
1.2 新生儿和婴儿的乙型肝炎免疫阻断
所有新生儿出生24 h内均肌内注射成都蓉生药业公司生产的乙型肝炎免疫球蛋白(hepatitis B immunoglobulin,HBIG) 100 IU,同时在不同部位注射10 μg重组酵母HBV疫苗;1月及6月龄时分别注射同等剂量第2针和第3针HBV疫苗。
1.3 婴儿随访及免疫阻断失败的诊断
婴儿出生后8~12个月,抽取外周血,HBV标志物(HBV marker,HBV-M)、HBsAg及HBV e抗原(hepatitis B virus e antigen,HBeAg)检测均阴性者视为未感染HBV,HBsAg、HBeAg及HBV核心抗体(hepatitis B virus core antibody, HBcAb)均阳性者诊断为HBV感染,判断为免疫阻断失败。
1.4 孕妇HBeAg、HBV DNA状况及接受HBIG注射情况
667例HBsAg阳性孕妇中,HBeAg阳性218例,占32.7%;HBeAg阴性449例,占67.3%。
共149例孕妇进行了HBV DNA定量检测,以HBV DNA=3 log10copies/ml为界点,分为HBV DNA阴性组(DNA<3 log10copies/ml)及HBV DNA阳性组(DNA≥3 log10copies/ml)。阳性者86例,占57.7%,其中DNA≥6 log10copies/ml共66例,占DNA阳性者76.7%。
2009年前湖北省多数县级医疗单位要求对感染HBV的孕妇注射HBIG,2009年开始参与本研究的医疗单位不再提出上述要求,但仍有孕妇受传统观念的影响,要求注射HBIG。本研究对象中,218例HBsAg阳性孕妇因上述原因分别在妊娠28、32、36周接受成都蓉生药业公司生产的HBIG 200 IU(共肌内注射3次,总剂量600 IU);449例孕妇未接受HBIG注射。接受HBIG注射的孕妇平均年龄为(27.8±4.3)岁,未接受HBIG注射的孕妇平均年龄为(27.3±4.8)岁, 无显著差异(P>0.05)。接受HBIG注射的孕妇剖宫产率为59.2%,未接受HBIG注射的孕妇剖宫产率为56.5%,无显著差异(P>0.05)。
1.5 实验室检测
1.5.1HBV-M检测采用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测HBV-M。HBsAg、HBV表面抗体(hepatitis B virus surface antibody,HBsAb)、HBeAg、HBV e抗体(hepatitis B virus e antibody,HBeAb)及HBcAb检测试剂盒购自上海科华工程股份有限公司,检测仪器为Sunrise Remote/Touch Screen ELISA全自动酶标免疫分析仪,严格按说明书要求操作及判断结果。
1.5.2HBVDNA检测采用荧光定量聚合酶链反应(polymerase chain reaction,PCR)法检测HBV DNA。HBV核酸定量检测试剂盒购自上海科华工程股份有限公司,检测仪器为杭州生物技术有限公司Line-Gene 实时PCR检测系统仪,按说明书要求操作及判断结果,HBV DNA≥1 000 copies/ml为阳性。
1.6 伦理学要求
本研究经武汉大学中南医院伦理委员会批准。实验检测获乙型肝炎孕妇的知情同意。
1.7 统计学分析
数据采用SPSS17.0软件分析,率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 HBV母婴传播免疫阻断失败率
随访667例HBsAg阳性孕妇及其出生后8~12个月的婴儿。婴儿HBsAg、HBeAg及HBcAb均阳性20例,免疫阻断失败率为3.0%。免疫阻断失败的患儿中,11例出生时做脐血(4例)或股静脉血(7例)检测,其中10例(90.9%)HBsAg阳性,8~12个月后持续阳性且HBeAg及HBcAb同时阳性。
2.2 孕妇HBeAg阳性对HBV母婴传播及免疫应答的影响
HBeAg阳性孕妇的免疫阻断失败率显著高于HBeAg阴性孕妇,但两组免疫应答率无显著差异(表1)。
表1HBeAg对HBV母婴传播及免疫应答影响(n=667)
Tab.1TheeffectsofHBeAgonmother-to-infanttransmissionofHBVandimmuneresponse(n=667)
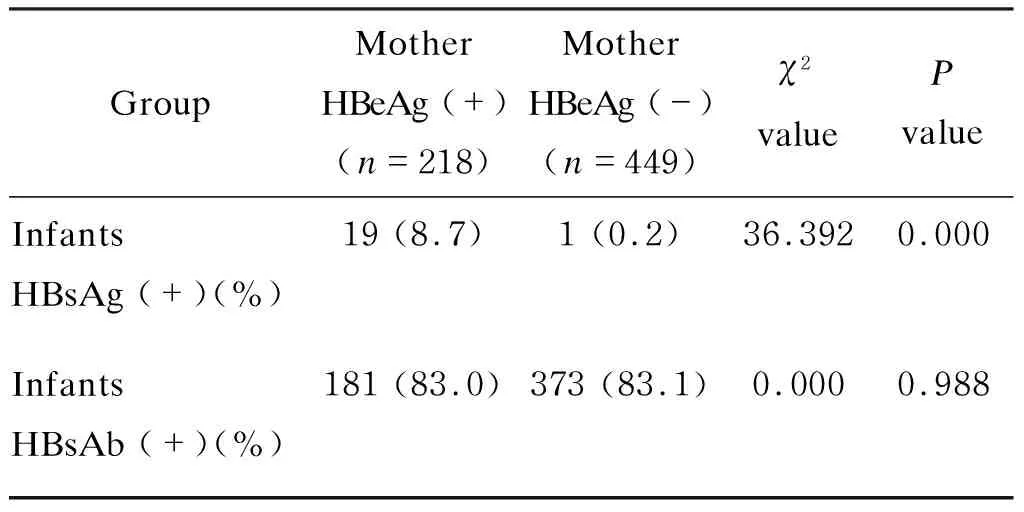
GroupMother HBeAg (+)(n=218)Mother HBeAg (-)(n=449)χ2 valuePvalueInfants HBsAg (+)(%)19 (8.7)1 (0.2)36.3920.000Infants HBsAb (+)(%)181 (83.0)373 (83.1)0.0000.988
2.3 孕妇HBV DNA对HBV母婴传播及免疫应答的影响
免疫阻断后仍然感染HBV的7例患儿均系HBV DNA阳性孕妇所生。HBV DNA阳性孕妇所生未感染HBV婴儿的HBsAb阳性率显著低于对照组(表2)。
表2HBVDNA对HBV母婴传播及免疫应答的影响(n=149)
Tab.2TheeffectsofHBVDNAonmother-to-infanttransmissionofHBVandimmuneresponse(n=149)

GroupMother DNA (+)(n=86)Mother DNA (-)(n=63)χ2 valuePvalueInfants HBsAg (+)(%)7 (8.1)0 (0.0)3.7160.054Infants HBsAb (+)(%)72 (83.7)60 (95.2)4.7720.029
2.4 HBV DNA 阳性孕妇 DNA 拷贝数对 HBV 母婴传播及免疫应答的影响
免疫阻断失败的患儿均为HBV DNA≥6 log10copies/ml的孕妇所生,但现有观察数与对照组比较,两组HBV母婴传播率及免疫应答率无显著差异(表3)。
表3HBVDNA拷贝数对HBV母婴传播及免疫应答的影响(n=86)
Tab.3TheeffectsofHBVDNAcopiesonmother-to-infanttransmissionofHBVandimmuneresponse(n=86)

GroupMother DNA<6 log10 copies/ml(n=20)Mother DNA≥6 log10copies/ml(n=66)χ2 valuePvalueInfants HBsAg (+)(%)0 (0.0)7 (10.6)1.1090.292Infants HBsAb (+)(%)17 (85.0)55 (83.3)0.0001.000
2.5 给孕妇注射 HBIG 对 HBeAg 阳性孕妇 HBV母婴传播和免疫应答的影响
667例HBsAg阳性孕妇所生的婴儿中,20例免疫失败。其中218例孕妇接受HBIG注射,婴儿感染HBV 8例,占3.7%;449例孕妇未接受HBIG注射,婴儿感染HBV 12例,占2.7%。两组免疫阻断失败率无显著差异(χ2=0.502,P=0.479)。两组对HBV疫苗的免疫应答率分别为84.4%和82.4%,无显著差异(χ2=0.416,P=0.519)。孕期接受HBIG注射对HBeAg阳性及阴性孕妇HBV母婴传播的影响见表4。
表4孕期接受HBIG注射对HBeAg阳性及阴性孕妇HBV母婴传播的影响(n=667)
Tab.4TheeffectsofantepartumimmuneinterruptionsofHBIGonmother-to-infanttransmissionofHBVinHBeAg-positiveandHBeAg-negativemothers(n=667)

GroupMother HBeAg (+)With HBIG(n=95)Without HBIG(n=123)Mother HBeAg (-)With HBIG(n=123)Without HBIG(n=326)InfantsHBsAg (+)(%)8 (8.4)11 (8.9)0 (0.0)1 (0.3)InfantsHBsAb (+)(%)80 (84.2)101 (82.1)104 (84.6)269 (82.5)
The HBV infection rates of infants born to HBeAg-positive mothers had no statistical difference between the mothers receiving HBIG and not receiving HBIG (χ2=0.018,P=0.892), and so did the production rates of HBsAb in infants (χ2=0.167,P=0.683). The HBV infection rates of infants born to HBeAg-negative mothers had no statistical difference between the mothers receiving HBIG and not receiving HBIG (χ2=0.378,P=0.538), and so did the production rates of HBsAb in infants (χ2=0.264,P=0.608).
3 讨论
HBV母婴传播可发生在宫内、产时及产后。既往资料表明,我国慢性HBV感染者约30%是通过母婴传播产生的[6],围生期感染HBV的小儿有90%成为HBV慢性无症状携带者[7]。近年来,随着为HBsAg阳性孕妇所产新生儿注射HBIG 和HBV疫苗的联合免疫方法逐渐普及,HBV母婴传播率已大幅下降。然而不同研究结果显示的传播率波动范围较大,据报道有3.15%~40.1%的胎儿发生宫内感染[8,9]。HBIG可中和血清中的HBV颗粒,在HBV疫苗发挥最大免疫作用前,可对高危新生儿提供被动免疫,阻断产时及产后感染,这可能是HBV母婴传播率下降的重要原因;同时也提示目前免疫失败的原因主要为宫内感染,与相关研究结果一致[8]。
本研究发现,免疫阻断失败者绝大多数为HBeAg阳性孕妇,免疫阻断失败率为8.7%,远高于HBeAg阴性孕妇(0.2%)(P<0.001),提示HBeAg阳性孕妇应为预防HBV母婴传播的重点对象。
HBV DNA反映HBV在宿主体内的复制程度。研究表明,孕妇HBV DNA定量值越高,感染性越强[10,11]。本研究以血清HBV DNA≥3 log10copies/ml为HBV DNA阳性判定标准,免疫阻断后仍然感染HBV的7例患儿均系HBV DNA阳性孕妇所生,孕妇血清HBV DNA均≥6 log10copies/ml。结果初步显示,血清HBV DNA为6 log10copies/ml可能是HBV宫内传播的界点,值得进一步研究。
鉴于对乙型肝炎相关肝移植患者在手术中及肝移植后注射大剂量HBIG可减少乙型肝炎复发,我国有些学者主张对感染HBV的孕妇注射小剂量HBIG(妊娠28、32及36周分别注射HBIG 200 IU)以加强预防HBV母婴传播的效果[12,13]。我国许多医疗单位将之列为预防HBV母婴传播的常规方法。但是,HBIG对慢性乙型肝炎没有治疗作用[2,3]。肝移植患者术中静脉注射HBIG 10 000 IU,肝切除术后1~7 d每日注射同等剂量HBIG,此后定期注射较大剂量HBIG达18个月,才能减少乙型肝炎的复发。因此,乙型肝炎孕妇在体内存在肝脏感染的情况下,孕晚期每月仅接受1次小剂量(200 IU)HBIG注射就能阻断HBV母婴传播是不可思议的。本研究结果显示,妊娠期注射小剂量HBIG并不能提高HBsAg阳性及HBeAg阳性孕妇婴儿对HBV疫苗免疫阻断的应答。在免疫阻断失败的患儿中,11例出生时进行了脐血或外周血检测,其中10例HBsAg阳性,8~12个月后持续阳性且HBeAg及HBcAb均为阳性,提示为宫内感染。因此,目前采用针对新生儿的主动免疫(HBV疫苗)及被动免疫(注射HBIG),只能有效阻断分娩时或产后的HBV母婴传播,缺乏阻断HBV宫内传播的有效方法。
如何预防HBV宫内感染是乙型肝炎流行严重地区面临的重要挑战。药物预防人类免疫缺陷病毒(human immunodeficiency virus, HIV)母婴传播的成功经验提示,孕前或分娩前进行抗HBV的药物治疗,特别是对HBV DNA血清高效价的感染者进行抗HBV药物治疗,是值得探索的阻断HBV宫内传播途径。学者们的初步探索提示,拉米夫定和替比夫定可降低HBV的宫内传播[14-16],但其有效性及安全性尚需更完善的大样本临床试验证实。
[1] 庄辉. 乙型肝炎流行病学研究进展[J]. 中国医学前沿杂志(电子版), 2009, 1(2): 18-24.
[2] 孙玉革,庄辉,韩忠厚,刘平,王秀艳,张立会,赵培利,王玉华,孙谢文,臧凯. 孕晚期注射乙肝免疫球蛋白对乙型肝炎病毒母婴传播阻断率影响的探讨[J].中华实验和临床感染杂志,2007,1(3):155-157.
[3] 韩忠厚,钟连华,王佳,赵庆利,孙玉革,李丽玮,曹丽华,郝向春,庄辉. 妊娠晚期孕妇注射乙型肝炎免疫球蛋白对其血清 HBV DNA及新生儿抗-HBS的影响[J].中华内科杂志,2007,46(5):376-378.
[4] Shi Z, Li X, Ma L, Yang Y. Hepatitis B immunoglobulin injection in pregnancy to interrupt hepatitis B virus mother-to-child transmission—a meta-analysis [J]. Int J Infect Dis, 2010,14(7):e622-e634.
[5] Yao JL. Perinatal transmission of hepatitis B virus infection and vaccination in China[J]. Gut,1996,38(Suppl 2):S37-S38.
[6] 朱启镕.重视与加强乙型肝炎病毒母婴传播的研究[J].中华儿科杂志,2006,44(12):883-885.
[7] 骆抗先.乙型肝炎基础和临床[M].第3版.北京:人民卫生出版社,2006,425-426.
[8] 王锋,韩国荣,李凤珍,薛玉珍. 孕母乙肝标志物及 HBV-DNA含量与新生儿宫内感染关系的探讨[J]. 现代医学,2009,37(6):435-437.
[9] Zhang SL, Yue YF, Bai GQ, Shi L, Jiang H. Mechanism of intrauterine infection of hepatitis B virus[J]. World J Gastroenterol, 2004,10(3):437-438.
[10] 马兴璇,黄玲,李凤梅,严龙,刘春明,黄国积,苏柳,廖滔. 孕妇血清HBV DNA含量与胎儿宫内感染HBV关系的研究[J].临床检验杂志,2006,24(6):463.
[11] 郭广洲,陈延娥,林坚,廖莳,伍春兰,康春阳. 孕妇HBV-DNA定量对监测母婴HBV传播价值的探讨[J].中国妇幼保健,2005,20(23):3080-3081.
[12] 罗晓冬,向玲,甘发清,罗晓春,吴曼. 乙型肝炎免疫球蛋白阻断乙型肝炎病毒母婴传播100 例临床分析[J].中国实用医药,2007,2(20):56-57.
[13] 朱启镕,吕晴,顾心焕,段恕诚,徐华芳,张秀珍,董左叔.阻断乙型肝炎病毒宫内传播的初步研究[J].中华儿科杂志,1995,33(2):93-94.
[14] Xu WM, Cui YT, Wang L, Yang H, Liang ZQ, Li XM, Zhang SL, Qiao FY, Campbell F, Chang CN, Gardner S, Atkins M. Lamivudine in late pregnancy to prevent perinatal transmission of hepatitis B virus infection: a multicentre, randomized, double-blind, placebo-controlled study [J]. J Viral Hepat, 2009,16(2):94-103.
[15] 张丽菊,王玲. 替比夫定对妊娠后期乙型肝炎病毒宫内感染的阻断作用[J]. 中华肝脏病杂志,2009,17(8):561-563.
[16] 曾艳梅,张思泉,姿国强,陈君,施军平,刘寿荣,黄劲松. 替比夫定阻断乙肝病毒宫内感染的临床研究[J]. 中国临床药理学与治疗学,2010,15(4):443-445.

