正交试验法研究侧柏叶总黄酮的提取工艺
陈兴芬,单承莺,马世宏,张卫明*
(1.南京师范大学生命科学学院,江苏南京 210097;2.南京野生植物综合利用研究院,江苏南京 210042)
侧柏叶 (Cacumen platycladi)又名柏叶,丛柏叶,扁柏叶,是侧柏〔Platycladus orentalis(L.)Franco〕的干燥嫩枝梢及叶。中医认为侧柏叶气清香,味苦涩、微辛,具有凉血止血、祛风降湿、化痰止咳、消肿散毒、生发乌发的功效。在侧柏叶的化学成分中,黄酮类的含量较为丰富,且被认为是主要功能性成分之一[1]。通常,黄酮类化合物的提取,主要是根据其性质和提取过程中附带的杂质是否容易去除从而选择适宜的提取溶剂和提取方法,除此之外,在提取的过程中,原料的粉碎度、提取温度、提取时间等也影响提取效率[2]。本文以正交试验的方法,考察侧柏叶总黄酮提取工艺中的最佳条件。
1 主要材料与仪器
1.1 材料及药品
侧柏叶:购于南京市先声药店,粉碎,过 40目筛 ,备用;
芦丁标准品:中国药品生物制品检定所,纯度99.9%;
乙醇、甲醇、石油醚、乙酸乙酯、三氯化铝均为市售分析纯;
实验用水为去离子水。
1.2 仪器
高速万能粉碎机,天津市泰斯特仪器有限公司;
METTLERAE240电子天平,上海天平仪器厂;
RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;
LXJ– II离心沉淀机 (4 000 r/min),上海医用分析仪器厂;
TU-1800紫外可见分光光度计,北京普析通用仪器有限责任公司;
HH-4数显恒温水浴锅,金坛市江南仪器厂。
2 实验方法
2.1 侧柏叶总黄酮的测定
以芦丁为标样,采用分光光度法测定总黄酮的含量[3,4]。侧柏叶总黄酮的含量为提取液旋转蒸发所得浸膏中总黄酮的质量与原料侧柏叶的质量之比。
2.1.1 标准品溶液的配制
精密称取 105℃干燥至恒重的芦丁标准品 20 mg,以 75%乙醇为溶剂,定容至 100 mL容量瓶中,配制成 0.2 mg/mL的芦丁标准品溶液。
2.1.2 样品溶液的配制
称取侧柏叶适量干粉,按 1∶15比例加入石油醚回流脱脂 2次,每次 2 h。脱脂后的侧柏叶粉末烘干,备用。精密称取 10 g脱脂的侧柏叶干粉,按 1∶12.5的比例加入 75%乙醇热回流提取 2次,每次2 h,合并提取液,离心,取上清液并减压浓缩至浸膏,抽真空干燥。精密称取 20 mg侧柏叶醇提物,以75%的乙醇为溶剂,定容至 50 mL的容量瓶中,配制0.4 mg/mL的样品溶液[1]。
2.1.3 测定波长的选择
分别吸取芦丁标准溶液和样品溶液各 0.5 mL,分别用 75%乙醇为溶剂,定容至 10 mL容量瓶中。分别吸取 2 mL,加入 2 mL 1%AlCl3显色 10 min,以1%AlCl3为空白对照,在 200~900 nm波长范围内扫描[5-7]。
2.1.4 标准曲线的绘制
精密称取 120℃常压干燥至恒重的芦丁标准品20 mg,用 75%的乙醇定容至 100 mL作为母液,精密吸取 2、4、6、8、10 mL,分别用 75%乙醇定容至 25 mL。取不同浓度的芦丁标准品溶液 2 mL,加入 1%AlCl3溶液 2 mL,以 75%的乙醇 2 mL加入 1%AlCl3溶液 2 mL作为空白对照,静置 15 min,测定吸光度[8]。
按 2.1.2节的方法配制样品溶液,自 2.1.4节中“加入 1%AlCl3溶液 2 mL”起,同上操作,测定总黄酮含量。
2.2 提取条件单因素实验
2.2.1 乙醇体积分数对侧柏叶总黄酮含量的影响
选择不同的乙醇体积分数:45%、55%、65%、75%、85%,按料液比 1∶12.5(g/mL)加入 75%乙醇加热回流提取 2 h,重复提取 2次。
2.2.2 提取时间对侧柏叶总黄酮含量的影响
选择不同的提取时间 :1、1.5、2、2.5、3 h,按料液比 1∶12.5(g/mL)加入 75%乙醇加热回流提取2 h,重复提取 2次。
2.2.3 料液比对侧柏叶总黄酮含量的影响
选择不同的料液比 (g/mL):1∶8、1∶10、1∶12.5、1∶15,加入 75%乙醇加热回流提取 2 h,重复提取 2次。
第二,生态保护和修复工程进展顺利。开展“绿盾”国家级自然保护区监督检查专项行动,完成京津冀、长江经济带、宁夏等15个省(区、市)生态保护红线划定。目前,中国正在稳步实施一批重大生态保护与修复工程,包括天然林资源保护、退耕还林还草、退牧还草、防护林体系建设、河湖与湿地保护修复、防沙治沙、野生动植物保护及自然保护区建设等。荒漠化和沙化状况连续三个监测周期实现面积“双缩减”。草原面积近4亿公顷,约占国土面积的41.7%,成为全国面积最大的陆地生态系统。自然保护区面积不断扩大,截至2017年底全国各种类型、不同级别的自然保护区总面积达到147.17万平方千米。
2.3 提取条件正交试验设计及验证
2.3.1 提取条件正交试验设计
在单因素实验结果的基础上,选取确定的最优条件,以总黄酮的含量为指标,选用 L9(34)正交试验,考察乙醇体积分数 (A)、提取时间 (B)和料液比(C)对提取效果的影响,从而确定最佳提取工艺条件。因素水平见表1。
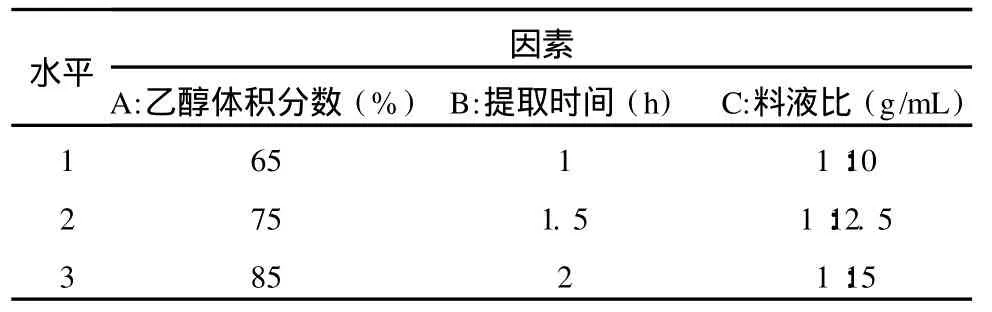
表1 正交试验因素水平表
2.3.2 验证实验
准确称量侧柏叶 3份,每份 10 g,按确定的最佳条件提取,每份样品溶液平行测定 3次,计算总黄酮平均含量。
3 结果与分析
3.1 侧柏叶总黄酮含量的测定
3.1.1 测定波长的确定
经AlCl3显色后的芦丁标准品溶液和样品溶液在 415 nm处有特征吸收峰,故选用 AlCl3显色法测定侧柏叶总黄酮的含量,并确定 415 nm为检测波长。
3.1.2 芦丁标准曲线
以芦丁标准溶液的浓度 C为横坐标,吸光度 A为纵坐标作图,绘制标准曲线见图2.1。求得标准曲线回归方程:C=0.030 3x-0.017 3(R2=0.999 7),表明芦丁质量浓度在 8~40μg/mL范围内线性关系良好。
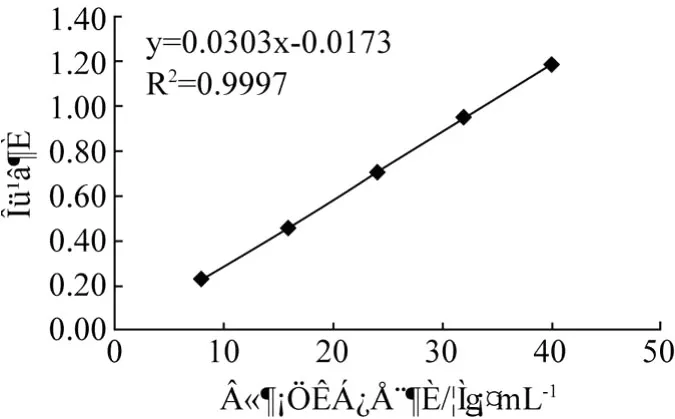
图1 芦丁标准曲线
3.1.3 侧柏叶样品中总黄酮含量
以芦丁作为标准品,采用 AlCl3显色,在 415 nm处测定总黄酮含量为 1.65%。
3.2 提取条件单因素实验结果
3.2.1 乙醇体积分数对侧柏叶总黄酮得率的影响
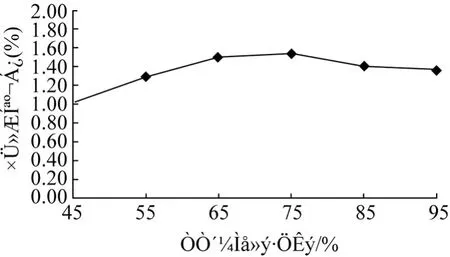
图2 乙醇体积分数对侧柏叶总黄酮含量的影响
实验结果表明,随乙醇体积分数的增大,侧柏叶总黄酮含量亦增大,乙醇体积分数在 65%和 75%时变化不大,在 75%时达到最大值,后随着体积分数的增大反而降低。可能是乙醇体积分数越大,黄酮类物质溶出的效果越好,但随着乙醇体积分数的增大,一些醇溶性杂质溶出量增加,与黄酮类物质竞争同醇 -水分子的结合,从而导致总黄酮含量降低,因此,乙醇体积分数选在 75%左右较为合适。
3.2.2 提取时间对侧柏叶总黄酮得率的影响
侧柏叶总黄酮含量随时间的延长略有增加,2 h达到最大值,不过在 1.5 h和 2 h之间变化幅度不大,之后随提取时间的延长逐渐降低。可能与长时间强热效应对侧柏叶中黄酮类物质产生破坏,从而使其降低,从节省能源的角度考虑,选取提取时间为1.5 h。
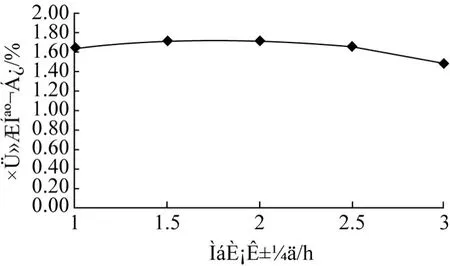
图3 提取时间对侧柏叶总黄酮含量的影响
3.2.3 料液比对侧柏叶总黄酮得率的影响

图4 料液比对侧柏叶总黄酮含量的影响
随着乙醇比例的升高,侧柏叶总黄酮含量亦升高,当料液比为 1∶15时,达到最高,但是在料液比为1∶12.5时接近最大值。可能是乙醇用量的增加有利于黄酮类物质向提取液中溶出。当乙醇用量达到一定限度后,原料表面与乙醇的体积差对总黄酮溶出的影响不大,所以基本保持不变。考虑节省资源及后续处理,料液比选取为 1∶12.5。
3.3 提取条件正交实验设计及验证
3.3.1 提取条件正交实验设计结果
在单因素实验基础上,对乙醇体积分数、提取时间和料液比 3个因素进行了 L9(34)正交试验,每个实验做 3次重复,其因素水平见表2,正交试验设计及结果见表3。
由正交实验设计直观分析可得:单因素实验结果中以 A2B2C2组合最佳,但正交试验结果中以A1B3C3组合的黄酮含量最大,并且各因素对侧柏叶总黄酮含量的影响主次顺序为:C>A>B,同时料液比对其影响要显著大于乙醇体积分数及提取时间两个因素;由方差分析结果可知,因素 C的影响显著,A与 B的影响皆不显著。综上所述,考虑节省资源选取最佳提取条件为:A1B2C3即用 65%乙醇提取 2次、提取时间 1.5 h、每次料液比 1∶15的工艺条件为较佳实验组合。
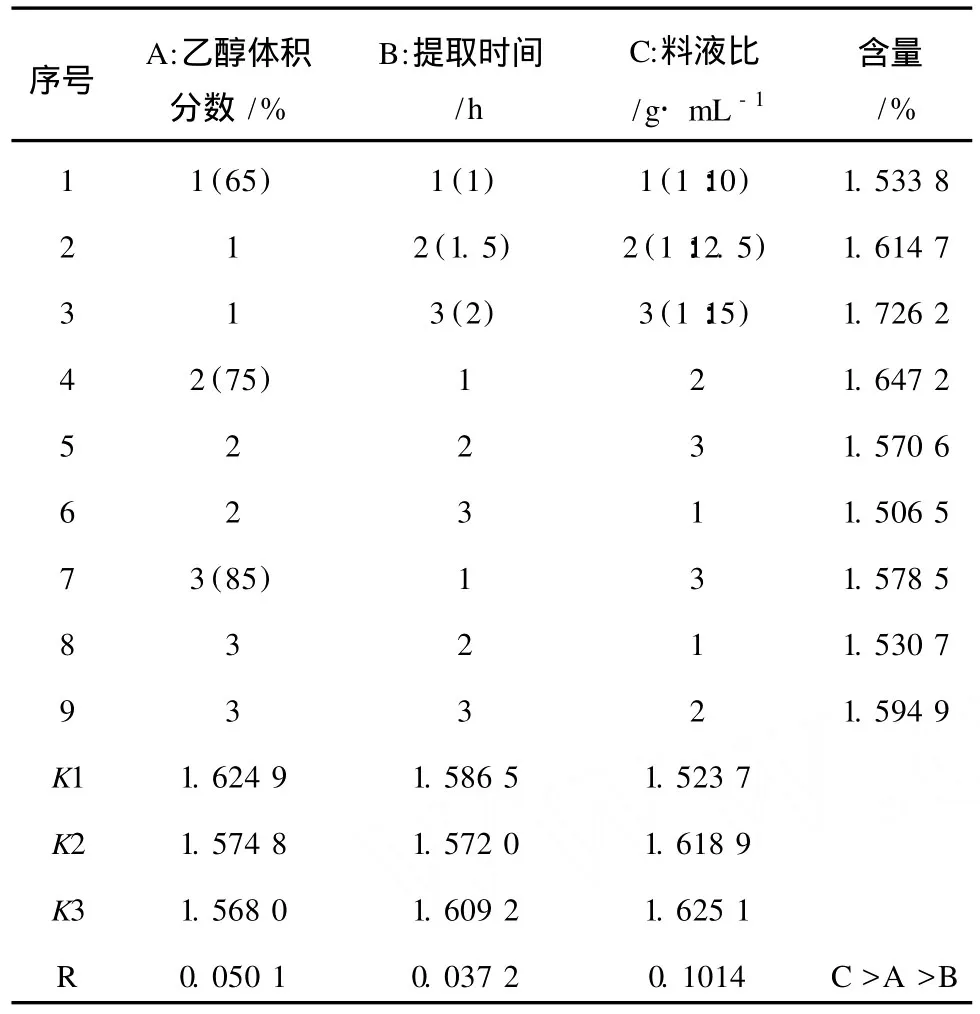
表2 正交试验设计及结果
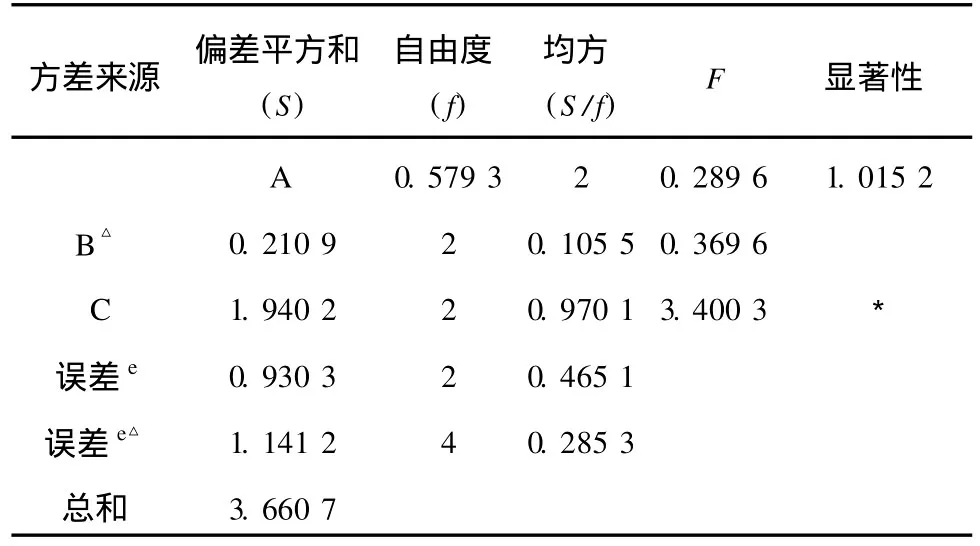
表3 正交试验方差分析表
3.3.2 正交实验验证
按正交试验选取的最佳提取工艺条件 A1B2C3进行重复试验,所得结果重现性较好,测定的黄酮含量较高,结果较为理想。结果见表4。

表4 正交试验验证结果
4 结 论
正交实验研究结果表明,由正交实验设计直观及方差分析结果可得:影响侧柏叶总黄酮含量的因素大小为:料液比 >乙醇体积分数 >提取时间,同时料液的影响要显著大于乙醇体积分数及提取时间两个因素;料液比对侧柏叶总黄酮含量的影响显著,其他两个因素影响皆不显著。综上所述,考虑节省资源选取用 65%乙醇提取 2次、提取时间 1.5 h、每次料液比 1∶15的工艺条件为较佳组合。采用上述工艺条件进行重复试验,验证该工艺重现性较好,总黄酮含量约为 1.7016%。
[1] 张国琴,刘延红,潘田琅,等.侧柏叶中总黄酮成分含量测定[J].西北药学杂志,2001,16(3):107-108.
[2] 景谦平,尉 芹.影响植物有效成分提取的因素述评[J].西北林学院学报,2001,16(3):29-31.
[3] 吕国良.紫外分光光度法测定蜂胶软胶囊中总黄酮含量方法的研究[J].现代仪器,2008(3):73-74.
[4] 伍蔚萍,孙文基,阎洪涛,等.分光光度法测定甘草中总黄酮的含量[J].药物分析杂志,2005,25(4):469-472.
[5] 裴咏萍,李维林,张涵庆.三氯化铝比色法测定中药中总黄酮含量的方法改进[J].现代中药研究及实践,2009,23(4):58-60.
[6] 钟世安,李 维,乔 蓉.分光光度法测定油皮中黄酮类化合物[J].光谱实验室,2007,24(4):598-601.
[7] 吴亮亮,石雪萍,张卫明.花椒总黄酮测定方法研究[J].食品工业科技,2010,31(10):372-374.
[8] 何照范,张迪青.保健食品化学及检测技术[M].北京:中国轻工业出版社,1998.

