微波法制备壳聚糖研究
张 洁,史劲松,孙达峰,朱昌玲
(1.南京野生植物综合利用研究院,江苏南京210042;2.江南大学医药学院,江苏 无锡214122)
壳聚糖(chitosan)是甲壳素(chitin)部分脱乙酰化产物,是2-氨基-2-脱氧-D-葡萄糖单体以β(1→4)苷键连接而成的直链多糖[1]。壳聚糖可溶于大多数有机酸和无机酸的水溶液中。与甲壳素相比,壳聚糖的溶解性和反应活性有很大提高。作为一种天然的碱性多糖,壳聚糖无毒,有良好的生物相容性和降解性,因而被用于医学、食品及食品添加剂、日化产品、污水处理[2]和农业等领域[3,4]。尽管壳聚糖的市场需求量大,但是工业生产方法相对落后。目前主要的生产方法包括热碱降解法[1]和酶解法[5]。热碱降解法是用浓碱液浸泡甲壳素,在高温条件下,经过长时间处理,制备壳聚糖。生产过程对设备腐蚀严重,并对环境造成很大污染。而且,热碱降解法对壳聚糖的糖苷键破坏严重,所得产品易降解,粘均分子量较小,分子量分布过宽。酶解法是一种清洁的、条件温和的生产方法,但是成本高,难于大规模生产。因此,寻找高效高产的壳聚糖生产方法仍是目前研究的焦点之一。随着微波技术的发展,有研究者提出利用微波加热制备壳聚糖[6-9]。
微波是位于光波和无线电波之间的电磁波,频率在0.3 ~300 GHz之间[10]。微波具有高效、均匀、节能、环保等优点,应用涉及化学合成、分析化学、石油化工、矿物冶金、环境保护等领域[11-14]。与传统加热方法相比,微波加热可以显著缩短反应时间,减少副反应,提高产率,改善反应的重现性。
本文研究了微波条件下甲壳素脱乙酰反应。着重考察了NaOH浓度和微波加热时间对微波场中甲壳素非均相碱法脱乙酰反应的影响。
1 材料与方法
1.1 原料与试剂
甲壳素由扬州日兴生物科技股份有限公司提供,经过粉碎,并过100目筛;NaOH、HCl、冰醋酸等均为国产化学纯试剂。
1.2 主要仪器
微波炉:美的MM720FC8-PS,额定输出功率700 W;NDJ-5S型旋转粘度计:上海昌吉地质仪器有限公司;FT-IR 360红外光谱仪:美国Nicolet公司。
1.3 实验方法
1.3.1 甲壳素微波脱乙酰反应
称取10.00 g甲壳素,置于500 mL聚四氟乙烯烧杯中。向烧杯中加入浓NaOH溶液,搅拌均匀后,静置10 min。甲壳素与NaOH溶液的体积比为1∶8[15]。将甲壳素与NaOH混合溶液置于微波炉中,利用微波加热混合物。反应结束后,洗去产物中过量的碱,得到壳聚糖粗产物。
1.3.2 壳聚糖的提纯
用5%HCl溶液溶解壳聚糖粗产物。壳聚糖完全溶解之后,抽滤,除去溶液中的不溶物。所得滤液用30%NaOH溶液调节至碱性,使壳聚糖析出。洗涤析出的壳聚糖,除去产品中多余的离子。直至产品的pH值为中性,并用AgNO3试剂检测滤液中残余的Cl-。在60℃,将提纯后的壳聚糖产品烘干至恒重。
1.3.3 壳聚糖脱乙酰度的测定
按照中华人民共和国水产行业标准(SC/T 3403-2004),用电导法测定壳聚糖的脱乙酰度。准确称取壳聚糖0.2000 g,倒入250 mL锥形瓶中,加入20 mL 0.100 0 mol/L盐酸。将锥形瓶置于电磁搅拌器座上,在20℃下搅拌至壳聚糖溶解,再加入50 mL蒸馏水。用0.1000 mol/L NaOH标准溶液滴定上述壳聚糖溶液。每滴加0.4 mL NaOH标准溶液,记录一次电导率,并做电导率-NaOH溶液体积曲线。壳聚糖的脱乙酰度按下式计算
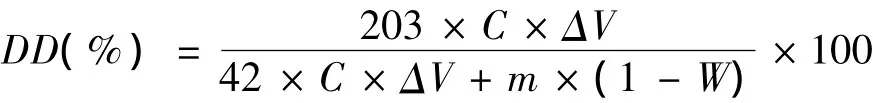
式中:DD—壳聚糖的脱乙酰度,%;C—NaOH标准溶液的浓度,mol/L;ΔV—电导率保持恒定时,滴定用NaOH标准溶液体积,mL;m——壳聚糖样品质量,mg;W—壳聚糖样品中的水分含量,%;203—甲壳素相对分子质量;42—乙酰基相对分子质量。
1.3.4 壳聚糖溶液黏度的测定
称取壳聚糖样品3.000 g,溶于300 mL 1%醋酸溶液,置于25℃水浴中。待溶解完全后,用NDJ-5S型旋转粘度计测定溶液黏度(1号转子,设定转速60 r/min,25 ℃)。
1.3.5 壳聚糖的红外光谱
105℃下烘干壳聚糖,采用KBr压片法测定样品在400~4 000 cm-1的红外光谱。
1.3.6 壳聚糖的粘均分子量
使用乌氏粘度计,采用一点法,以0.1%的醋酸为溶剂,壳聚糖溶液浓度为0.01%,在25℃测定壳聚糖溶液的流出时间。按照经验公式求得溶液的特性粘度[η]
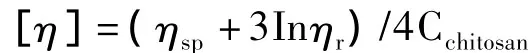
其中ηsp=(t/t0)-1;ηr=t/t0;t为壳聚糖溶液流出时间;t0为溶剂流出时间;Cchitosan为壳聚糖溶液浓度(g/mL);
2 结果与讨论
在一定温度下,甲壳素固体与浓碱溶液反应,脱去乙酰基,得到壳聚糖。由于反应发生在固相与液相之间,反应过程中物质的扩散及传递存在一定困难。在常规加热条件下,甲壳素非均相碱法脱乙酰反应属于一级化学反应[16-17]。但是采用微波加热,并在敞口容器中进行的甲壳素脱乙酰反应受到反应温度和NaOH溶液浓度的影响,反应过程比较复杂。在加热过程中,碱液中的水分挥发,NaOH溶液浓度不断增大。此时,反应不符合一级化学反应的规律[18]。碱溶液的浓度和微波加热时间是影响壳聚糖脱乙酰度的重要因素。
2.1 NaOH溶液浓度对甲壳素脱乙酰反应的影响
取浓度分别为40%、45%、50%、55%的NaOH溶液,与甲壳素混合,置于微波炉中,固定微波加热时间为30 min,制备壳聚糖。所得壳聚糖经过处理后,测定壳聚糖的脱乙酰度(DD)和粘均分子量(Mr)。将壳聚糖溶于1% 醋酸溶液中,测定溶液的黏度(η)。

表1 NaOH溶液浓度(CNaOH)与壳聚糖的脱乙酰度(DD)、粘均分子量(Mr)和溶液黏度(η)的关系
由上表可知,固定微波加热时间,随NaOH溶液浓度增加,壳聚糖的脱乙酰度先增加,后减小,NaOH溶液浓度为45%时,壳聚糖的脱乙酰度最大。用不同浓度NaOH溶液制备的壳聚糖的粘均分子量相近,其1%醋酸溶液的黏度均为60 mPa·s。
在强碱性溶液中,甲壳素不仅直接与浓碱发生脱乙酰反应,生成壳聚糖[1];而且OH-和水分子可以进入甲壳素分子,使大分子溶胀,分子体积增大,柔度增大,N-乙酰基受攻击的几率增加。壳聚糖分子在强碱性溶液中可能发生分子链断裂,分子量降低[19]。NaOH溶液浓度增大,对甲壳素脱乙酰反应与壳聚糖降解反应都有利。最终所得壳聚糖的脱乙酰度和分子量大小,是两个反应竞争的结果。本文所得壳聚糖的粘均分子量较大,其1% 醋酸溶液的黏度较高,甲壳素脱乙酰反应占主要地位。
限于已有的实验条件,本文采用普通微波炉加热反应混合物。普通微波炉采用磁铁开关循环控制的脉冲加热和多模设计产生的不均匀场,不能精确地控制反应温度和加热时间,缺少压力控制和对反应混合物的搅拌方法[10]。微波进入炉腔后,通过腔壁的反射,以无序方式与样品相互作用。多模炉腔内部可能出现具有不同能量密度的多重能量小区域,产生了热点和冷点。尽管微波发射的功率很高,但是微波场中的功率密度通常较低,空腔内能量分布不均匀。如果此时不能对反应体系施加有效地搅拌,仅依靠自发地传导和对流传递热量,热量传递效率低,分布不均匀。体系内部不同位置的反应温度不同,反应速度也有区别。本文采用未经任何改装的普通微波炉,反应过程中不能对甲壳素与NaOH溶液混合物进行有效地搅拌。微波加热下,甲壳素与NaOH浓溶液的混合物中可能存在热量不同的小区域。热点和冷点之间热量交换效率降低,冷点的热力学效应不明显。而且随着NaOH溶液浓度升高,黏度增加,NaOH与甲壳素粉末混合不均匀。甲壳素脱乙酰反应的速率整体降低。因此,尽管NaOH溶液浓度增加有利于脱乙酰反应,使壳聚糖脱乙酰度增大;但是NaOH溶液浓度高于45%后,壳聚糖的脱乙酰度减小。
2.2 微波加热时间对甲壳素脱乙酰反应的影响
普通微波炉的微波输出功率不会直接变化,只能通过微波发射的通/断转换进行火力调节。本文所使用微波炉的额定输出功率为700 W。固定NaOH溶液浓度为45%,改变对甲壳素和NaOH溶液施加微波的时间(t),测定壳聚糖的脱乙酰度,及其1%醋酸溶液的黏度。考察微波加热时间对甲壳素脱乙酰反应的影响。
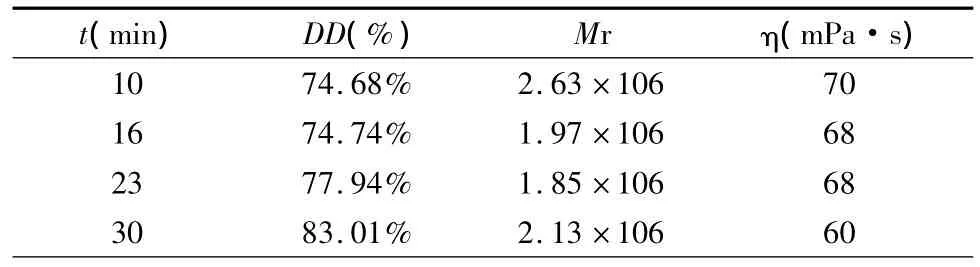
表2 微波加热时间对壳聚糖的脱乙酰度(DD)、粘均分子量(Mr)和溶液黏度(η)的影响
实验表明,随微波加热时间增加,壳聚糖的脱乙酰度增大,而其1%醋酸溶液的黏度略有减小。微波加热的最佳时间为30 min。加热时间继续增加,壳聚糖变黑。加热时间对壳聚糖的粘均分子量影响不大。本文中微波加热的时间比文献中报道的时间长,是因为这里采用间歇加热的方式,控制反应体系的温度低于110℃。
本文所使用的微波炉的工作频率为2.45 GHz,这也是绝大多数微波反应器的工作功率。2.45 GHz(1.6×10-3eV)的微波光子能量不足以断开分子中的共价键,甚至低于布朗运动所需的能量[10]。微波不是通过反应底物或介质直接吸收电磁波能量来诱导化学反应进行。通常认为微波可能通过三种途径影响化学反应速率:单纯的热力学效应、微波介电加热效应和非热微波效应[10,12,16]。对于大多数化学反应来说,温度升高有利于反应进行,反应速率的提高只是单纯的热力学效应。不论是采用微波加热还是传统的加热方法,只要能够达到极高的温度,化学反应都能以相同的反应速率进行,而不存在任何特殊的或非热的效应。微波介电加热的本质仍属于热效应,但是其促进化学转化率的效果是常规加热无法达到或重复的。微波介电加热主要通过“偶极极化作用”和“离子传导作用”实现[10,12]。偶极极化作用,是指具有偶极矩的物质受到微波照射时,物质的偶极在电场作用下进行排列;当电场发生振荡时,偶极场试图在交流电场中进行重排;在这个过程中,由于分子间的摩擦和介电损失,能量以热的形式被消耗。离子传导机理,即反应体系中溶解的带电粒子在微波场中前后振荡,与相邻的分子或原子相互碰撞,碰撞引起搅动或运动,形成了热。反应体系中通过离子传导机理产生的热量要高于通过偶极极化作用产生的热量。在上述情况之外,所有不能用单纯的热力学效应或者特殊微波效应解释的,微波场对化学转化率的提高,称为非热微波效应。关于非热效应存在较大争议。
微波场中,甲壳素脱乙酰反应速度加快,已经不能用单纯的热力学效应来解释。代养勇等人比较了传统的热碱法和微波加热法制备壳聚糖,在反应时间、壳聚糖的得率和品质的区别[20]。结果证明,与传统加热方法相比,微波加热不仅显著缩短反应时间,同时避免了长时间高温处理所导致壳聚糖的分子量和溶液黏度急剧下降,提高了产物的品质。微波场中,甲壳素脱乙酰反应中存在微波介电加热效应。微波对反应体系中的极性水分子发生偶极极化作用,对带正电的Na+离子和带负电的OH-离子发生离子传导作用。NaOH浓度越高,反应体系的温度升高得越迅速。反应体系的温度升高,甲壳素脱乙酰化反应的速度加快。但是反应温度过高,壳聚糖的颜色变黑。施加微波的时间越长,混合物的温度越高,所得壳聚糖的脱乙酰度越大。微波加热的最佳时间为30 min。时间继续增加,壳聚糖变黑。这与文献中的报道一致[17]。
2.3 壳聚糖的红外光谱

图1 固定微波加热时间为30 min,不同浓度NaOH溶液制备的壳聚糖的红外光谱
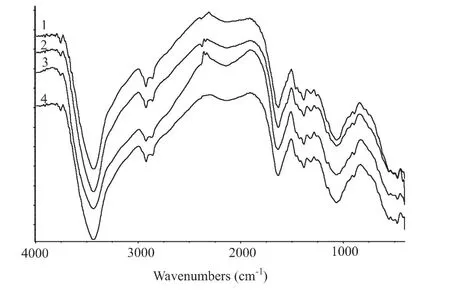
图2 固定NaOH溶液浓度为45%,微波加热时间不同,所得壳聚糖的红外光谱
图1和图2为所得壳聚糖的红外光谱图。在3 430 cm-1左右为一组宽峰,包括了-OH和-NH3的伸缩振动。2930~2 840 cm-1范围内是各种CH、CH2和CH3的伸缩振动的吸收峰。在2 000 cm-1左右的弱的宽峰是空气中CO2的杂质峰。1 650 cm-1左右为C=O双键的吸收峰,即酰胺Ⅰ。在1 550 cm-1附近的酰胺Ⅱ吸收峰较弱,不如1 310 cm-1左右的酰胺Ⅲ吸收峰明显。1 420 cm-1附近为=CH2弯曲和-CH3变形吸收峰。1 380 cm-1附近为CH弯曲和-CH3对称变形吸收峰。1 150 cm-1左右为不对称氧桥伸缩振动。1 063 cm-1左右为C-O伸缩振动吸收峰。890 cm-1左右为β构型壳聚糖的C-H环伸缩振动吸收峰。实验所得壳聚糖的红外光谱图上的各官能团的峰值符合文献中各官能团所属的振动范围[1]。
3 结论
本文采用微波加热,并在敞口容器中进行甲壳素脱乙酰反应。考察了碱溶液的浓度和微波加热时间对壳聚糖脱乙酰度的影响。
首先,固定微波加热时间为30 min,取浓度(CNaOH)分别为40%、45%、50%、55%的 NaOH溶液,与甲壳素混合,制备壳聚糖。随NaOH溶液浓度增加,所得壳聚糖的脱乙酰度先增加,后减小。NaOH溶液浓度为45%时,壳聚糖的脱乙酰度最大。不同浓度NaOH溶液所制得的壳聚糖的粘均分子量相近,其1%醋酸溶液的黏度均为60 mPa·s。由于本文采用未经任何改装的普通微波炉,甲壳素与NaOH浓溶液的混合物中可能存在热量不同的小区域。混合物中热点和冷点之间热量交换效率降低,在冷点的热力学效应不明显。而且随着NaOH溶液浓度升高,黏度增加,NaOH与甲壳素粉末的混合不均匀。因此,对于浓度高于45%的NaOH溶液,随着浓度增加,甲壳素脱乙酰反应的速率整体降低,壳聚糖的脱乙酰度也降低。
第二,固定NaOH溶液浓度为45%,改变微波加热时间,考察微波对甲壳素脱乙酰反应的影响。随微波加热时间增加,所得壳聚糖的脱乙酰度增大,而其1%醋酸溶液的黏度略有减小。微波加热的最佳时间为30 min。加热时间继续增加,壳聚糖变黑。微波加热时间对壳聚糖的粘均分子量影响不大。微波对甲壳素脱乙酰反应的促进作用,是单纯的热力学效应和微波介电加热效应共同作用的结果。
壳聚糖在生产生活中的应用广泛,市场潜力巨大。与热碱降解法和酶解法相比,微波加热法制备壳聚糖不仅反应速度快,产率高,而且成本较低,可以制备粘均分子量较高的壳聚糖。本文为工业化微波法制备壳聚糖工艺进行了初探。
[1]蒋挺大.壳聚糖[M].北京:化学工业出版社,2007:1-67.
[2]Zeng Defang,Wu Juanjuan,Kennedy J F.Application of a Chitosan Flocculant to Water Treatment[J].Carbohydrate Polymers,2008,71:135-139.
[3]车小琼,孙庆申,赵 凯.甲壳素和壳聚糖作为天然生物高分子材料的研究进展[J].高分子通报,2008(2):45-49.
[4]Ravi,Kumar M N V.A Review of Chitin and Chitosan Applications[J].Reactive& Functional Polymers,2000,46:1-27.
[5]王 星,郭建生.甲壳素生物脱乙酰技术研究现状[J].现代纺织技术,2007(2):51-54.
[6]Ge Huacai,Luo Dengke.Preparation of Carboxymethyl Chitosan in Aqueous Solution under Microwave Irradiation[J].Carbohydrate Research,2005,340:1351-1356.
[7]Ge Huacai,Pang Wan,Luo Dengke.Graft Copolymerization of Chitasan with Acrylic Acid under Microwave Irradiation and its Water Absorbency[J].Carbohydrate Research,2006,66:372-378.
[8]Yu Jingang,Huang Kelong,Tang Jinchun,et al.Rapid Microwave Synthesis of Chitosan Modified Carbon Nanotube Composites[J].International Journal of Biological Macromolecules,2009,44:316-319.
[9]Liu Li,Li Yeping,Li Yu,etc.Rapid N-phthaloylation of Chitosan by Microwave Irradiation [J].Carbohydrate Polymers,2004,57:97-100.
[10]Kappe C O,Alexander S.Microwaves in Organic and Medicinal Chemistry[M].Weinheim:WILEY-VCH Verlag GmbH&Co KGaA,2005:1-94.
[11]刘玉婷,周 英,尹大伟,等.微波技术在化学化工上的应用[J].化学世界,2010,8:505-508.
[12]童 星,肖小华,邓建朝,等.低温微波技术在化学研究中的应用[J].化学进展,2010,22(12):2462-2468.
[13]张忠海,李建波,袁伟忠,等.微波技术在生物可降解聚合物合成中的研究进展[J].高分子通报,2010(6):47-52.
[14]祁 强,李 萍,张起凯,等.微波技术的最新应用进展[J].化工科技,2009,17(1):60-65.
[15]李巧霞,宋宝珍,仰振球,等.微波间歇法快速制备高粘均分子量和高脱乙酰度的壳聚糖[J].过程工程学报,2006,6(5):789-793.
[16]张子涛,陈东辉,陈 亮.甲壳素脱乙酰化及其动力学[J].青岛大学学报,2000,15(2):23-26.
[17]刘长霞.甲壳素脱乙酰化反应动力学规律评述[J].沧州师范专科学校学报,2002,3:31-33.
[18]李作为,张立彦,曾庆孝.微波场中甲壳素非均相碱法脱乙酰反应动力学研究[J].广东轻工职业技术学院学报,2006,5(2):5-7.
[19]许惠英,李成平,陈雪松,等.微波技术提取高脱乙酰度高黏度壳聚糖的实验研究[J].浙江化工,2006,37(8):3-5.
[20]代养勇,曹 健,王中太.甲壳素传统法与微波法制备壳聚糖的比较[J].食品工业科技,2006,27(6):54-55.

