2种罗格列酮钠制剂在犬体内的生物等效性研究Δ
胡思星,方大树,张检,李靖柯,周鸿睿,胡湘南(重庆医科大学药学院,重庆市 400016)
2种罗格列酮钠制剂在犬体内的生物等效性研究Δ
胡思星*,方大树,张检,李靖柯,周鸿睿,胡湘南#(重庆医科大学药学院,重庆市 400016)
目的:比较罗格列酮钠肠溶制剂与罗格列酮钠普通制剂在犬体内的药动学特征及其生物等效性。方法:将6只犬均分为2组,分别单次灌服罗格列酮钠肠溶胶囊或罗格列酮钠普通胶囊4mg,于给药前及给药后450min内后腿静脉取血,给药7d后,相同剂量自身交叉给药,于上述相同时间点取血,用高效液相色谱法测定血浆中罗格列酮浓度;经DAS 2.0软件处理,计算药动学参数。结果:在相同剂量下,罗格列酮钠肠溶胶囊与其普通胶囊的药动学参数分别为AUC0~∞:(119.662±8.451)、(118.493±15.325)mg·min·L-1,t1/2Ka:(101.548±6.526)、(39.702±26.293)min,cmax:(0.359±0.035)、(0.807±0.208)mg·L-1;与普通胶囊比较,肠溶胶囊的AUC0~∞无显著性差异,t1/2Ka明显延长、cmax明显降低(P<0.05或P<0.01)。结论:与普通胶囊比较,罗格列酮钠肠溶制剂与其生物等效且具有明显的缓释特征。
罗格列酮钠;肠溶胶囊;普通胶囊;药动学;犬;生物等效性
罗格列酮是噻唑烷二酮类药,其以过氧化物酶——增殖体活化受体γ(PPARγ)为作用靶点的治疗2型糖尿病的新型药物,其通过提高骨骼肌和脂肪对葡萄糖的吸收以及降低肝糖的输出,来发挥胰岛素的敏感作用,达到对糖尿病患者血糖的控制作用[1]。罗格列酮钠片(商品名:太罗)是我国自行研究开发的、国内唯一拥有完全自主知识产权的抗糖尿病新药,其通过放大胰岛素的降糖作用,减少胰岛素抵抗,更好地“复活”自身胰岛素。但罗格列酮钠呈碱性,且其普通片剂或胶囊在胃中崩解后又转变成了罗格列酮或其盐酸盐,并不利于其吸收。为此,重庆医科大学药学院研发了其肠溶胶囊,在本文中,通过以罗格列酮钠的普通胶囊为参比制剂,采用文献[2,3]方法建立血浆中罗格列酮的高效液相色谱分析方法,对犬体内的罗格列酮钠肠溶胶囊的药动学特征和生物利用度进行研究,为进一步完善该剂型以及开发新的药物提供理论依据。
1 仪器与材料
1.1 仪器
1100 型高效液相色谱仪(美国Aglient公司);GL-88B型混匀器(江西医疗器械厂);R200D电子天平(北京塞多利斯天平有限公司);HS-120D超声处理器(上海新芝生物技术研究所);Anke TGL-16G离心机(上海医疗器械厂)。
1.2 试药
罗格列酮钠片(太极集团重庆涪陵制药厂有限公司,批号:66070001,规格:每片4mg);罗格列酮对照品(北京高盟化工有限公司,批号:070911,含量:99.9%);罗格列酮钠普通胶囊(取罗格列酮钠片研碎,以4号空心胶囊以每粒4mg的剂量灌装,打光后即得);罗格列酮钠肠溶胶囊(自制,规格:每粒4mg);乙二胺四乙酸(EDTA)、醋酸钠、冰醋酸(分析纯,重庆川东化工有限公司化学试剂厂);乙腈、甲醇(色谱纯,江苏汉邦有限公司);戊巴比妥钠(分析纯,中国医药集团上海化学试剂公司)。
1.3 动物
家犬6只,♀♂各半,体重8~12kg,月龄10~12个月,由重庆医科大学实验动物中心提供,合格证号:SYXK(渝)2007-0001,实验前2周进入实验室。
2 方法与结果
2.1 色谱条件[4,5]
色谱柱:Lichrospher C18(250mm×4.6mm,5μm);流动相:0.01mol·L-1的醋酸钠缓冲溶液(醋酸调pH为6.0)-甲醇(35∶65);流速:1mL·min-1;柱温:35℃;荧光检测激发波长:250nm ;发射波长:370nm;进样量:100μL。
2.2 溶液的制备
2.2.1 对照品贮备液:精密称取罗格列酮对照品95.58mg,置于100mL容量瓶中,加乙腈超声处理使溶解并稀释至刻度,摇匀。精密量取上述溶液1mL,置于25mL容量瓶中,加乙腈稀释至刻度,摇匀。再精密量取1mL,置于10mL的容量瓶中,加乙腈稀释至刻度,摇匀,得浓度为3.8232μg·mL-1的溶液,即得,贮存于4℃冰箱备用。
2.2.2 标准工作液:精密量取“2.2.1”项下对照品贮备液1mL,加3mL乙腈稀释后,摇匀,得浓度为0.9558μg·mL-1的溶液,贮存于4℃冰箱中备用。
2.3 样品处理
将血浆样品200μL、乙腈400μL,同置于1.5mL具塞离心试管,混匀3min,15000r·min-1离心15min,将上清液转入另一具塞离心试管内,相同条件下再离心5min,取上清液100μL注入液相色谱仪,记录色谱,以外标法进行定量分析。
2.4 含量测定方法学研究
取♂家犬1只,用3%戊巴比妥钠1mL·kg-1麻醉,于后腿静脉取血,每1mL加入50mmol·L-1EDTA 0.1mL抗凝,转入离心管中,3000r·min-1离心5min,取血浆于具塞玻璃试管中,置于-20℃冰箱中备用,即为空白血浆。
2.4.1 专属性考察。精密量取标准工作液0.1mL,加醋酸钠缓冲液0.2mL、乙腈0.3mL,混匀后,精密量取该溶液100μL注入液相色谱仪;取空白血浆0.2mL,加乙腈0.4mL,按“2.3”项下方法处理,取上清液进样;取犬灌服罗格列酮普通胶囊190min后的血浆,处理后进样分析,记录色谱。结果显示,空白血浆在罗格列酮对照品出峰处无色谱峰,血浆样品溶液的主峰出峰时间与对照品一致,说明空白血浆不会干扰罗格列酮血浆样品的测定。高效液相色谱详见图1。

图1 高效液相色谱图A.对照品;B.空白血浆;C.样品血浆;1.罗格列酮Fig1 HPLC chromatogramsA.reference substance;B.blank plasma;C.sample plasma;1.rosiglitazone
2.4.2 标准曲线的制备。精密量取对照品贮备液适量,分别置于0.2mL的空白血浆中,加乙腈稀释,制备成浓度分别为0.01991、0.07965、0.15930、0.47790、0.63720、1.27440、1.91160μg·mL-1的血浆样品,按“2.3”项下方法处理后,进样分析,记录色谱。以浓度(c)为横坐标,峰面积(A)为纵坐标进行回归分析,得回归方程:A=2523.7c+23.391(r=0.99945),结果表明,罗格列酮检测浓度在0.01991~1.91160μg·mL-1范围内呈良好的线性关系。
2.4.3 灵敏度考察。取对照品贮备液适量,分别稀释成不同浓度溶液,加入至空白血浆中,按“2.3”项下方法处理后,进样分析。结果表明,罗格列酮最低检测限(S/N>2)为0.125ng。
2.4.4 回收率与精密度试验。分别取标准工作液适量,置于0.2mL空白血浆中,加乙腈稀释,制备成浓度分别为0.039825、0.1593、0.6372μg·mL-1的样品血浆,然后按“2.3”项下方法处理后,进样分析,以醋酸钠缓冲液稀释的标准工作液为对照,分别计算回收率;另取回收率试验中高、中、低3种溶液各1份,每天进样5次,连续进样5d,同法计算日内和日间精密度,结果见表1。

表1 回收率与精密度试验结果Tab1 Results of recovery and precision tests
2.5 药动学研究
取犬6只,随机分为2组,每组3只,给药前犬禁食12h,用3%戊巴比妥钠1mL·kg-1麻醉,灌胃给予罗格列酮钠肠溶胶囊或罗格列酮钠普通胶囊4mg,于给药前及给药后30、50、80、100、130、150、190、230、270、310、360、400、450min分别从后腿静脉取血,给药7d后,同剂量自身交叉给药,于上述相同时间点取血,加入EDTA抗凝,转入离心管中,3000r·min-1离心5min,取血浆0.5mL于试管中,按“2.3”项下方法处理后,进样分析,记录色谱,计算各时间点血药浓度,采用DAS2.0药动学软件进行自动拟合处理。由于实验过程中有2只犬数据未获得,因此文中只用了4只犬的血药数据进行分析。2种制剂在犬体内的药-时曲线详见图2,药动学参数详见表2。

图22 种制剂在犬体内的药-时曲线Fig2 Plasma concentration-time curves of 2kinds of preparations in dogs
表2 2 种制剂在犬体内的药动学参数(±s,n=4)Tab2 Pharmacokinetic parameters of 2kinds of preparations in dogs(±s,n=4)
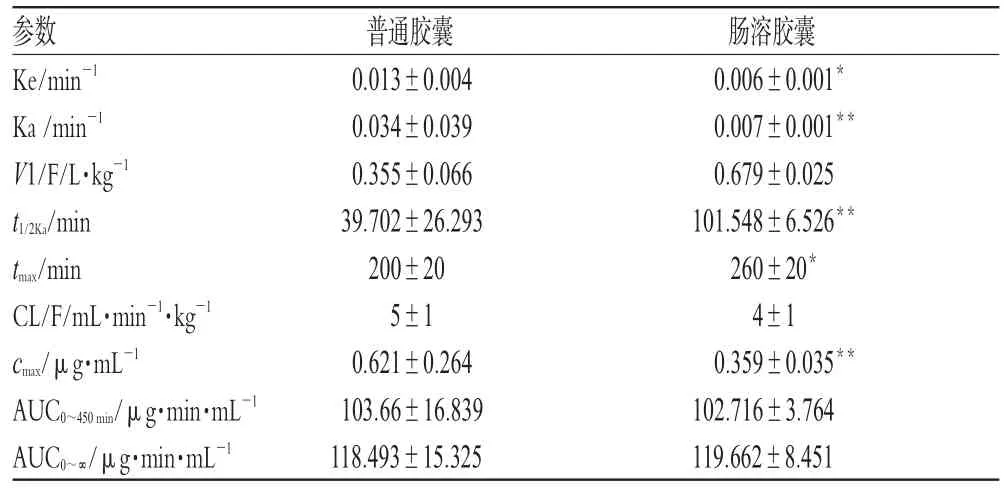
表2 2 种制剂在犬体内的药动学参数(±s,n=4)Tab2 Pharmacokinetic parameters of 2kinds of preparations in dogs(±s,n=4)
与普通胶囊比较:*P<0.05,**P<0.01vs.capsule:*P<0.05,**P<0.01
参数Ke/min-1 Ka/min-1 V1/F/L·kg-1 t1/2Ka/min tmax/min CL/F/mL·min-1·kg-1 cmax/μg·mL-1 AUC0~450min/μg·min·mL-1 AUC0~∞/μg·min·mL-1普通胶囊0.013±0.0040.034±0.0390.355±0.06639.702±26.293200±205±10.621±0.264103.66±16.839118.493±15.325肠溶胶囊0.006±0.001*0.007±0.001**0.679±0.025101.548±6.526**260±20*4±10.359±0.035**102.716±3.764119.662±8.451
由表2可见,与普通胶囊比较,肠溶胶囊的Ka、Ke、cmax明显降低,t1/2Ka、tmax明显延长(P<0.05或P<0.01),AUC0~450min、AUC0~∞无显著性差异。
2.6 生物等效性分析
在相同剂量下,与普通胶囊 AUC0~450min、AUC0~∞比较,肠溶胶囊的相对生物利用度为(90.4±8.4)%和(100.9±14.4)%,通过三因素方差分析(周期、制剂、个体),结果显示,在制剂间、周期间无明显差异,而个体间存在差异,这可能是由于个体差异或操作误差造成。并在此基础上对AUC0~450min进行双单侧检验,结果表明,肠溶胶囊与普通胶囊AUC0~∞的比值90%置信区间为83.3%~97.5%,在80%~125%内,各参数与等效性检验的低限及高限比较以及群体等效性(PBE)分析显示均合格,说明了2种制剂具有生物等效性。
3 讨论
有研究[2]表明,麻醉药戊巴比妥钠对罗格列酮药动学没有影响。在本次研究中,将罗格列酮钠的普通制剂改成肠溶制剂后,可以减少其碱性钠盐对胃黏膜的刺激以及胃环境的破坏,同时,也避免了罗格列酮钠转变成罗格列酮或其盐酸盐,有利于药物的吸收[6~9]。从实验结果可推知,罗格列酮钠的肠溶制剂有明显的缓释特征,在一定程度上避免了血药浓度的峰值和谷值,延长了药物作用时间,使血药浓度更加平稳,也减少血药浓度的峰值可能带来的噻唑烷二酮类药物的相关副作用,提高了患者的顺应性,适合长期服用。本文可在某种程度上给临床合理用药提供一定的指导,但动物和人体对该制剂的吸收可能存在差异,因此,还需要对该制剂进行更深入的考察和研究。
[1] Moore GB,Chapman H,Holder JC,et al.Differential regulation of adipocytokine mRNAs by rosiglitazone in db/db mice[J].Biochem Biophys Res Commun,2001,286(4):735.
[2] 杨俊卿,邱红梅,尚京川,等.依替膦酸罗格列酮与马来酸罗格列酮的生物等效性研究[J].第三军医大学学报,2006,28(23):2343.
[3] 张云美,潘永全,杨俊卿,等.HPLC法测定犬体内罗格列酮药物动力学参数[J].四川动物,2005,24(1):90.
[4] 甘勇军,吴禄春,方大树,等.罗格列酮钠肠溶片的制备及质量控制[J].中国药房,2009,20(10):773.
[5] Kim KA,Park JY.Simple and extractionless high-peformance liquid chromatographic determination of rosiglitazone in human plasma and application to pharmacokinetics in humans[J].Biomedical Chromatography,2004,18(8):613.
[6] 胡湘南,甘勇军,吴禄春,等.噻唑烷二酮金属盐类药物肠溶制剂及其制备方法[P].中国专利:CN101327198,2008-12-24.
[7] 方大树,胡思星,张 检,等.罗格列酮油水分配系数的测定[J].中国药房,2010,21(5):409.
[8] 甘勇军,吴禄春,方大树,等.罗格列酮钠肠溶片的体外释放度研究[J].中国医院药学杂志,2009,29(14):1159.
[9] 吴禄春,甘勇军,方大树,等.利用紫外分光光度法测定罗格列酮游离碱的pKa值[J].重庆医科大学学报,2009,34(11):1546.
Bioequivalence of 2Kinds of Rosiglitazone Sodium Preparations in Dogs
HU Si-xing,FANG Da-shu,ZHANG Jian,LI Jing-ke,ZHOU Hong-rui,HU Xiang-nan
(School of Pharmacy,Chongqing Medical University,Chongqing 400016,China)
OBJECTIVE:To compare pharmacokinetic characteristics and bioequivalence of Rosiglitazone sodium enteric-release capsule and Rosiglitazone sodium capsule in dogs.METHODS:6dogs were divided into two groups.Both groups were given Rosiglitazone sodium enteric-release capsule or Rosiglitazone sodium capsule 4mg respectively in randomized cross-over study.Blood samples of hind legs vein were collected before administration and within 450min after administration.The plasma concentration of rosiglitazone was measured by HPLC.The pharmacokinetic parameters of rosiglitazone were calculated using DAS 2.0software.RESULTS:The pharmacokinetic parameters of same dosage of Rosiglitazone sodium enteric-release capsules vs.Rosiglitazone sodium capsules were as follows:AUC0~∞:(119.662±8.451)mg·min·L-1vs.(118.493±15.325)mg·min·L-1;t1/2Ka:(101.548±6.526)min vs.(39.702±26.293)min;cmax:(0.359±0.035)mg·L-1vs.(0.807±0.208)mg·L-1.Compared with normal capsule,AUC0~∞of enteric-release capsule had no significant difference,t1/2Kaextended andcmaxdecreased significantly(P<0.05orP<0.01).CONCLUSION:Rosiglitazone sodium enteric-release capsules and common capsule are bioequivalente and characterized with sustained-release profile.
Rosiglitazone sodium;Enteric-release capsule;Common capsule;Pharmacokinetics;Dog;Bioequivalence
R969;R587.1
A
1001-0408(2011)17-1556-03
Δ重庆自然科学基金项目(2006BB5286)
*硕士研究生。研究方向:药物化学。E-mail:husixing051@163.com
#通讯作者:副教授。研究方向:药物化学。电话:023-66729212。E-mail:huxiangnan@yahoo.com.cn
2011-01-13
2011-02-25)

