白纹伊蚊基因表达定量PCR内参基因的选择*
吴家红,程金芝,孙 宇,陈 璐
随着多个物种基因组全序列的揭晓,定量研究基因表达水平在生命科学领域已益显重要。实时荧光定量RT-PCR技术(real-time quantitative PCR,qPCR),作为一种高效的定量 PCR技术,可以实时监测某个基因在不同细胞、组织、个体以及发育不同阶段或者是某种特殊处理条件下的表达水平。因此,当前已广泛用于基因芯片数据的验证,RNA干扰后基因表达差异的验证,以及疾病的诊断等。然而,为了获得真实可靠的实验结果,在此过程中通常需要采用内参基因对数据进行校正和标准化,以消除不同样品在RNA产量、质量以及反转录效率上可能存在的差别。理想的内参基因应该是在所有细胞、不同发育阶段以及不同处理因素下其表达水平均不受影响。然而稳定表达的基因几乎是不存在的,因此利用单一看家基因用于标化,可能造成与实际表达水平相差几十倍以上的差异[1]。为解决这一问题,事先检测看家基因的稳定性,以及需要几个看家基因同时作为内参,就需要在实验设计时考虑周全。
当前,国内尚未见蚊虫基因表达定量PCR分析内参基因筛选的相关报告。为此,本研究选择白纹伊蚊β-actin、rspL40、BTF3a、rsp5、rsp27a、superoxide等6个看家基因,对其作为内参基因的效应进行检测,为后续qPCR最适内参基因的选择奠定基础。
1 材料与方法
1.1 实验材料 白纹伊蚊广州株,引自军事医学科学院微生物流行病研究所媒介生物学与控制研究室,由本室常规养殖,温度(25±2)℃,相对湿度(80±5)%,光照14 h/d,羽化后喂食糖水。实验共分6组:解剖5d龄未吸血雌蚊(SG组)、饥饿12h雌蚊(吸血含前先饥饿12h,JSG组)、饱血雌蚊(吸血2 h,腹部饱胀者;BSG0组)和饱血24h雌蚊(BSG24)的唾液腺。收集去头、去唾液腺后剩余的雌蚊(C组),羽化后5d龄的去头雄蚊(有唾液腺,M组),以及去头雌蚊(含唾液腺,F组),其中F组用于扩增效率分析。-80℃保存备用。
1.2 主要试剂 Trizol试剂购自美国 Invitrogen公司;逆转录试剂盒(PrimeScript TM RT reagent Kit)和荧光定量 PCR试剂盒(SYBRTMPremix Ex TaqTM)购自日本 TaKaRa公司;DNA酶 I试剂盒(Deoxyribonuclease I,Amplification Grade)购自美国Invitrogen公司;其他试剂均为国产分析纯产品。荧光定量PCR仪(ABI 7300型)为美国ABI公司产品。
1.3 引物的设计及合成 参考 GenBank中白纹伊蚊相应基因的核苷酸序列,采用ABI公司Prim 3.0软件设计引物,大连 TaKaRa公司合成,具体见表1。其中rsp5设计了两对引物。

表1 侯选基因的克隆参数Table 1 Cloning parameters for candidate reference genes
1.4 实时RT-PCR
1.4.1 RNA抽提 将7组样品分别加入Trizol试剂,按照试剂操作说明进行总 RNA提取。通过1.2%琼脂糖凝胶电泳和紫外分光光度计检测所得总RNA的质量和浓度。
1.4.2 DNA去除 按照DNA酶I试剂盒的说明进行。去除DNA后的总RNA直接用于反转录。
1.4.2 逆转录反应:按照逆转录试剂盒的说明操作。反应体系为:总 RNA 500 ng,5×PrimeScript缓冲液2μL,PrimeScript酶混合物0.5μL,寡核苷酸多聚 T引物(Oligo dT)和随机6碱基引物(Random 6 mers)引物各 0.5μL,加无 RNA酶水(RNase Free dH2O)至总体积为10μL。反应条件:37℃30 min,85℃5 s。-20℃保存备用。每组3个样品。
1.4.3 扩增效率分析 利用F组cDNA为模板,进行10倍稀释,共设5个实验浓度;分别对6个基因进行荧光定量 PCR,构建标准曲线,计算扩增效率和 R2。
1.4.4 PCR片段序列分析 将PCR扩增产物进行亚克隆,送 TaKaRa公司测序,并用DNAstar5.0进行序列分析。
1.4.5 荧光定量 PCR 取上述5ng逆转录产物(cDNA)进行PCR,按照荧光定量PCR试剂盒的说明书进行,每个样品重复3次,每组做3个重复。反应体系为:2×SYBR○RPremix Ex TaqTM 10μL,10 μmol/L上、下游引物各0.8μL,50倍 ROX参考染料(50×ROX Reference Dye)0.4μL,cDNA模板5ng,加无 RNA酶的水(RNase Free dH2O)至 20 μL。反应条件:95℃30 s;95℃5 s,60℃34 s,共40个循环。反应结束后确认real-time PCR反应的扩增曲线和熔解曲线。
1.4.6 数据处理和分析 数据分析采用Microsoft Office Excel 2003和 geNorm程序进行。从 http://medgen.ugent.be/~jvdesomp/genorm/网址下载geNorm程序在Excel中将不同样本中某一内参基因Ct值最小者对应样品的表达量定义为1,其他样品此内参基因的相对表达量则为2-ΔCt(ΔCt=各样本Ct值-最小Ct值)将这些数据导入geNorm程序在进行数据格式转换后通过Change Data命令利用geNorm程序计算基因表达稳定度M值,对内参基因的表达稳定度进行排序(M值越小则表达越稳定),最后根据内参基因标准化因子的配对差异分析(Vn/n+1)判定内参基因的最适数目。
2 结 果
2.1 内参基因的选择 根据文献调研及 GenBank上已知序列信息,本研究筛选6个功能不同的常用看家基因作为侯选基因。利用ABI公司Prim 3.0软件,设计荧光定量PCR引物对并进行检测。PCR扩增产物经测序均与目标序列100%一致性,表明6个基因引物设计的特异性好;采用10倍稀释,构建6个基因的标准曲线,PCR扩增效率和R2值见表1。PCR扩增效率显示,有5个基因 PCR扩增效率在96%~112%之间,而 rsp27a基因扩增效率在141%;6个基因的R2值均在98%以上,说明标准曲线线性关系很好,因此弃rsp27a基因,余5个基因进行后续实验。
2.2 内参基因表达的稳定性分析
2.2.1 白纹伊蚊不同组织中内参基因表达稳定性geNorm 软件分析显示 ,β-actin、BTF3a、rsp5-1、rsp5-2、superoxide、rspL40 在雌蚊唾液腺、无唾液腺雌蚊组织及雄蚊组织中,表达稳定度M的平均值分别是0.66,0.25,0.58,0.54,0.94,0.25;表达稳定度由高到低依次排序为:rspL40,BTF3a>rsp5-2>rsp5-1>β-actin>superoxide;见图 1geNorm 软件以0.15为默认取舍值,即当Vn/n+1<0.15时,说明没有必要选择使用数量大于n+1的看家基因作为内参。本研究结果显示V2/3=0.226,而V3/4=0.146,提示最适内参基因数目为3(图2)。因此可选用的内参基因有:BTF3a,rspL40,rsp5。
2.2.2 白纹伊蚊唾液腺组织吸血不同时相内参基因表达稳定性分析 geNorm软件分析显示,白纹伊蚊唾液腺组织在吸血不同时相,β-actin、BTF3a、rsp5-1、rsp5-2、superoxide、rspL40 表达稳定度 M的平均值分别是 0.46,0.38,0.25,0.24,0.28,0.24;表达稳定度由高到低依次排序为:rspL40,rsp5-2>rsp5-1>superoxide>BTF3a>β-actin(图 3);说明rspL40和rsp5表达最稳定。geNorm软件以0.15为默认取舍值,即当Vn/n+1<0.15时,说明没有必要选择使用数量大于n+1的看家基因作为内参。本研究中Vn/n+1均<0.15,说明使用一种内参基因,rspL40或rsp5即可(图4)。
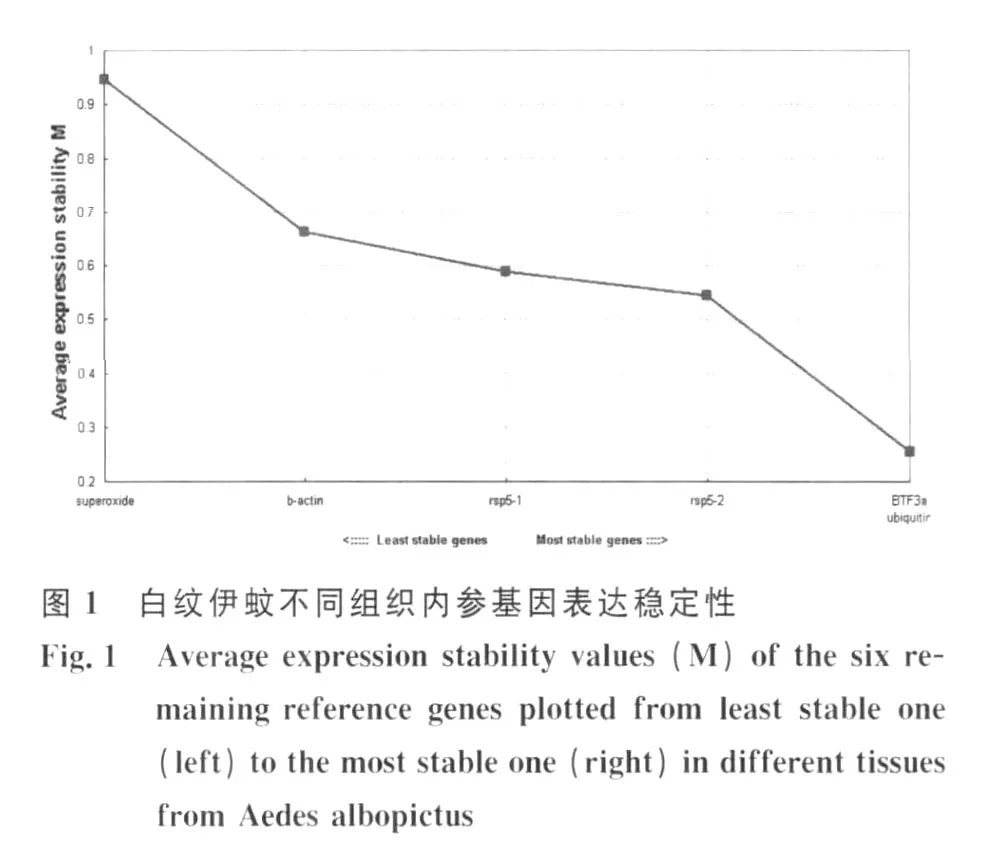
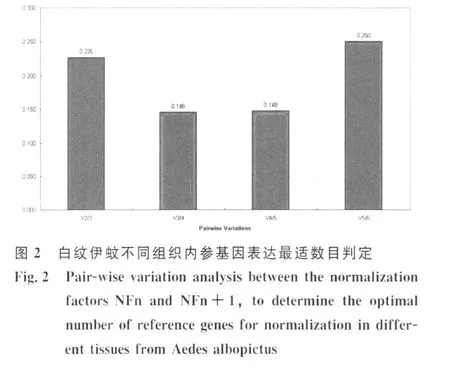
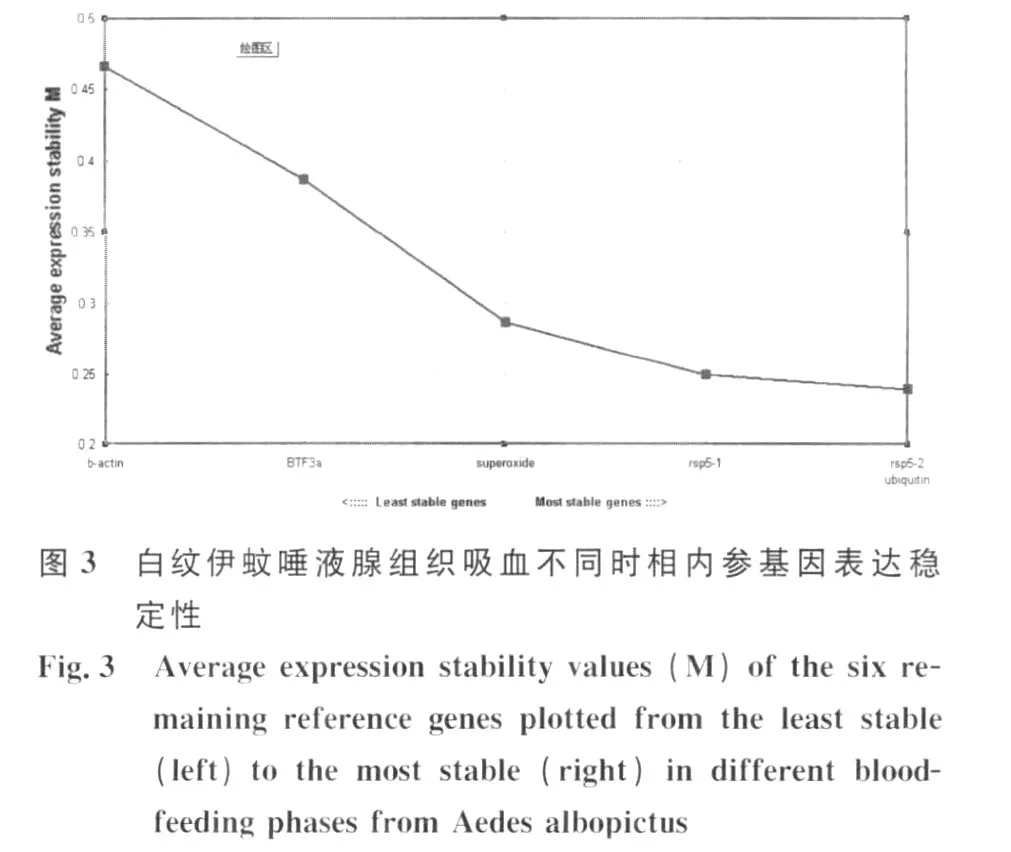
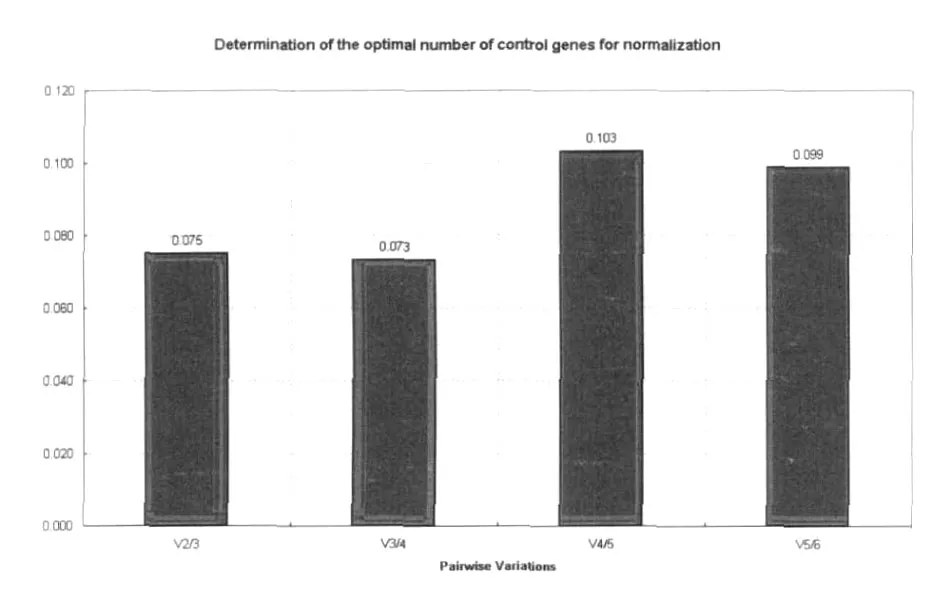
图4 白纹伊蚊唾液腺组织吸血不同时相内参基因最适数目判定Fig.4 Pair-wise variation analysis between the normalization factors NFn and NFn+1,to determine the optimal number of reference genes for normalization in different blood-feeding phases from Aedes albopictus
3 讨 论
近年来,随着qPCR和基因芯片的广泛使用,关于在不同物种和不同组织内参基因的选择已见很多报道[2-3]。当前,与蚊虫相关的标化基因常见的有:β-actin,核糖体 RNA基因等;本研究根据文献调研,选择了6个功能不同的看家基因,对其在白纹伊蚊不同组织及吸血不同时相时唾液腺组织中的表达差异进行了探讨。其中rsp5有文献报道用作半定量PCR的内参基因[4],因此,设计引物时设计了两对引物,以确认不同引物对对基因表达稳定度的影响。为了确定稳定表达的基因,在样品的准备时严格按照时间点取样,保证唾液腺解剖时完整;总RNA制备、定量都采用同一方法和同一机器进行。相同量的RNA在同一条件下进行逆转录。以尽可能减少逆转录及 PCR中的实验误差。最后采用geNorm软件对研究结果进行进一步分析。
geNorm是Vandesompele等[5]于2002年编写的一款用于微软Excel平台的VBA宏程序,主用于侯选看家基因稳定度排序及找出合适看家基因。因该程序免费,可直接从网上下载,因此是目前常用于侯选看家基因筛选常用程序之一。geNorm软件分析显示,在白纹伊蚊不同组织中基因表达最稳定的基因是rspL40,BTF3a,其次是 rsp5。然而最适内参基因数目变异度显示 V2/3=0.226,而V3/4=0.146<0.15,提示单纯用一个内参基因作标化,对于标化不同组织中的差异表达并不是适合的,最适内参基因选择的数目应该是3个,因此可选择的基因就是rspL40,BTF3a,rsp5。而在吸血不同时相唾液腺组织基因表达最稳定表达基因是rspL40,rsp5;其次是superoxide。最适内参基因数目变异度V2/3=0.075<0.15,提示其最适的内参基因数目是1或者2个。因此,在研究吸血不同时相唾液腺组织基因表达差异时,可选择rspL40和rsp5作为内参基因。而β-actin基因无论是在不同组织中的差异表达还是吸血不同时相的差异表达均不适于作内参基因。
rsp5基因设计两对引物,两对引物扩增的PCR效率及R2值均相差不大,说明引物设计好。而且geNorm软件分析结果也显示该两对引物的 PCR扩增后表达稳定性基本一致。因此,认为同一基因,不同引物对对基因表达稳定性影响不大。此外,本研究结果还显示不同的处理因素、不同组织基因表达的稳定性是不一致的。因此,在进行标化基因选择时,应进行仔细的分析和确证。
[1]张艳君,朱志峰,陆融,等.基因表达转录分析中内参基因的选择[J].生物化学与生物物理进展,2007,34(5):546-550.
[2]Hiel MBV,Wielendaele PV,Temmerman L,et al.Identification and validation of housekeeping genes in brains of the desert locust Schistocerca gregaria under different developmental conditions[J].BMC Molec Bio,2009,10:56 doi:10.1186/1471-2199-10-56.
[3]Scharlaken B,de Graarf DC,Goossens K,et al.Reference gene selection for insect expression studies using quantitative real-time PCR:The head of the honeybee,Apis melliferia,after a bacterial challenge[J].Jonline Insect Sci.2008,8:33.Available online:insectscience.org/8.33.
[4]Arca B,Lombardo F,Francischetti IMB,et al.An insight into the sialome of the adult female mosqutitoAedes albopictus[J].Insect Biochem Molec Biol,2007,37:107-127.
[5]Vandesompele J,De Preter K,Pattyn F,et al.Accurate normalizaition of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biol,2002,3(7):1-11.

