激肽释放酶基因过表达对5/6肾切除大鼠肾脏细胞凋亡和炎症的影响和机制*
赵 刚 高 静 郑晓菲 冯文静 赵俊杰 汪培华 凃 玲
(1.华中科技大学同济医学院附属同济医院,湖北 武汉 430030;2.泰山医学院附属泰山医院,山东 泰安 271000)
肾纤维化包括肾小球硬化、肾小管和间质纤维化,是各种肾脏疾病进展到慢性肾衰竭的共同途径和主要病理基础[1-2]。肾间质纤维化涉及到肾小管上皮细胞(tubules cellula epithelialis,TEC)及间质的损伤,肌成纤维细胞增殖、细胞外基质(extracellular matrix, ECM)的增多和降解减少等一系列过程。近年研究表明,5/6肾切除手术诱导显著的肾脏纤维化,且肾脏细胞凋亡和炎症细胞浸润在其中发挥重要作用[3]。
激肽释放酶——激肽系统(KKS)与RAS相互作用调节血压,调节一氧化氮和前列腺素的产生以及血管加压素的释放,维持钠、水平衡等[4-5]。近年研究[1,6]证实人组织型激肽释放酶基因(human tissue kallirein, HK)过表达在多种肾脏疾病模型中发挥肾保护作用。其中,腺相关病毒介导HK过表达显著减轻了5/6肾切除大鼠的肾间质纤维化,且此肾脏保护作用与TGF-β/smads和p38MAPK通路密切相关[7]。但是, HK过表达是否可以减轻5/6肾切除大鼠肾脏细胞凋亡和炎症细胞浸润,目前还未见报道。本实验通过检测凋亡和炎症相关通路的靶点蛋白表达及HK过表达对其的影响,初步探讨腺相关病毒介导的HK过表达对5/6肾切除大鼠肾脏细胞凋亡和炎症细胞浸润的影响机制。
1 材料和方法
Wistar大鼠购自华中科技大学同济医学院实验动物中心,辣根过氧化酶偶联羊抗兔IgG抗体(Jackson 公司),SP试剂盒及DAB显色试剂盒(北京中山公司),原位细胞凋亡检测盒购自罗氏公司(Roche,Cat.No.1684817),蛋白质杂交膜(PVDF膜)购自Schleicher and Schuell公司,化学发光试剂ECL购自PIERCE公司,抗HK、β-actin 、Bcl-2、Bcl-xl、Bax 、VCAM-1和MCP-1抗体购自Santa Cruz 公司。HK重组腺相关病毒包装和滴度测定参照文献进行[8]。
1.2实验模型及动物分组
雄性Wistar大鼠32只, 8周龄,体重(200±20)g。适应性喂养1周,随机分为4组:假手术组(sham组)8只、手术组(operation组)8只,手术+绿色荧光蛋白组(GFP组)8只和手术+HK组(HK组)8只。尾静脉注射病毒后3周(剂量:1×1011pfU溶在1 ml磷酸盐缓冲液中),手术按照Hinojosa-Laborde的方法构建5/6肾切除大鼠模型[9-10]。实验结束后处死动物。肾脏取同一部位横断面,部分用福尔马林固定后石蜡包埋,拟形态学染色,其余标本液氮速冻后置于-80 ℃冰箱保存备用。
1.3组织病理学观察
各组大鼠肾脏用福尔马林固定后,石蜡包埋并制成4 μm的切片,行HE染色检测肾组织结构变化和Masson染色(胶原纤维呈蓝色,肌纤维、胞质呈红色,胞核呈蓝褐红色,红细胞呈橙红色)检测胶原沉积。HE染色和Masson染色方法参照文献[1]。根据Masson染色结果,每组取多个视野作综合分析,得出蓝色面积(Masson阳性面积)占总面积的百分比。应用病理图像采集和分析系统软件(HMIAS2000型),在高倍镜下(×200)对每个标本随机选择8~10个含血管比较少的视野,统计并行半定量分析。
1.4TUNEL 染色法检测大鼠肾脏细胞凋亡
案例教学法在实际应用中仍然存在若干问题,因此对于“会计学基础”课程的教学,完善案例教学法,其根本目的在于提高教学质量,更好地达到教学目标。因此,在运用过程中要求教师在选取案例时注意选取兼具针对性与可分析性案例,所选案例应符合时代背景,贴近现实经济生活,同时建立高水准的专业课程案例库,定期或不定期进行案例更新。除此之外,与传统“灌输式”教学方法相比,虽然教师仍然是课堂教学的核心,但教师需要扮演的角色更为复杂,因此对教师综合素质的要求也更高。教师在具备扎实专业功底的同时,也应具备充分的信息加工与分析能力,同时具有能够引导与激发学生主动思考的能力,合理将理论教学与实践教学相结合。
TUNEL 染色采用原位细胞凋亡检测盒,具体步骤参照试剂盒说明。主要步骤如下:切片脱蜡入水,抗原修复后血清封闭非特异性反应,滴加反应液5O μl(TdT 5μl,荧光素连接的核苷酸混合缓冲液45 μl),37℃湿盒内孵育1 h。PBS (pH7.4)冲洗5 min×3次, 0.3 % H2O2,孵育以阻断内源性过氧化物酶,窒温下PBS冲洗5 min×3次,再次37℃封闭15 min。切片滴加l︰2稀释的POD(HRP连结的抗荧光素抗体)20 μl,置湿盒内,37℃孵育30 min,窒温磷酸盐缓冲液洗5 min×3次。镜下,DAB-H2O2显色,胞核呈深棕色即用自来水流水冲洗终断反应,苏木精复染,梯度酒精脱水,二甲苯透明,树胶封片。未凋亡细胞的胞核染成蓝色,凋亡细胞的细胞核呈棕黄色(tunnel 阳性),染色质凝聚、浓缩。随机选取共5个非重叠200倍镜视野,计数凋亡细胞数和总细胞数,细胞凋亡率=凋亡细胞数/细胞总数×100% 。
1.5肾脏组织Caspase-3 活性测定
新鲜肾脏组织100 mg,匀浆、离心,测定并调整蛋白浓度,取上清样本蛋白0.5 ml, 加入Caspase-3 检测试剂盒(购自Clontech公司) 中的DTT 和2×反应缓冲液的混合液( 1 mol/L DTT 10 μl, 2×反应缓冲液1 ml) 50 μl, 再加1 mmol Caspase-3底物DEVD-AFC 5 μl, 37℃孵育60 min,以激发光波长400 nm, 发射光波长505 nm 测定Caspase-3 孵育前后荧光单位。按照试剂盒说明统计数据并分析。
1.6Western blot法检测HK、Bcl-2、Bcl-xl、Bax 、VCAM-1和MCP-1蛋白表达
提取组织蛋白质并测定蛋白质溶液浓度:配制组织裂解液,剪碎组织后机械匀浆,4℃低温10000 r/ min离心10 min,留取上清,即为组织蛋白质溶液。用Bradford方法测定蛋白质浓度[10]。Western blot方法同我们的文献报道[11]。用IBAS 图像处理系统对胶片进行扫描并测定感光区带的感光密度,积分处理相对吸光度值(IOD),每组实验均重复3次。
1.7统计方法
2 结 果
2.1尾静脉注射rAAV-HK病毒诱导大鼠肾脏组织HK的长期稳定高表达
手术后第12周,处死大鼠,提取新鲜肾脏标本蛋白质做Western blot检测HK表达,结果显示尾静脉注射rAAV-HK病毒成功诱导大鼠肾脏组织HK的长期稳定高表达,代表性图片见图1,经密度灰度分析扫描分析(表1),差异有统计学意义(P<0.05)。

图1 Western blot检测大鼠肾脏HK蛋白表达
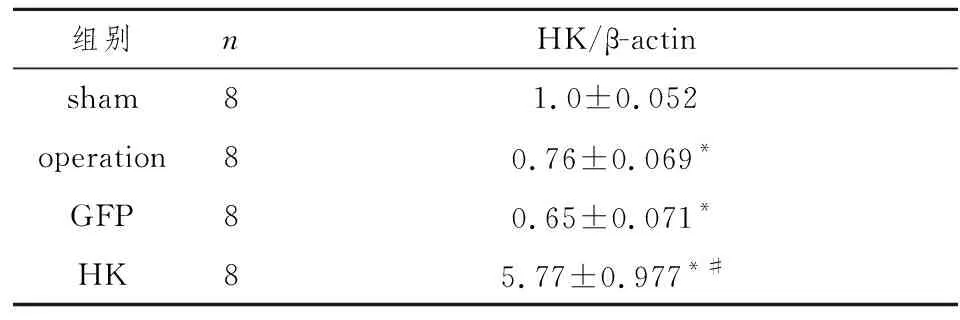
组别nHK/β-actinsham81.0±0.052operation80.76±0.069*GFP80.65±0.071*HK85.77±0.977*#
注: 与sham组比较,*P<0.05;与operation组和GFP组比较,#P<0.05。
2.2HK基因过表达明显减轻了5/6肾切除大鼠肾脏组织结构破坏和胶原沉积
HE染色结果表明5/6肾切除术导致肾组织出现明显形态学改变:肾小球萎缩和代偿性肥大同时存在,球囊明显增厚,系膜增生,刷状缘消失,肾小管显著扩张和管型形成,肾间质大量基质沉积和广泛的纤维组织增生。然而HK基因过表达显著减轻了上述变化,抑制了肾脏结构破坏,见图1。Masson染色结果显示,HK基因过表达显著减轻了5/6肾切除术所致的肾间质胶原沉积,见图1。定量分析蓝色面积(Masson阳性面积)占总面积的百分比,与手术组和GFP组相比,HK基因过表达明显降低了蓝色胶原纤维所占面积百分比(表2)。
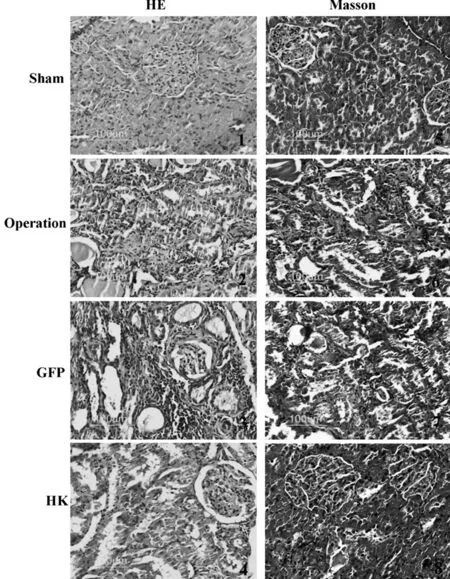
图2 HE染色和Masson染色结果(×200)

组别nMasson阳性面积/总面积(%)sham85.6±1.05operation861.3±5.3*GFP859.1±4.45*HK829.4±2.5*#
注:与sham组比较,*P<0.05;与operation 和GFP组比较,#P<0.05。
2.3肾组织细胞凋亡检测
2.3.1Tunel法检测肾组织细胞凋亡 假手术组胞核染成棕黄色细胞很少,但手术组和GFP组的肾组织可见大量tunel阳性细胞,主要位于萎缩和扩张的肾小管,肾小球内亦有大量表达凋亡细胞。HK基因过表达明显减少了凋亡细胞的数量(图3)。每组取多个视野作综合分析,HK组tunel阳性细胞比例显著低于手术组和GFP组(表3)。
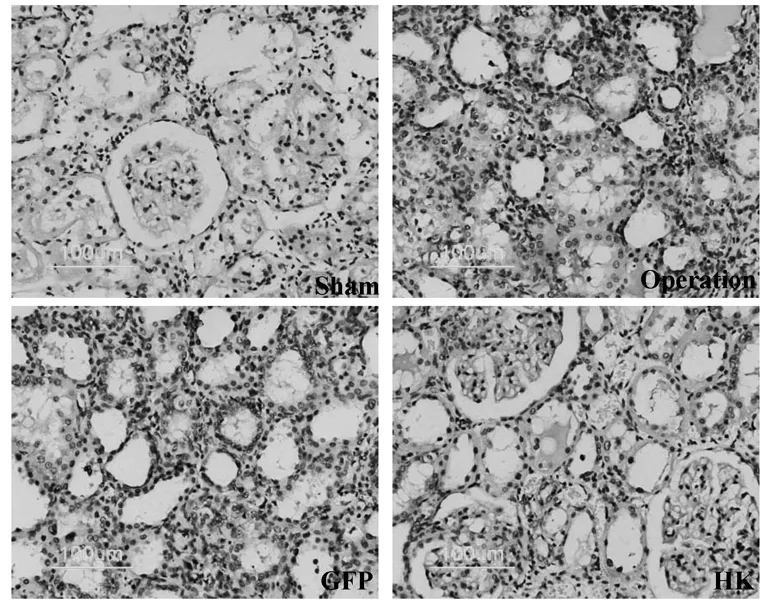
图3 Tunel法检测凋亡细胞(×200)

组别ntunel阳性细胞/总细胞(%)sham85.51±1.11operation836.03±4.01*GFP834.7±3.02*HK813.5±2.05*#
注:与sham组比较,*P<0.05;与operation和GFP组比较,#P<0.05。
2.3.2肾组织Caspase-3活性检测 手术明显提高了肾脏组织中Caspase-3活性,但是HK基因过表达明显抑制了Caspase-3活性的升高。定量分析结果显示(表4),HK组Caspase-3相对活性明显低于手术组和GFP组。

表4 各组大鼠肾脏Caspase-3活性数据分析
注:与sham组比较,*P<0.05;与operation和GFP组比较,#P<0.05。
2.4Western blot方法检测凋亡和炎症相关蛋白表达水平
2.4.1Western blot 方法检测凋亡相关蛋白表达 HK组大鼠促凋亡蛋白Bax表达较假手术组明显升高,但明显低于手术组和GFP组,并且HK过表达显著抑制了手术所致的凋亡抑制蛋白Bcl-2和Bcl-xl的表达降低,代表性的Western blot条带见图4,经密度灰度分析扫描分析(表5),差异有统计学意义 (P<0.05)。
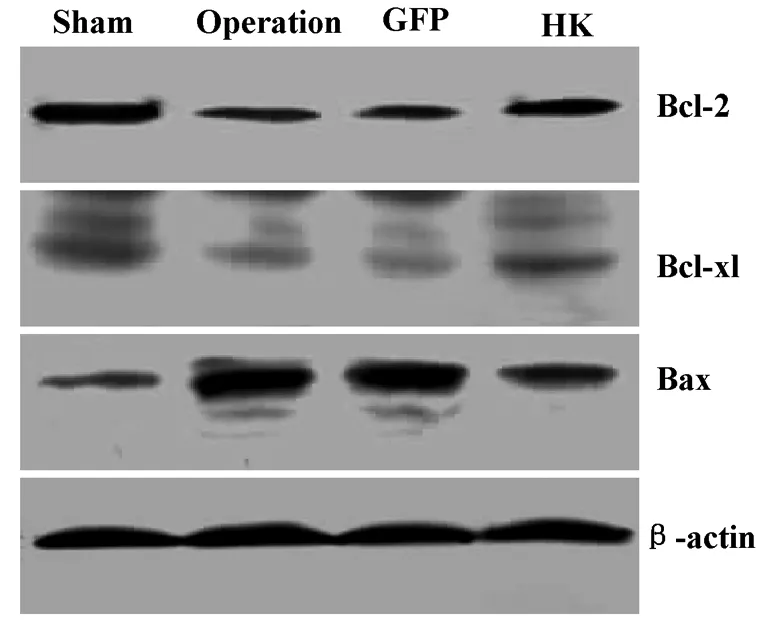
图4 Bax、Bcl-2和Bcl-xl表达的条带
2.4.2Western blot 方法检测炎症相关蛋白表达水平 HK组大鼠肾脏组织VCAM-1和MCP-1表达较假手术组明显升高,但与手术组和GFP组相比表达量明显降低,代表性Western blot图片见图5,经密度灰度分析扫描分析(表6),差异有统计学意义 (P<0.05)。
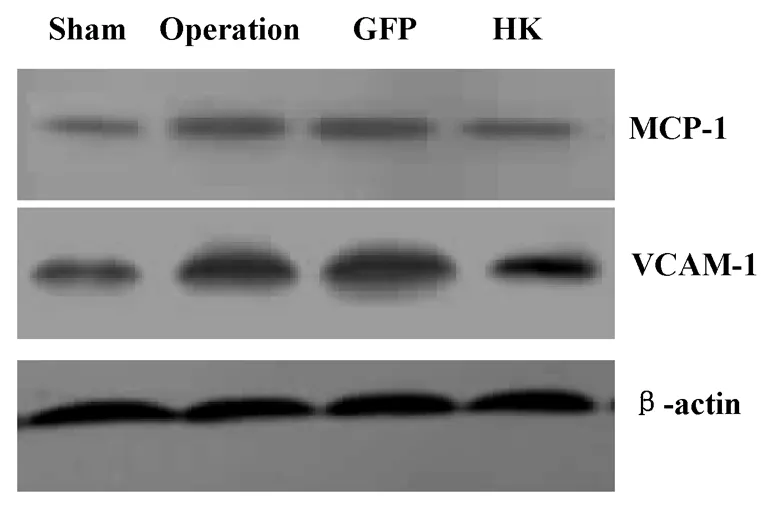
图5 VCAM-1和MCP-1表达的条带

组别nMCP-1/β-actinVCAM-1/β-actinsham81.0±0.0321.0±0.041operation81.45±0.0611.67±0.073*GFP81.454±0.0681.69±0.058*HK81.27±0.0591.425±0.067*#
注:与sham组比较,*P<0.05;与operation和GFP组比较,#P<0.05。
3 讨 论
肾间质纤维化是慢性肾功能衰竭的病理学基础,大量研究[10,12]证实在5/6肾切除大鼠肾脏纤维化的过程中,肾脏细胞凋亡和局部炎症细胞大量浸润发挥着关键作用。
HK是一种丝氨酸蛋白酶,在多种组织中有丰富表达,特别是肾脏中表达丰富。HK裂解低分子量激肽原生成缓激肽(BK)[1,13]。BK是体内较强的内源性舒张血管的物质之一,其通过与靶细胞上的Ⅱ型BK受体(BKR2)结合而发挥生物学效应,降低多种动物模型的血压,增加局部血流和血管通透性,具有显著的扩张血管和血管保护作用。HK过表达可以显著抑制心脏重构,减轻大脑中动脉狭窄而减少脑卒中发生,改善血脂代谢而抑制动脉粥样硬化发生等[14-15]。
HK在肾脏中通过TGF-β/smads和MAPK途径显著抑制了5/6肾切除大鼠的肾脏纤维化[1]。Chao J等人[13]证实HK显著抑制慢性血管紧张素Ⅱ皮下输注和高盐饮食诱导的肾脏损伤,其机制主要是通过抑制炎症和氧化应激。在细胞水平,BK明显抑制肾小管上皮细胞向间充质细胞的转分化(TEMT),TEMT是肾脏纤维化发生早期重要的标志[1]。5/6肾切除可诱导大鼠慢性肾功能损伤,其主要表现是肾间质的大量胶原沉积,肾小球硬化和萎缩,肾脏细胞凋亡和炎症细胞浸润等。Ling Tu等[1]已经证实重组腺相关病毒介导的HK过表达可显著抑制5/6肾切除大鼠的肾脏纤维化。

表5 凋亡相关蛋白(Bax、Bcl-2和Bcl-xl)表达条带密度灰度扫描分析结果
注:与sham组比较,*P<0.05;与operation和GFP组比较,#P<0.05。
本实验以重组腺相关病毒为载体,成功获得了HK在大鼠体内的稳定高效表达[8],且证实HK过表达显著减轻了5/6肾切除大鼠肾脏结构破坏和胶原沉积,与文献报道[1]相符。细胞凋亡是5/6肾切除大鼠肾脏重要的病理改变。肾脏大量胶原沉积而肾脏细胞减少是肾脏纤维化的特征。本研究通过Tunnel染色,Caspase-3活性检测和凋亡相关蛋白检测证实HK显著减少了肾脏细胞凋亡,机制至少包括减少促凋亡蛋白Bax的表达和抑制凋亡保护蛋白Bcl-2和Bcl-xl表达下降,减少Caspase-3活化。
炎症细胞浸润是5/6肾切除大鼠肾脏病变的另一个重要因素。5/6肾切除导致肾脏组织表达大量炎症细胞趋化因子如MCP-1等[16]。炎症趋化因子导致大量的炎症细胞浸润,浸润的炎症细胞可以分泌多种细胞因子,这些细胞因子又促进了具有强大促纤维化作用的TGF-β等的大量产生从而导致肾脏纤维化[16]。因此,抑制炎症趋化因子的表达和局部炎症细胞浸润就成为了抑制纤维化的重要措施。本实验证实HK过表达显著减少了肾组织VCAM-1和MCP-1的表达,从而减轻了局部炎症细胞浸润而改善肾脏功能。
综上所述,HK过表达显著改善了5/6肾切除大鼠肾脏纤维化和功能,其机制至少包括抑制TGF-β/smads和MAPKs的促纤维化作用,抑制肾素血管紧张素醛固酮系统的肾脏毒害,抑制炎症和细胞凋亡等等。通过对HK肾脏保护机制的研究,以期为慢性肾功能不全患者的治疗提供一个新的途径和思路。但肾脏纤维化机制复杂,HK抗纤维化是否还包括其它机制还需要进一步研究。
[1] Tu L, Xu X, Wan H, et al. Delivery of recombinant adeno-associated virus-mediated human tissue kallikrein for therapy of chronic renal failure in rats[J]. Hum Gene The, 2008, 19(4):318-330.
[2] Zhou QG, Zheng FL, Hou FF. Inhibition of tubulointerstitial fibrosis by pentoxifylline is associated with improvement of vascular endothelial growth factor expression[J]. Acta Pharmacol Sin, 2009, 30(1):98-106.
[3] Ng YY, Huang TP, Yang WC, et al. Tubular epithelial-myofibroblast transdifferentiation in progressive tubulointerstitial fibrosis in 5/6 nephrectomized rats[J]. Kidney Int, 1998, 54(3):864-876.
[4] Almeida AP, Frabregas BC, Madureira MM, et al. Angiotensin-(1-7) potentiates the coronary vasodilatatory effect of bradykinin in the isolated rat heart[J]. Braz J Med Biol Res, 2000, 33(6):709-713.
[5] Paula RD, Lima CV, Khosla MC, et al. Angiotensin-(1-7) potentiates the hypotensive effect of bradykinin in conscious rats[J]. Hypertension, 1995, 26(6 Pt 2):1154-1159.
[6] Tang SC, Chan LY, Leung JC, et al. Bradykinin and high glucose promote renal tubular inflammation[J]. Nephrol Dial Transplant, 25(3):698-710.
[7] An WS, Kim HJ, Cho KH, et al. Omega-3 fatty acid supplementation attenuates oxidative stress, inflammation, and tubulointerstitial fibrosis in the remnant kidney[J]. Am J Physiol Renal Physiol, 2009, 297(4):F895-903.
[8] Yan W, Wang P, Zhao CX, et al. Decorin gene delivery inhibits cardiac fibrosis in spontaneously hypertensive rats by modulation of transforming growth factor-beta/Smad and p38 mitogen-activated protein kinase signaling pathways[J]. Hum Gene Ther, 2009, 20(10):1190-1200.
[9] Hinojosa-Laborde C, Frohlich BH, Cowley AW. Whole body autoregulation in reduced renal mass hypertension[J]. Hypertension, 1992,20(5):659-665.
[10] Zhao G, Zhao H, Tu L, et al. Effects and mechanism of irbesartan on tubulointerstitial fibrosis in 5/6 nephrectomized rats[J]. J Huazhong Univ Sci Technolog Med Sci, 2010, 30(1):48-54.
[11] Xiao B, Li X, Yan J, et al. Overexpression of cytochrome P450 epoxygenases prevents development of hypertension in spontaneously hypertensive rats by enhancing atrial natriuretic peptide[J]. J Pharmacol Exp Ther, 2010, 334(3):784-794.
[12] Paterno JC, Freire AO, Soares MF, et al. Electroacupuncture and moxibustion attenuate the progression of renal disease in 5/6 nephrectomized rats[J]. Kidney Blood Press Res, 2008, 31(6):367-373.
[13] Chao J, Li HJ, Yao YY, et al. Kinin infusion prevents renal inflammation, apoptosis, and fibrosis via inhibition of oxidative stress and mitogen-activated protein kinase activity[J]. Hypertension, 2007, 49(3):490-497.
[14] Thornton E, Ziebell JM, Leonard AV, et al. Kinin receptor antagonists as potential neuroprotective agents in central nervous system injury[J]. Molecules, 2010, 15(9):6598-6618.
[15] Manolis AJ, Marketou ME, Gavras I, et al. Cardioprotective properties of bradykinin: role of the B(2) receptor[J]. Hypertens Res, 33(8):772-777.
[16] Ghosh SS, Massey HD, Krieg R, et al. Curcumin ameliorates renal failure in 5/6 nephrectomized rats: role of inflammation[J].Am J Physiol Renal Physiol, 2009, 296(5):F1146-1157.

