伊曲康唑固体脂质纳米粒在小鼠体内药动学和组织分布学*
丁 艳 郭学德
(山东医药技师学院,山东 泰安 271000)
伊曲康唑为三唑衍生物,是一种合成的广谱抗真菌药。临床用于治疗全身性真菌感染,如曲霉病、念珠菌病、隐球菌病及组织包浆菌病和多种少见的全身性或热带真菌病等[1]。目前已上市的伊曲康唑制剂有胶囊、口服液和静脉注射液3种剂型。其胶囊制剂吸收受饮食、H2 受体阻滞剂等因素的影响;其口服液和注射液中所含辅料羟丙基-β-环糊精(HP-β-CD),通过肾小球滤过清除,具有肾毒性[2-5]。此外,伊曲康唑注射液还具有心脏毒性,可以导致心脏衰竭[5]。固体脂质纳米给药系统已经成为药物新剂型研究中非常活跃的领域,将药物包封于纳米给药系统中可以改变药物在机体内的分布,使药物到达并浓集于特定部位的靶组织、靶器官、靶细胞甚至细胞内结构,增加药物在靶部位的分布量,提高疗效,减轻药物毒副作用。本实验室采用低温固化法制备了伊曲康唑固体脂质纳米粒,并且比较了伊曲康唑溶液和固体脂质纳米粒混悬液在小鼠体内的药物动力学和组织分布学,来评价其靶向性。
1 材料与方法
1.1仪器
80[-2]型离心沉淀机(江苏金坛市中大仪器厂);LC-10AT VP高效液相色谱仪(日本岛津);SPD-10A VP紫外检测器(日本岛津);METTLER TOLEDO 电子秤(上海);HS3120超声波清洗器;IKA RCT 控温搅拌器;PRO200匀浆器(美国)。
1.2试药
伊曲康唑(寿光富康药业有限公司提供);注射用大豆卵磷脂(上海太伟药业有限公司);硬脂酸(天津市广成化学试剂有限公司);Poluronic F68(SIGMA);Tween 80(天津市天大化工实验厂);三氯甲烷(莱阳市康德化工有限公司,批号090703);2-羟丙基-β-环糊精;甲醇(色谱纯,天津四友生物医学技术有限公司,批号:090908101);氯化钠(天津市科盟化工工贸有限公司);所用水为双蒸水。其它试剂均为市售分析纯。
1.3动物
健康小鼠66只,雌雄各半,体重20±2 g(由山东大学实验动物中心提供)。
1.4伊曲康唑固体脂质纳米粒的制备
别精密称取硬脂酸、卵磷脂、伊曲康唑原料药适量,加入氯仿适量,70 ℃水浴使之完全溶解,在2000转/分的搅拌速度下,加入到含泊洛沙姆F68和吐温80的水溶液中,以相同速度继续搅拌,然后分散于0~2 ℃冰水中,以相同速度搅拌4h,即得ITZ-SLN。
1.5色谱条件
色谱柱:DiamosilTM- C18 (4.6mm×150 mm,5 μm); 流动相:甲醇:水(84:16,V/V);流速:1.0 mL·min-1;检测波长:262 nm;柱温:室温;进样量:20 μl,按伊曲康唑峰计理论塔板数不小于3000。
1.6小鼠体内药物动力学和组织分布学研究
1.6.1试验设计
取昆明种健康小鼠3×22只,随机分为2组,每个时间点平行设定3只。尾静脉注射给药,剂量15mg/kg(按伊曲康唑计算),给药前禁食12 h,自由饮水,第1组为伊曲康唑注射液组,第2组为伊曲康唑固体脂质纳米粒组,分别用作小鼠体内组织分布研究。
于给药前(0h)、给药后5min、15min、30min、45min、1、2、4、6、8、12、24h,取3只,分别取出血浆后处死,立即取心、肝、脾、肺、肾和脑组织。血浆置于肝素化的离心管中,4000r/min离心15min,取上清液,按血浆处理方法测定血药浓度。取出的组织均用生理盐水冲洗干净,并用滤纸吸干表面水分,-20℃冰箱保存待测。
1.6.2血浆样品及组织样品的处理方法
1.6.2.1血浆样品预处理
精密吸取待测小鼠血浆300μl,置离心管中,加甲醇450μl,涡漩1min后,离心(4000 r/min)10min,取上清液,置50 ℃ 水浴氮气吹干,残渣用300μl流动相复溶,经微孔滤膜后过滤,进样20μl。
1.6.2.2组织样品预处理
取动物脏器,精密称重,加1ml生理盐水匀浆(肝脏加入2 ml水进行组织匀浆)。取匀浆样品300μl,置离心管中,加甲醇450μl,涡漩1min后,离心(4000 r/min) 10min,取上清液,置 50℃ 水浴氮气吹干,残渣加300μl流动相复溶,经微孔滤膜过滤,进样20μl。
1.6.3标准曲线的制备
1.6.3.1小鼠血浆标准曲线
取离心管分别精密量取标准储备液适量,用纯N2吹干,加小鼠空白血浆0.5 ml,涡旋混匀,配成浓度为0.1、0.5、1.0、10.0、20.0、50.0μg·mL-1的系列含药血浆样品,按"2.3"项下方法进行预处理后,进样20μl,记录色谱图,求得峰面积A。
1.6.3.2小鼠组织标准曲线
精密量取标准储备液适量至离心管中,用纯N2吹干,分别加小鼠肝、脾、肺、肾等组织匀浆及空白血浆0.5 ml,涡旋混匀,配成浓度为0.1、0.5、1.0、5.0、10.0、25.0、50.0μg·ml-1的系列含药组织样品,按"1.6.2"项下方法进行预处理后,进样20μl,记录色谱图,求得峰面积A。
1.6.4药物浓度的测定
在"1.5"项下,对组织样品进行HPLC测定,记录色谱图。将测得的伊曲康唑峰面积代入相应标准曲线,计算出小鼠血浆及各组织中药物含量。
1.7数据处理
将血药浓度和组织药物浓度测定结果用DAS ver2.0(Drug And Statistics for Windows)药代动力学程序进行处理,求算药物动力学参数。
2 结 果
2.1方法学考察
2.1.1专属性考察 在本实验条件下, 小鼠血浆及各组织中的内源性物质不干扰伊曲康唑的测定。伊曲康唑保留时间在6-8 min之间,药物与内源性物质分离良好。2.1.2标准曲线及线性范围 以血浆样品及各组织样品中待测浓度(C)为横坐标,待测物峰面积(A)为纵坐标,进行线性回归,求得血浆及各组织标准曲线方程。血浆:A=40761C+24093(r=0.998 9)。各组织标准曲线如表1所示:
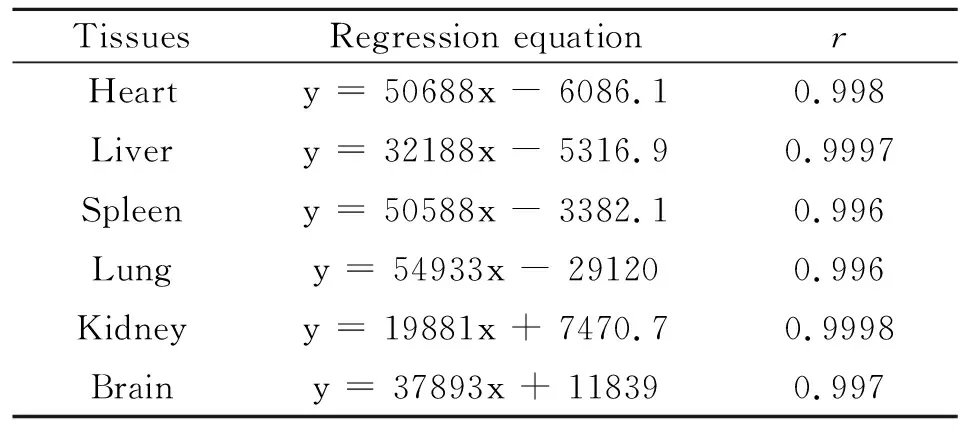
表1 小鼠各组织标准曲线
结果表明ITZ血浆和各组织浓度在0.1~50.0 μg·ml-1范围内线性关系良好,定量下限为0.1μg·ml-1。符合试验要求。
2.1.3精密度与回收率 小鼠血浆及各组织低、中、高(0.2、5.0、40.0μg/ml)三种浓度的日内、日间精密度(RSD)小于 4%,方法回收率为 95%~105%,见表 2和表3。

表2 小鼠血浆和各组织的精密度试验结果(n=5)
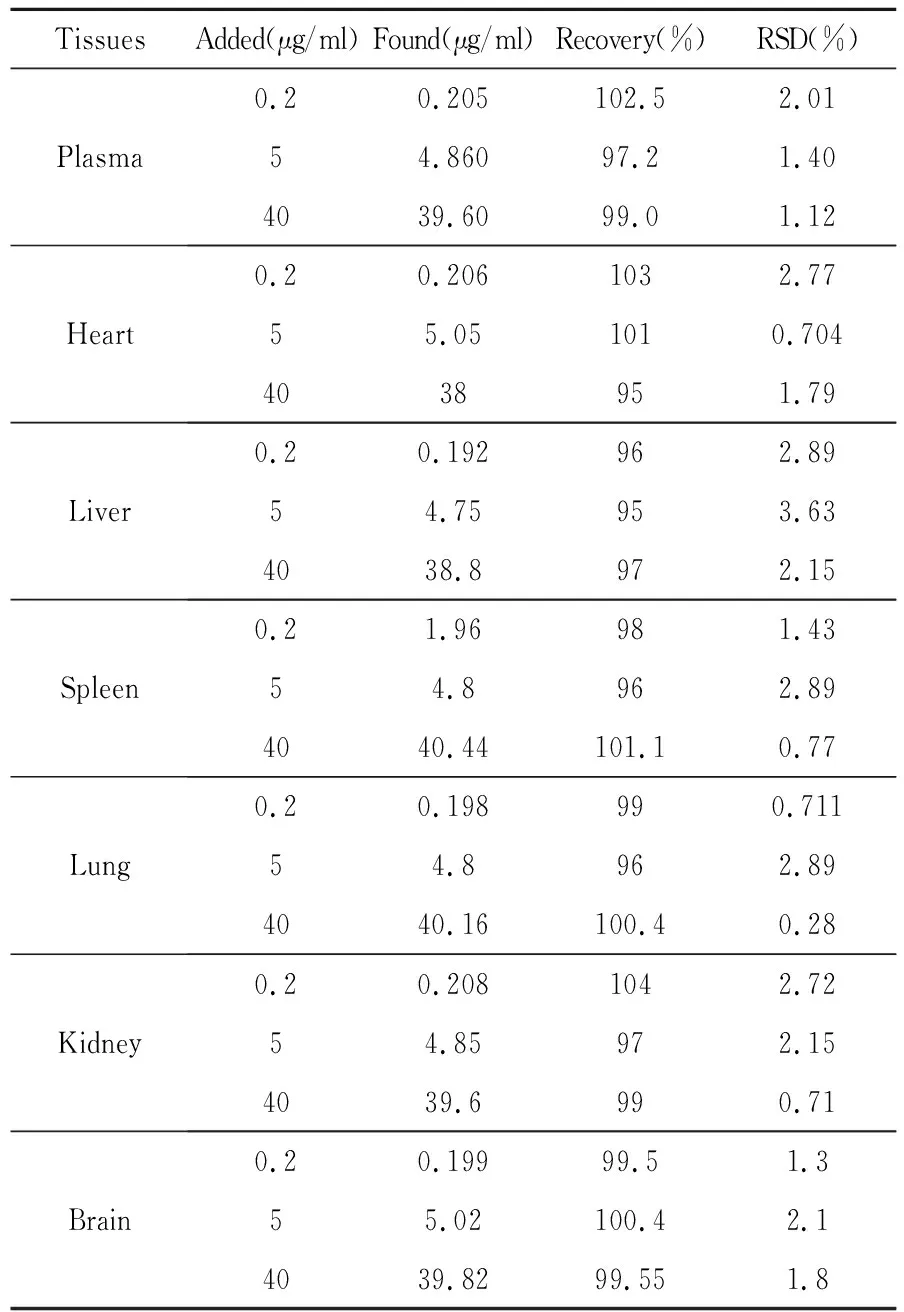
表3 小鼠血浆和组织方法回收率试验(n=5)
2.2小鼠血浆测定结果
2.2.1小鼠血浆血药浓度-时间数据
HPLC法测定各组小鼠给药后不同时间点血浆样品,按"1.6.2.1"项下方法处理,进样20μl,记录色谱图和峰面积。各时间点血药浓度测定结果见表4,平均血药浓度-时间曲线见图1。
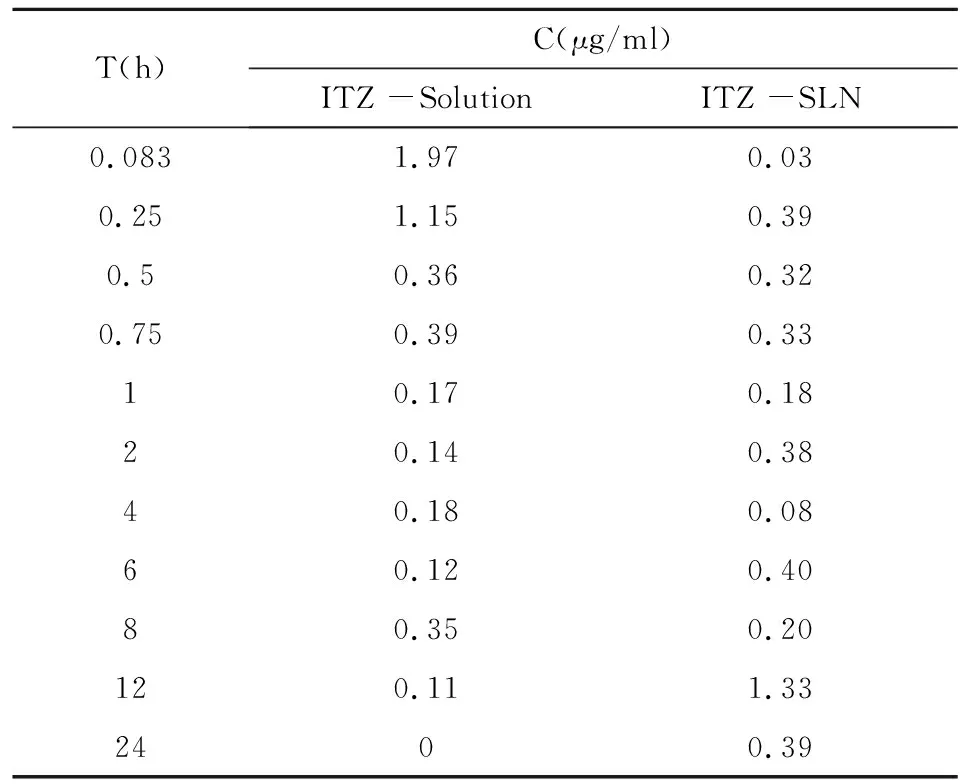
表4 血浆中ITZ药物浓度随时间变化关系(n=3)
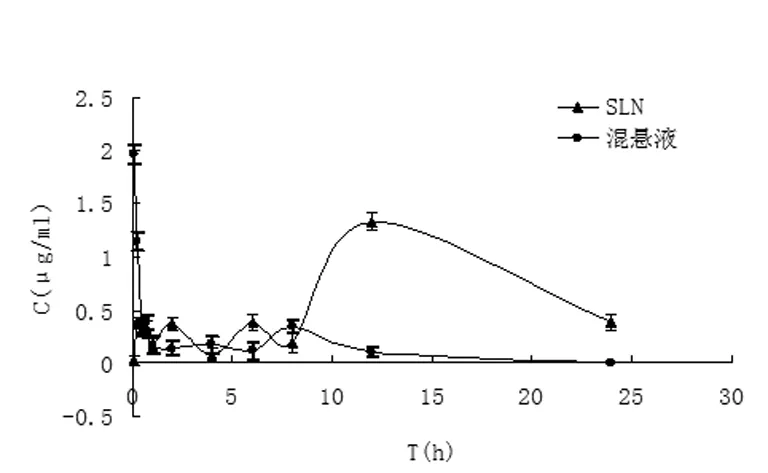
图1 伊曲康唑两种制剂在小鼠体内的药物动力学曲线
2.2.2小鼠血浆数据处理
将血药浓度测定结果用DAS ver2.0(Drug And Statistics for Windows)药代动力学程序进行处理,求算药物动力学参数。详见表5
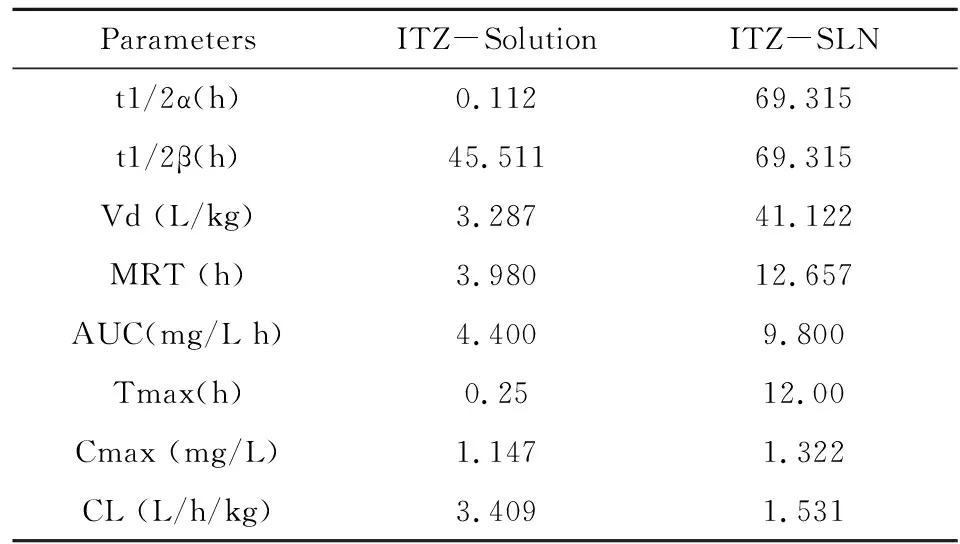
表5 伊曲康唑不同制剂在小鼠体内的动力学
2.3小鼠组织测定结果
HPLC法测定各组小鼠给药后不同时间点组织样品,按"1.6.2.2"项下方法处理,进样20μl,记录色谱图和峰面积。各时间点药物浓度测定结果见表6,7和图2(A-F)。
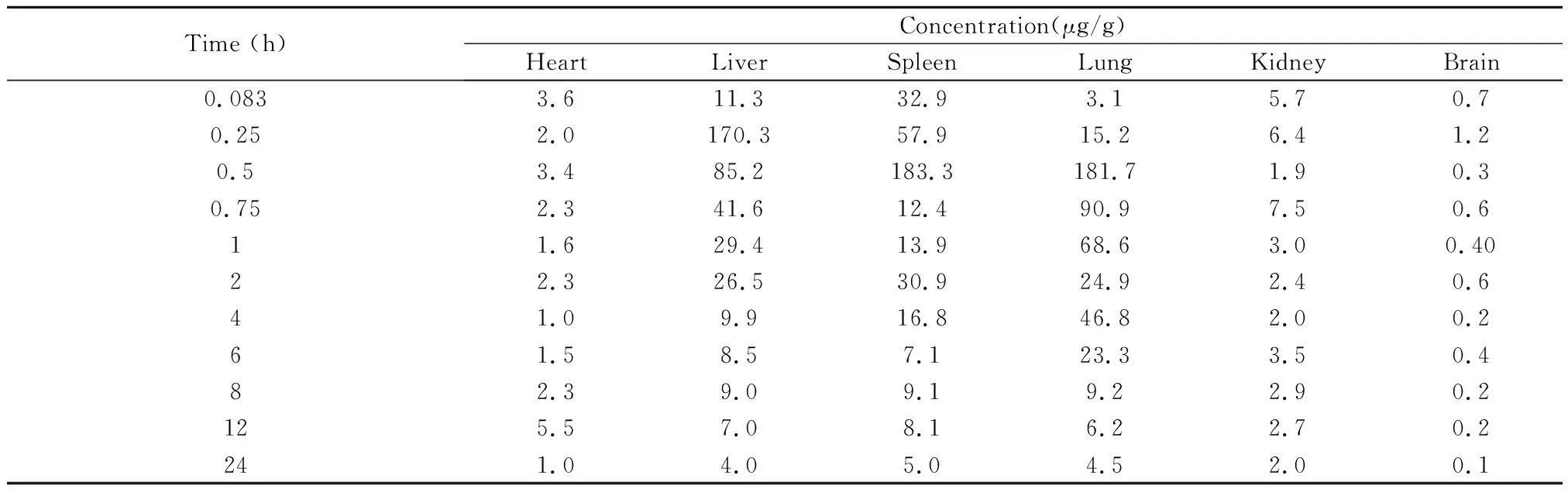
表6 小鼠静脉注射ITZ溶液后各时间点组织中的药物浓度(n=5)
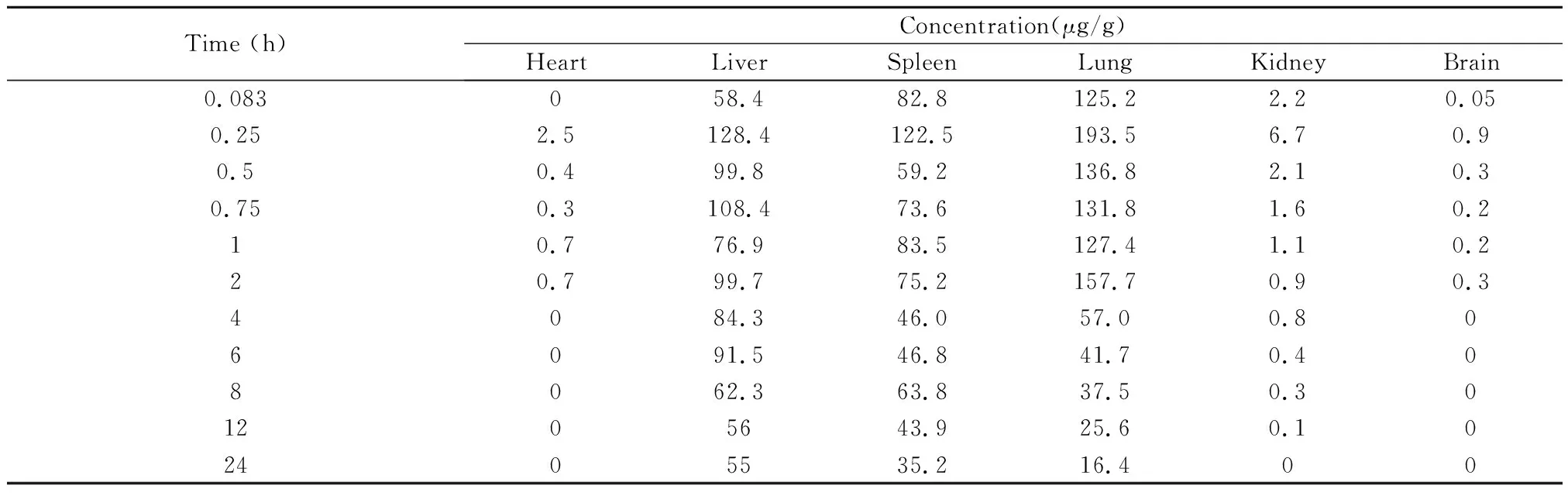
表7 小鼠静脉注射ITZ-SLN后各时间点组织中的药物浓度(n=5)
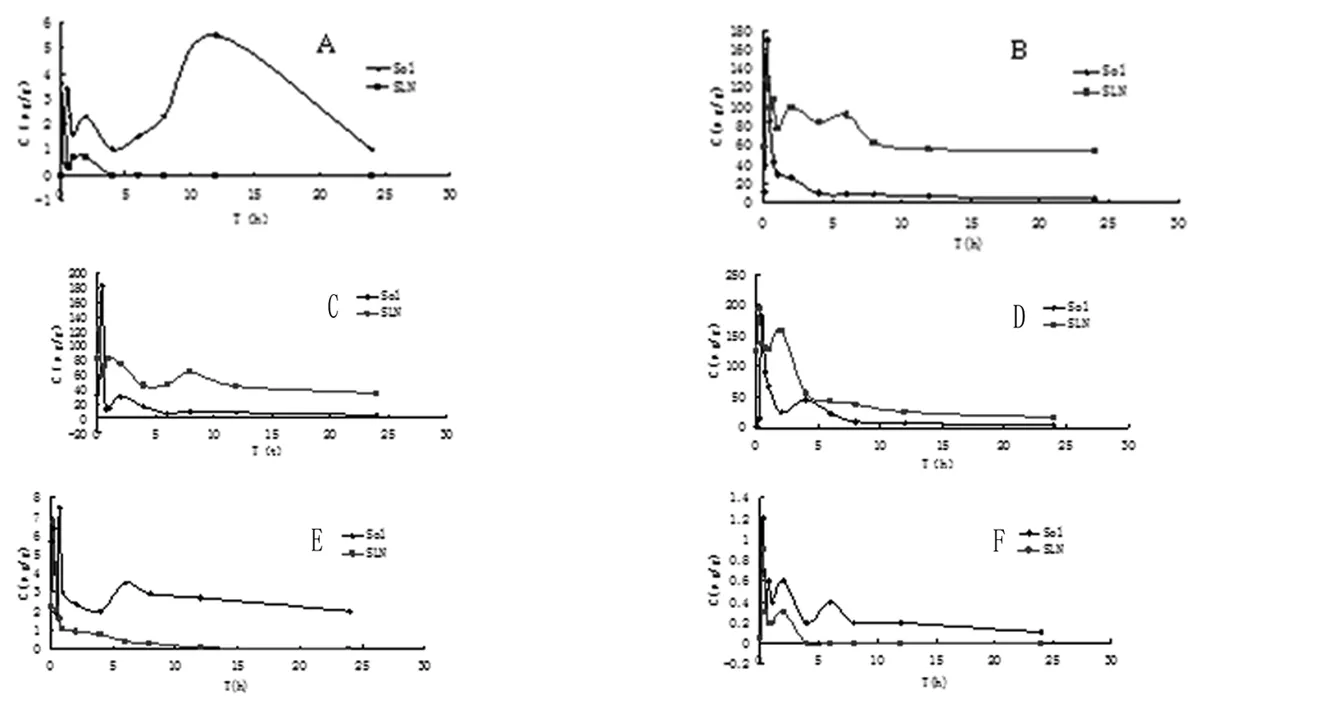
图2 静注ITZ-Sol和ITZ-SLN各组织药-时曲线A:心 B:肝 C:脾 D:肺 E:肾 F:脑
2.4小鼠体内靶向性评价
纳米粒的体内靶向性可采用靶向性参数相对摄取率(re)、总靶向效率(Te)及峰浓度比(Ce)来进行评价。其中:re=AUCn/AUCs,Te=AUC靶/AUC总,Ce=Cmax,n/ Cmax,s,式中n和s分别表示纳米粒和溶液,靶向性评价结果见表8、9。
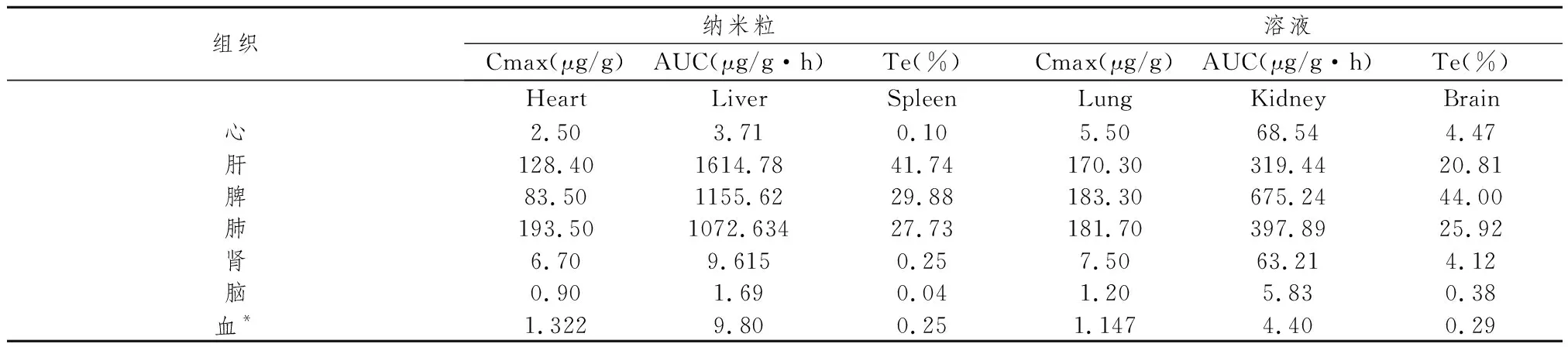
表8 纳米粒及溶液小鼠体内的靶向性(n=5)
*药物浓度单位:μg/mL

表9 ITZ载于SLN后体内靶向性的改变(n=5)
由表8、表9可知,将ITZ制成ITZ-SLN后,体内靶向性发生了明显的改变。肝中的相对摄取率re最大,达到5.055,表明纳米粒对肝有显著靶向性;肝内总靶向效率Te从20.81%提高到41.74%。除肝脏以外,巨噬细胞丰富的脾脏和肺脏中的相对摄取率分别达到了1.711和2.695,表明纳米粒进入循环系统后可以迅速被内皮网状系统吞噬。
3 讨 论
3.1当前伊曲康唑临床应用的剂型有胶囊剂和注射剂等,其在临床应用中存在着以下问题:水溶性差,制成注射剂需要使用处方量40%的羟丙基-β-环糊精[6]的衍生物,虽然它在药物制剂中作为包合物材料被较多使用,但有报道指出它存在肾毒性[7]和致癌作用[8]。口服只能用来浅部真菌感染,当用于治疗系统性真菌感染不能达到较高的稳态血药浓度。在整个人体内组织分布广泛,对于胞内真菌感染无法发挥靶向杀菌作用,使药物疗效降低且易导致毒副作用的产生。
3.2将小鼠血药浓度测定结果用DAS ver2.0(Drug And Statistics for Windows)药物动力学程序进行处理,应用拟合度法及AIC判别法进行模型判断,拟合度越大、AIC越小,模型拟合越好,伊曲康唑溶液、伊曲康唑固体脂质纳米粒的药物动力学特征均可用双室模型来拟合,权重系数w=1。ITZ-Sol组t1/2α为0.112h,t1/2β为45.511h,药时曲线下面积AUC为4.400 μg·h·ml-1;ITZ-SLN组t1/2α为69.315 h,t1/2β为69.315 h,药时曲线下面积AUC为9.800μg·h·ml-1。与ITZ溶液相比,ITZ-SLN的AUC是ITZ的2.23倍,t1/2β由45.511h延长到69.315 h,表明生物利用度提高,药物在体内消除时间延长,可达到缓释长效的目的。
3.3小鼠体内组织分布试验,证明将ITZ制成ITZ-SLN后,体内靶向性发生了明显的改变:肝中的相对摄取率re最大,达到5.055,表明纳米粒对肝有显著靶向性;肝内总靶向效率Te从20.81%提高到41.74%。巨噬细胞丰富的脾脏、肺脏相对摄取率也分别达到了1.711和2.695,说明纳米粒有内皮网状系统靶向性。
3.4在心肾的分布也有了明显的改变。从小鼠的组织分布实验中我们发现ITZ-SLN在心脏的分布明显改变,心内峰浓度由5.5μg/g降低到2.5μg/g,总靶向效率Te从4.47%下降到0.10%;肾脏分布也较溶液组明显改变,肾内峰浓度从7.5μg/g 降至6.7μg/g,总靶向效率Te从4.12%下降到0.25%。这就意味着将ITZ包埋于纳米粒后,药物的心、肾脏毒性大大减小,在临床应用中可能降低患者心脏损害,肾病综合征以及肾功能异常的发病率。
3.5由于肺组织是真菌感染的主要途径和病灶区域,以提高肺分布为目的肺部给药系统已成为该类抗真菌药物的研究热点之一[9],因而对于肺部真菌肺感染这可能会减少临床给药剂量,提高治疗指数和患者顺应性[10]。
[1] Chen W, Gu B, Wang H, et al. Development and evaluationof novel itraconazole-loaded intravenous nanoparticles [J].Int J Pharm, 2008, 362(1-2): 133-140.
[2] ZHOU X, LI G M. Developments of antifungal agents in the treatment of systemic fungal infection [J]. J Dermatol Venereol (皮肤病与性病), 2006, 28 (1):17-20.
[3] YU B, LIU G, ZHANG R, et al. Preparation of itraconazole /2-HP-β-CD solid fusion mixture and investigation of in vitro drug release [J]. Chin Hosp Pharm J (中国医院药学杂志), 2005, 25 (12):1131-1133.
[4] YILWOONG Y, HYE J Y, BONG O K, et al. A mixed polymeric micellar formulation of itraconazole: Characteristics, toxicity and pharmacokinetics [J]. J Controlled Release, 2007, 117(1):59-67.
[5] BARRETT R, JAMES K, PAVLOS P, et al. Itraconazole IV nanosuspension enhances efficacy through altered pharmacokinetics in the rat [J]. Int J Pharm, 2007, 339(1/2):251-260.
[6] 王懿睿 ,杜光. 伊曲康唑制剂的研究进展[J]. 医药导报 2008,27(7):815-818.
[7] VERRECK G, SI X K, DENMOOTER GV, et al . Characterization of solid dispersions of itraconazole and hydroxypropylmethylcellulose prepared by meltextrusion part I[J]. Int J Phar m , 2003, 251 (1 -2) : 165 -174.
[8] Yi Y, Yoon HJ, Kim BO, et al1A mixed polymeric micellar formulation of itraconaz ole: Characteristics, t oxicity and pharmacokinetics[J] J Control Release, 2007, 117 (1) : 59 - 671
[9] Vaughn JM, McConville JT, Burgess D, et al. Single doseand multiple dose studies of itraconazole nanoparticles [J].Eur J Pharm Biopharm, 2006, 63(2): 95-102.
[10] 时晔,贺芬,黄冲,等. 伊曲康唑纳米粒的制备及其在小鼠体内的分布[J].中国医药工业杂志, 2010, 41(2)106-110.

