碘量法分析铜产品中铜含量的技术改进
张 宇 王忠德 邓 华
(国营第一二三厂理化计量中心,齐齐哈尔 161046)
随着工业化进程的逐步推进和规模的不断扩大,国内对铜产品的需求量日益增加,无形中对铜产品的检验能力提出了更高的要求。但是目前我国国家标准中还没有快速测定铜材中铜元素含量的有效方法,大多数企业是依照行业标准YS/T 521.1-2009规定的碘量法进行分析,有些企业则依旧采用电解法。究其原因,前者分析过程复杂,不易掌握,后者分析用时过长,对于批量生产铜材的企业来讲,方法检测速度偏低。
针对上述问题,笔者对行业标准YS/T 521.1-2009中的碘量法进行了改进,改进后的方法试剂用量少,测定范围宽,测定简便、快速,降低了生产成本。
1.实验部分
1.1 主要试剂
硝酸:ρ=1.42 g/mL;
氨水:ρ=0.9 g/mL;
乙酸溶液:100 mL水中加36%乙酸5 mL或100 mL水中加95%的冰乙酸1.8 mL;
碘化钾溶液:称取碘化钾30 g溶于100 mL水中(限当天用)1);
马铃薯淀粉溶液:称取淀粉1 g,用10~20 mL冷水调至糊状,然后用沸水定容至1 000 mL;
硫代硫酸钠标准溶液:0.1 mol/L,具体配制方法参见GB/T 601-2002;
黄铜标准样品:铜含量为61.52%,符合GSB H60002-1988《黄铜化学标准样品》规定,铜含量为62.90%,符合BY1902-1A《黄铜化学标准样品》规定,沈阳有色金属加工厂。
1.2 方法原理
采用间接碘量法进行试验,其方法原理如下:
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
Cu2++2NH3·H2O=[Cu(NH3)2]2++2H2O
2Cu2++5I-=2CuI↓+I3-
2S2O32-+I3-=S4O62-+3I-
含铜量按下式计算:
(1)
其中:w——试样中铜的质量分数, %;
T——Na2S2O3标准溶液对Cu的滴定度, g/mL;
V——试验中消耗Na2S2O3标准溶液的体积, mL;
m——称取试样量, g。
根据反应特点确定主要考察因素包括加入浓氨水量2)、煮沸时间、加入乙酸溶液量3)和加入碘化钾溶液量4)等。
2 结果与讨论
2.1 NH3·H2O用量
为考察浓NH3·H2O用量对试验的影响,采取加入2、4、6 mL NH3·H2O试验水平参与反应,具体数据见附表1和附表2。通过比对发现选择加入4 mL浓NH3·H2O对测定结果的稳定性和重现性最有利,因此确定采用加入4 mL浓NH3·H2O。
在实际操作中,笔者也采用了不加氨水的试验条件进行分析,结果发现大多数情况下得不到有效的试验数据,究其原因是Cu2+在pH<5的酸性溶液中与KI溶液反应生成CuI↓的能力下降,影响最终用Na2S2O3标准溶液滴定计算铜含量的结果[1],故未列出有关试验具体数据。
2.2 煮沸时间
为考察煮沸时间对试验的影响,采用中温煮沸2 min和3 min两个试验水平,具体数据见附表1和附表2。通过试验比对发现,煮沸2 min完全可以达到分析精度要求,故选择煮沸2 min作为试验参数。在试验过程中,还尝试了不加热煮沸和加热1 min两个水平,试验发现,在这两种情况下,HNO3所产生的氮氧化物未能除净,影响与KI溶液充分反应,导致计算的铜含量偏低,甚至无法测出结果。
2.3 HAc溶液用量
试验过程中采用50 mL和100 mL HAc溶液两个水平进行比对,所得数据见附表1和附表2。试验结果表明,加入50 mL HAc溶液所得效果与加入100 mL HAc溶液差别微小,故选择体系中加入50 mL HAc。由于选择加入浓NH3·H2O量仅为4 mL,故加入50 mL HAc溶液完全能够保证反应体系处于pH 5~6之间,这也是I3-与Na2S2O3标准溶液反应必须满足的要求。
2.4 KI溶液用量
为了验证KI溶液用量对试验的影响,采用加入5、10、15 mL KI溶液进行比对,测得铜含量见表1和表2。结果表明,加入10 mL KI溶液最佳。
2.5 其它条件的选择
试验中称取样本量均为0.200 0 g,采用T(Na2S2O3/Cu)=0.006 378 g/mL的Na2S2O3标准溶液(约为0.1 mol/L)滴定,指示剂选择0.1%的马铃薯淀粉溶液。淀粉溶液应是新配制的,若放置过久,其与I2形成的络合物,使溶液不呈蓝色5)而呈紫色或红色,且这种物质吸附络合物,在用Na2S2O3滴定时,褪色慢,终点不敏锐。同时,淀粉指示剂不宜加入过早,否则,淀粉会吸附很多的I2,使滴定结果产生误差。
2.6 最佳条件选择
通过试验表明,采用4 mL浓HNO3溶解试样,滴加4 mL NH3·H2O,煮沸2 min,再依次加入50 mL HAc溶液,10 mL KI溶液,以淀粉作指示剂,用Na2S2O3标准溶液滴定的试验流程,既能保证分析结果的准确度,同时也是各种试验条件中消耗最低的。为了验证此方法在连续批量生产情况下试验结果的准确性和精密度,采用此条件重复测试100次,结果如表1所示。
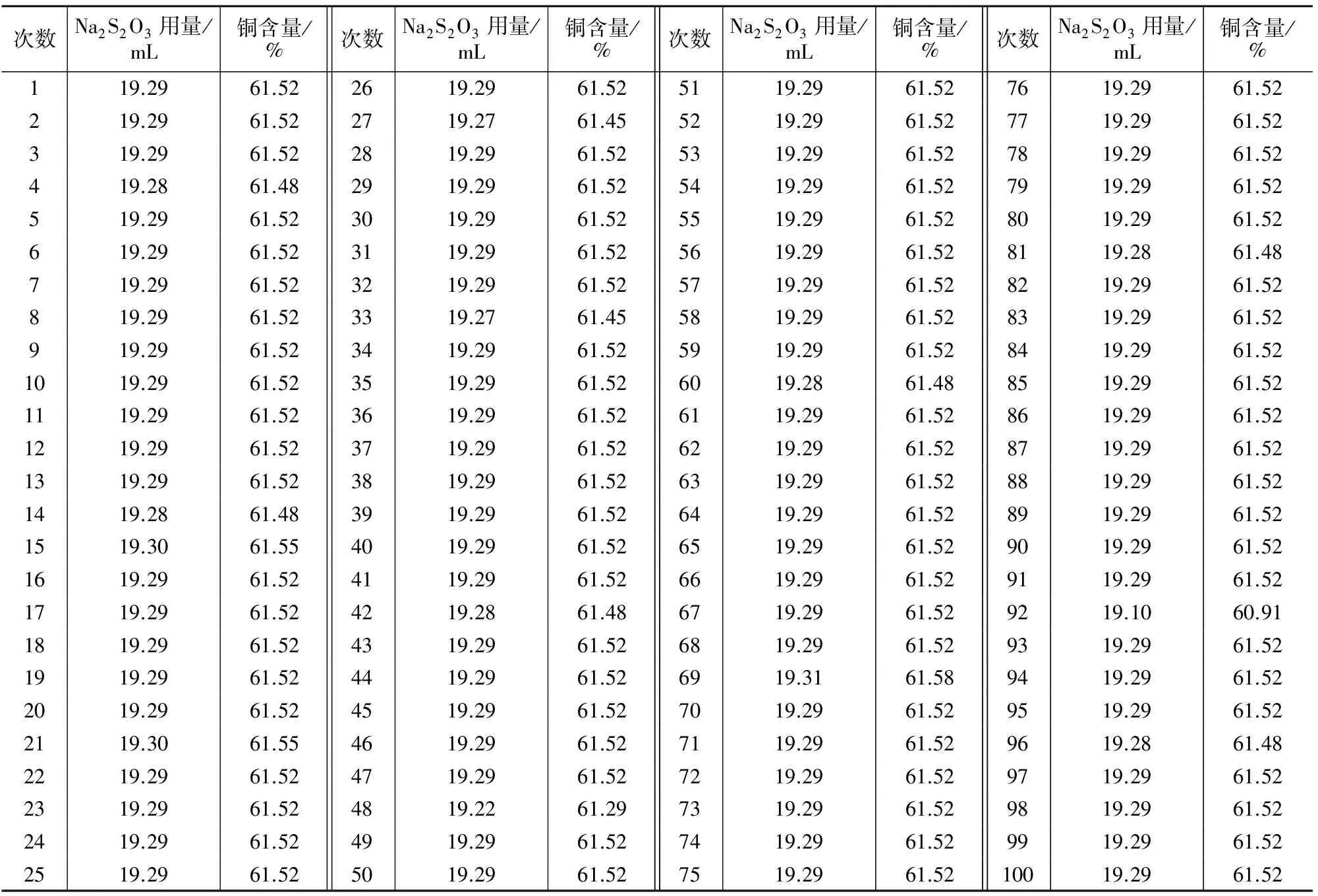
表1 重复性试验结果
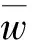
重复性试验标准偏差sr计算结果:
为了验证方法的可靠性,随机抽取另一标准样本,由其它分析人员进行再现性试验(已知该标样铜含量为62.90%),平行测定10次,所得数据如表2所示。

表2 再现性试验结果
再现性试验标准偏差sR计算结果:
通过验证试验说明,该条件下样品分析准确度可以满足化学分析试验要求。
3 结论
为快速测定铜材中含铜量提供了一种简便、高效的分析方法。此方法测量准确度与行业标准相当,其中重现性和再现性均能达到0.016%,完全能够满足生产检测需要。
此法用于企业大批量铜产品的铜含量检验,主要有以下几个优点:
(1)反应原理明确,过程简单,耗时少。该法平均每次测定时间少于10 min,而YS/T 521.1-2009方法需耗时20 min左右,相对于采用电解法测试则至少可以节约1 h。
(2)测定范围宽,该法可测定含铜量范围为50%~97%6),且准确度和精密度高。
(3)提高生产效率,缩短生产周期。按企业原日生产量10批次计,每天用于化学检验所节省的时间可再生产2批。
(4)节约检测消耗,降低生产成本。此法与行业标准的成本比较,所用各试剂量均小于行业标准,平均每生产1 t铜产品可以节省材料费约500元,提高劳动生产率所产生的价值则更为可观,相对于电解法等更是可以节约大量电能。
(5)单一性好,干扰少,避免了YS/T 521.1-2009中繁杂的掩蔽方法。
注:1)因KI常温下极易被空气缓慢氧化而析出I2,使溶液浓度发生变化,故建议企业根据生产实际情况酌量配制,当天使用。
2)加入浓NH3·H2O不宜过量太多,至溶液有稳定的沉淀即可,沉淀为白色,否则生成大量铜氨络离子,影响观察沉淀是否完全(刚生成沉淀溶液呈亮蓝夹杂白色沉淀,而铜氨络离子为深灰蓝色);另一目的是与过量的HNO3反应,进而在煮沸过程中除净溶液中的低价氮氧化物(低价氮氧化物能氧化I-,干扰测定)。
3)HAc溶液加入量要适中,主要是调整样品溶液呈弱酸性,保证S2O32-与I-反应完全。
4)加入KI溶液必须过量,使生产的I2以I3-络离子的形式存在,防止生成的I2挥发;同时,I2易被日光照射分解,故试验最好于暗处进行。
5)滴定终点根据所分析铜产品的化学组成不同而颜色略有不同,普通黄铜终点为近乳白色,铅黄铜终点为淡黄色。
6)本方法主要适合测定普通黄铜类、铅黄铜类等产品,对于含有较多镍、铁等干扰元素的特殊铜材,由于滴定终点颜色的不稳定性,不适用本法。
[1]YS/T 521.1-2009 粗铜化学分析方法 第一部分:铜量的测定 碘量法[S].
[2]JJF 1059-1999 测量不确定度评定与表示[S].

