头针促进MCAO模型大鼠脑微血管新生的动态观察*
张慧敏,赵万标,张志强,时宇静
(1.首都医科大学附属北京世纪坛医院,北京 100038;2.中国中医药报社,北京 100085;3.中国中医科学院,北京 100700)
局灶性脑缺血病后的康复已引起临床神经病学家的重视并取得了很大的进展,头针是治疗缺血性脑卒中的理想方法之一,具有简单易行、经济有效等特点,不仅可以有效改善神经功能缺损评分[1]和缺血性中风模型的多项指标,并参与脑血管内皮细胞损伤状态的调整和恢复,促进血管新生。然而目前临床及科研主要集中在治疗切入时机的研究,而疗程观察相对较少,本文选用头穴百会透刺曲鬓穴方法,采用不同针刺疗程,从血管新生的角度,研究其对脑缺血损伤的保护机制及其介入治疗时限的相关性,从而为临床治疗提供依据。现报告如下。
1 材料与方法
1.1 动物
清洁级健康雄性Wistar大鼠,12周龄,体重300g±20g,由中国军事医学科学院实验动物中心提供。大鼠于饲养厨内适应性饲养1周,清洁饮水,自由摄食。光照与黑暗为12h交替,室温为20℃~22℃,相对湿度60%。
1.2 动物模型建立
模型的制作,根据1985年Koizumi[2]在日本脑卒中会议上首次报道的在大鼠用尼龙线进行可逆性大脑中动脉阻塞模型方法。采用4~0号尼龙渔线(日本株式会社生产),头端加热成圆球形,直径约0.3mm,经硅化后晾干备用。麻醉后的大鼠取仰卧位固定。颈部正中切口,分离并暴露一侧颈总动脉及颈内、外动脉,在颈内、外动脉分叉处结扎颈外动脉,在近心端结扎颈总动脉,并在其远端预置一结扎线。在颈总动脉结扎处远端约3mm处剪一小口,将直径为0.24mm的尼龙线从切口导入,经颈内动脉入颅内分叉部时,即可阻断流入大脑中动脉的血流,进线长度约18±0.5mm,之后将颈总动脉连同尼龙线一起结扎。术后创面敷少许抗生素(先锋Ⅳ),缝合伤口,注意动物保暖,术后大鼠单笼饲养观察。
1.3 动物分组
所有实验组动物在MCAO清醒(术后约30min)后,在1h~2h内观察模型动物神经症状行为障碍的程度,依据Bederson[3]行为学评分法,采用双盲法评分,进行实验动物神经功能评价。具体方法为:①无神经损伤症状0分;②不能完全伸展对侧前爪1分;③向对侧转圈2分;④向对侧倾倒3分;⑤不能自发行走,意识丧失4分。测评分符合1~3分的动物为纳入动物,余下剔除。实验组大鼠造模后符合纳入标准的动物随机分为模型组与头针组,每组依据治疗疗程的不同分为1D、3D、5D、10D 4个时间段,每时间段各8只,每组32只。假手术组除不进行线栓阻塞外,其余手术步骤同模型组[1]。
1.4 针刺治疗
针刺选穴与操作:选取大鼠百会、曲鬓穴,采用直径0.25×25mm毫针常规消毒,病灶侧百会透刺曲鬓,针体与皮肤成15°角至帽状键膜下,深约10mm。针后捻转每分钟200转,每根针捻转1min,重复2次,留针30min。首次针刺在造,模术后6h开始,治疗各组疗程分别为1、3、5、10D,每日1次。空白对照组和模型组各组动物每天同样抓取1次,不做其他处理。
1.5 免疫组化实验
1.5.1 取材 各组实验大鼠分别在规定的时间点,以10%水合氯醛(0.3ml/kg体重)腹腔麻醉后,从左心室插管灌注,先给予0.9%生理盐水50ml灌注后,行4%的多聚甲醛300ml灌注25min,注毕取出大脑并置于4%多聚甲醛液中后固定过夜。
1.5.2 标本处理 于冰盘上迅速分离全脑去除嗅球、小脑及脑干,于视交叉前2.0mm处向后冠状切取4.0mm厚度的脑组织,待做常规免疫组化标本。
1.5.3 免疫组化染色法 一抗由北京中山生物技术有限公司代理的美国Santa Cruz生物技术公司提供;二抗采用北京中山生物技术有限公司代理的美国DAKO公司的EnVision试剂盒。具体步骤如下:(1)脱蜡、水化组织切片;(2)3%过氧化氢孵育10min,以阻断内源性过氧化物酶;(3)根据所应用一抗的特殊要求,对组织切片进行预处理;(4)滴加FⅧR:Ag一抗,4℃过夜,PBS冲洗,2min×3;(5)增加试剂EnVision,37℃孵育20min,PBS冲洗,2min×3;(6)应用 D AB溶液显色,采用 D AKO显色剂;(7)蒸馏水冲洗、复染、脱水、封片。
1.5.4 图像分析 在200倍镜下,每张切片在缺血侧海马CA3区随机选取5个视野,用北航多功能真彩色病理图像分析管理系统(CMIAS2001A型)进行定量分析,分别测量缺血侧海马CA3区微血管内皮阳性细胞黄褐色反应物的总面积、积分光度,分析FⅧR:Ag的表达情况。
1.6 统计学处理
2 结果
2.1 光镜下观察各组微血管内皮FⅧR:Ag表达结果
新生的血管是由单层扁平上皮细胞构成的,免疫组化DAB显色后,新生的血管内皮细胞的胞浆呈棕黄色,胞体扁平,呈单层管样排列,有的基底膜完整,有的不完整甚至无基底形成。实验所选定的模型1d组、3d组与正常组、假手术组及针刺1d组未见新生血管;针刺组3d开始有新生血管生成,5d生成血管数量明显增加,10d达高峰;而模型组5d开始有新生血管生成,10d血管新生明显,但明显少于针刺组(见附图1)。
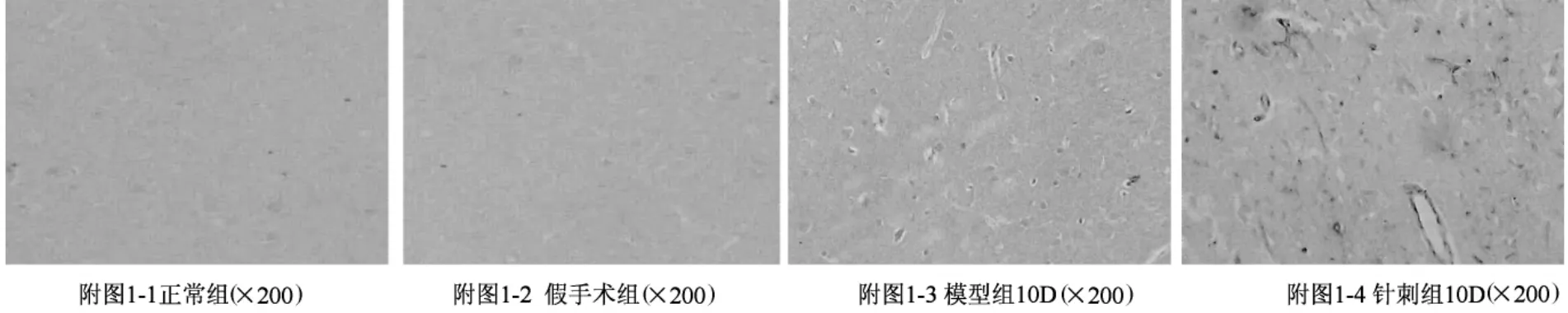
2.2 图像分析针刺对脑微血管内皮FⅧR:Ag表达的影响
缺血各时段假手术组FⅧR:Ag表达的总面积、积分光密度与正常组比较未见明显改变(P>0.05),模型组动物海马CA3区表达FⅧR:Ag的总面积、积分光密度均较假手术组及正常组明显升高(P<0.05)。提示正常脑血管内皮细胞可少量表达FⅧR:Ag,脑缺血后缺血海马CA3区阳性血管内皮细胞FⅧR:Ag表达明显增加。
表1显示,模型组与假手术组比较各个不同疗程的阳性细胞数明显增多,有极显著性差异(P<0.01),说明线栓法局灶性脑缺血模型成功;而同疗程针刺组与模型组比较,针刺1D组与模型1D组比较无显著性差异(P>0.05),针刺3D、5D组分别与模型3D、5D组比较有显著性差异(P<0.05),针刺10D组与10D组比较有极显著性差异(P<0.01)。
表1 各组实验大鼠FⅧR:Ag表达的总面积

表1 各组实验大鼠FⅧR:Ag表达的总面积
注:与同时段模型组比较:★P<0.05,★★P<0.01;与假手术组比较:▲P<0.05,▲▲P<0.01
Group n 1D 3D 5D 10D Normal 8 80.35±2.63 80.35±2.63 80.35±2.63 80.35±2.63 Sham 8 80.53±2.71 80.53±2.71 80.53±2.71 80.53±2.71 Model 8 84.25±5.13 88.88±6.32 95.16±5.37▲ 112.47±5.02▲Treatment 8 85.42±4.98 92.41±4.97★ 98.49±4.87★ 118.61±4.73★★
表2 各组实验大鼠FⅧR:Ag表达的积分光密度

表2 各组实验大鼠FⅧR:Ag表达的积分光密度
注:与同时段模型组比较:★P<0.05,★★P<0.01;与假手术组比较:▲P<0.05,▲▲P<0.01
Group n 1D 3D 5D 10D Normal 8 43.51±3.96 43.51±3.96 43.51±3.96 43.51±3.96 Sham 8 44.43±4.07 44.43±4.07 44.43±4.07 44.43±4.07 Model 8 45.51±4.01▲▲ 49.59±3.97▲▲ 54.52±4.33▲▲ 72.42±4.09▲▲Treatment 8 45.49±4.44 46.52±3.87★ 50.99±4.67★ 65.44±4.78★★
表2显示,模型组与假手术组比较各个不同疗程的阳性细胞数明显增多,有极显著性差异(P<0.01),说明线栓法局灶性脑缺血模型成功;同疗程针刺组与模型组比较,针刺1D组与模型1D组比较无显著性差异(P>0.05),针刺3D、5 D组与模型3D、5D组比较有显著性差异(P<0.05),针刺10D组分别与模型10D组比较有极显著性差异(P<0.01)。提示正常脑缺血海马CA3区内皮细胞FⅧR:Ag可少量表达,脑缺血经针刺治疗后缺血海马CA3区微血管内皮细胞FⅧR:Ag积分光密度表达明显增加,并呈持续效应。
3 讨论
缺血性脑血管病遗留的神经功能障碍一直是困扰人类医学的难题。脑缺血后神经元的修复不仅与营养因子、生长相关因子表达等有关,还取决于缺血区血管新生营造的微环境[4]。血管新生是指在机体生长发育过程中或创伤修复、缺血缺氧和炎症等情况下,原有微血管内皮细胞经过生芽、迁移、增殖与机制重塑等形成新毛细血管的过程[5]。血管新生是微血管系统对缺血损伤做出能动反应的标志。微血管的完整性需要内皮细胞通透屏障和基底膜来共同维持。内皮细胞紧密连接及胞饮作用形成首要屏障[6]。当血管内皮受损时,遗传性假血友病因子(von willebrand’s factor,vWF)的合成大量增加并释放入血流中,可作为血管内皮损伤的标志。目前国际上认为,vWF是在TIA、微血栓形成及大多数缺血性卒中的一个有效的独立危险因素。凝血因子Ⅷ是由凝血蛋白和vWF所组成的复合物,具有抗原性,又称因子Ⅷ相关抗原(FⅧR:Ag)。FⅧR:Ag主要由内皮细胞合成,分布于血管内皮细胞Weikel-palabe小体,也分布于血小板膜内。vWF增高是心脑血管事件的独立预测因子,凡是有血管内皮细胞损害的病变如脑卒中等,均可见血浆中FⅧR:Ag水平增高[7]。而用免疫组化方法显示的FⅧR:Ag只在新生血管上表达,因此不仅能测定出血灶内FⅧR:Ag的相对含量,同时也可作为新生血管的标记。FⅧR:Ag是公认的最特异、最常用的血管内皮细胞标记抗原,FⅧR:Ag表达阳性强度说明新生血管形成程度[8]。本试验结果显示,1D模型组与针刺组无显著差异,而3D、5D组有显著差异,10D组有极显著差异,并与有关文献基本一致[9],说明头穴针刺可促进缺血后微血管新生,对治疗脑血管病有良好的作用且有持续治疗意义。其中模型组内1D、3D与10D组比较有差异,说明有一定的自愈倾向,但组间比较差异显著,说明自愈程度有限,仍需积极治疗。
总之,通过本研究对头穴针刺在不同时间段上FⅧR:Ag指标的动态考察,可以认为头穴针法可激活内皮细胞,促进脑缺血后脑微血管的新生,对指导临床救治缺血性脑血管疾病有显著意义。而这种在疗效上的显著意义,随着最佳介入时间内疗程的适度延长更具有显著相关性。
[1]张慧敏.头针对局灶性脑缺血脑微血管内皮细胞ICAM-1影响的动态观察[J].现代生物医学进展,2007,5(7):682-684.
[2]Koizumi J,Yoshida Y,Nakazawa T,et al.Experiments studies of ischemic brain edema: a new experimental model of cerebrebroembolism in rats in witch recirculation can be introduced in the ischemic area[J].Jpn J stroke,1986,8:1.
[3]Bederson J B,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion,evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-473.
[4]王 娟,刘 健,王 舒,等.脑缺血后血管新生及针刺作用的研究进展[J].中华中医药学刊,2009,7(27):1477-1480.
[5]谢佳佳,宾建平.靶向超声分子成像评价血管新生的研究进展[J].中国医学影像学杂志,2010,1:75-77.
[6]Hamann GF,Liebetrau M,Martens H,et al.Microvascular basal lamina injury afterexperimentalfocalcerebralischemia and reperfusion in the rat[J].J Cereb Blood Flow Metab,2002,22(5):526-533.
[7]Cortellaro M,Boschetti C,Cofrancesco E,et al.The PLAT study:hemostatic function in relation to atherothromotic ischemic events in vascular disease patients[J].Arterioscler Thromb,1992,12(9):1063-1070.
[8]于锡欣,李孟军.肿瘤微血管研究方法进展[J].中国矫形外科杂志,2000,7:267-269.
[9]马璟曦,罗 勇.针对大鼠局灶脑缺血再灌注后脑内血管生长因子和血管抑制因子表达的影响[J].中国针灸,2007,27(2):129-133.

