骨用镁合金表面技术研究现状
臧志海,尹冬松,薄向东,周海瑞
(1.天津市东丽区东丽医院,天津市 东丽区 300300;2.佳木斯大学材料科学与工程学院,黑龙江佳木斯154007;3.佳木斯大学总务处 黑龙江 佳木斯 154007;4.佳木斯大学药学院,黑龙江,佳木斯 154007;)
目前,不锈钢和钛合金等金属作为骨折内固定材料己被应用于临床。但在临床应用中发现它们植入人体后,释放的离子,对人体造成潜在的危害,另外,一般来讲这些材料的弹性模量与自然骨相差较大,容易造成应力遮挡效应[1-2],引起二次骨折。而常用的可降解高分子类植入材料存在力学性能差的明显缺点。因此,有必要寻找一种新的硬组织植入材料。
而作为骨折内固定材料,镁合金的优势明显:1)镁的弹性模量和屈服强度与人骨更接近,能够有效的避免应力遮挡效应;2)镁是人体新陈代谢和骨组织中的基本元素,微量释放对人体有益;3)具有非常低的平衡电极电位,特别是在含有Cl-离子的溶液中易被腐蚀而降解,如果作为植入材料,可以避免二次手术[3-4]。镁合金具有力学性能和加工性能优异,并具有优良的抗疲劳性能。
另外,大量的研究认为,镁合金具有很好的生物相容性。镁合金植入并未对动物机体的循环免疫、泌尿系统产生负面影响。镁对骨膜组织和骨的沉积变硬有积极作用[5]。镁合金具有比可降解聚合物更好的骨组织相容性和骨组织诱导性能[1]。镁合金周围的成骨细胞具有高度的活性,随着镁合金的不断降解,磷酸盐层不断向新骨组织转变,从而使新骨就在降解后的镁合金植入体上生长[6-7],正因为以上的优势,镁合金作为硬组织植入材料,前景广阔。
1 镁的腐蚀特点
镁的平衡电极电位为-2.34 V,在常用的介质中的电极电位也较低,例如在0.5 N的NaCl水溶液中其电极电位为-1.45 V,因此,很容易由第二相或杂质引起的内部电池作用腐蚀,镁合金最为主要的的杂质为FeNiCu,它们易于在晶间形成网状物,使合金遭受严重腐蚀;另外,镁的表面膜保护性不强,很容易被一些常见的阴离子(如Cl-)侵蚀,这样就造成镁合金的腐蚀性能较差;因此阻碍了镁及其合金在生物医用领域的应用。镁在含有氯离子的水溶液中的腐蚀化学方程式如下:
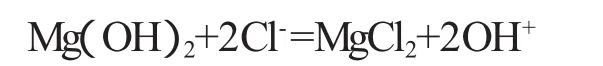
这样,必然会在体内局部区域造成镁离子浓度和pH值过高,引起过量的BMP-2分泌,激活破骨细胞,导致溶骨现象,并将导致皮下气囊产生和中后期材料的强度急剧下降,难于满足内固定的要求[8]。
另外,由于真实体液较为复杂,人们已经考虑到磷酸盐,碳酸盐等其他盐类对腐蚀的影响,并探索出了相应规律[9]。体内降解过程受到包括物理、化学和生化因素影响。物理因素主要是外应力,化学因素主要有水解、氧化及酸碱作用;生化因素主要是酶和微生物的作用,这方面的工作还有待深入[10]。
2 医用镁合金表面处理的研究概况
根据金属腐蚀学的相关理论结合镁合金的腐蚀特点,可以采取以下提高镁合金纯度、合金化、热处理、快速凝固及表面处理等措施来提高镁合金的腐蚀性能。
与其他方法相比较,表面处理有其独特的优势,首先它可以显著的降低镁合金在体液中的腐蚀速率特别是植入初期的腐蚀速率,这种效果,其他方法很难达到;另外,如涂层的选择得当或者增加适当的辅助处理步骤,还可以同时改善材料表面的生物活性和生物相容性。因此,前人在表面处理提高耐蚀性上作了大量研究。表面处理主要包括:电化学方法(电泳、电镀、电沉积等)、金属镀层、离子注入、碱热处理、激光熔敷和微弧氧化等方法。
2.1 阳极氧化
Ting Lei等利用阳极氧化方法在Mg-Zn-Ca表面制备了MgO涂层,利用电化学测量了合金的腐蚀速率,发现MgO涂层降低了合金的腐蚀速率[11]。李姝,董寅生等为改善医用AZ31镁合金的抗腐蚀性能,综合应用阳极氧化及化学转化工艺在其表面制备较为致密、平整复合膜层,所得主要由Mg(OH)及Al2O3相组成,膜层中含有N,O,P元素,显著提高了AZ31合金的耐蚀性能[12]。王飞,张永君等通过阶跃式阳极氧化表面改性技术有效地增加镁合金的耐腐蚀性及耐磨性,减缓了镁合金的降解,使其有望成为一种新型的生物医用材[13]。
2.2 微弧氧化
重庆大学CHENJun,ZENG Rongchang等研究了微弧氧化AZ91镁合金表面在模拟体液中的腐蚀磨损性能,结果发现:微弧氧化AZ91镁合金的腐蚀磨损性能远高于原始合金[14]。P.Shi等采用微弧氧化在纯镁表面得到多孔的氧化镁涂层,并利用溶胶-凝胶工艺进行对其表面多孔部位进行封孔处理,之后用水热处理使其稳定,通过测试发现与未处理试样相比,耐蚀性增加了30倍[15]。
2.3 电化学处理
Song Yang,Zhang Xiaonong等研究了利用电沉积方法制备了三种Ca-P涂层(CaHPO4H2O,Ca(PO4)(OH)2,Ca5(PO4)3(OH)1-xFx)来改善Mg-Zn合金的生物活性和耐蚀性能,结果发现三种Ca-P涂层都能降低Mg-Zn合金的降解速率,其中Ca5(PO4)3(OH)1-xFx涂层耐蚀性最好[16]。WangHX和Wang LG利用脉冲电沉积的方法制备了羟基磷灰石涂层,该涂层能够显著的提高镁合金的耐蚀性能,自腐蚀电位由-1645 mV增加到-1414 mV,自腐蚀电流由110A/cm2下降到25 A/cm2。该涂层与基体具有较高的结合强度,涂层的剪切强度可达到 41.8MPa±2.7 MPa[17]。ZhangXiaonong和 Li Jianan等通过电化学方法在Mg-6Zn合金基体上制备FHA涂层,结果表明,表面改性之后,材料的生物活性明显好于原始材料[18]。
2.4 碱热处理
碱热处理也能够明显提高镁合金的耐蚀性,Gu×N和Zheng YF等采用三种含有Na离子的碱溶液进行浸泡,随后进行热处理对Mg-Ca合金进行表面处理,结果在合金表面形成了13.6 μm~26μm的氧化层,三种方法的碱热处理都能够显著的提高镁合金的腐蚀速率,并且具有较好的生物形容性[19]。Kuwahara将纯镁(质量分数99.9%)在530℃下热处理9 h~25 h后,放在模拟人体环境溶液中浸泡,发现材料的抗蚀性显著提高[20]。
2.5 转化膜
人们通常通过发生化学反应,使基体金属的离子与溶液中的阴离子或原子反应,之后在其表面自发形成反应膜,这种膜通常可以保护材料基体。颜廷亭,杨柯等采用正交实验研究了以CeCl3为主盐的镁合金稀土转化膜处理工艺,在AZ31B镁合金表面制备出较为致密的稀土转化膜。结果表明,该工艺处理后的AZ31B镁合金表面生成了由CeO2和MgO组成的稀土转化膜,在生理盐水及Hank’s溶液中,均具有良好的耐蚀性能;表面稀土转化膜具有良好的抗凝血性能。还讨论了转化膜的成膜机理[21]。
另外,他们还在AZ31B镁合金表面制备了氟转化涂层,并研究了处理工艺对涂层耐蚀性能及厚度的影响。涂层的主要成分为MgO与MgF2。氟转化处理能显著提高AZ3IB镁合金在SBF溶液中的耐蚀性能。此外,氟处理将镁合金的主要腐蚀形式由点蚀转变为面腐蚀为主要腐蚀形式,使氟转化处理后的镁合金表现出“滞后”的降解行为。氟转化处理AZ3lB镁合金具有优异的细胞相容性、血液相容性及抗菌性能[22]。
2.6 激光熔覆
高亚丽,熊党生等为改善医用镁合金表面耐蚀性和生物相容性,采用激光熔覆技术在AZ91D镁合金表面制备具有生物活性的羟基磷灰石涂层。结果表明,所制备的涂层和镁合金基体达到了良好的冶金结合涂层显微结构为致密的胞状晶,主要由Mg、HA、CaH2P2O7和 CaH4(PO3)2·H2O 组成,从而大大提高了涂层的生物活性[23]。Mei课题组[24]利用激光熔覆两步法并对工艺参数进行优化,在镁合金表面激光熔覆Al-Zn涂层,涂层与基体形成良好的冶金结合,熔覆试样的腐蚀电流密度比未处理试样显著降低。
2.7 其他处理方法
TANLi-li,YANGKe等利用化学沉积的方法制备了Ca-P涂层,发现其耐腐蚀性能显著提高,生物相容性也得到改善[25]。Xu Liping和ZhangErlin利用2%的磷酸和硫酸混合溶液进行表面处理,得到含有Ca-P涂层的表面活化的Mg-Mn-Zn合金,经过体外和体外实验表明这种方法显著改善了镁合金的表面活性[26]。黄晶晶等[27]采用浸涂法制备Mg植入材料表面聚乳酸涂层,发现经聚乳酸表面处理的试样在模拟体液中浸泡10d后,表面处理后的试样质量损失明显降低。许鑫华等利用壳聚糖涂层来改善稀土镁合金的耐蚀性能和生物相容性,发现壳聚糖涂层能够显著的提高镁合金的耐腐蚀性能[28]。
3 总结
由于人体出现创伤时,体液呈酸性环境,这样,对于镁基植入材料,在植入初期伤口未愈合时降解速度最快,对材料的腐蚀也最严重,因此对镁合金初期腐蚀的控制非常重要,而表面处理方法在这方面具有显著优势,以上各种方法都具有自身的优势和不足,想更好的发挥各种方法的优势,避免其不足需要对各种表面方法进行综合的运用;这样会使镁合金最为骨折内固定材料更具可能。
[1]StaigMP era,Pieta A.M.ka.Magnesium and its alloys as orthopedic biomaterials[J].Areview.Biomaterials,2006,27(9):1728-1734.
[2]颜廷亭,谭丽丽,熊党生,等.医用镁金属材料的研究进展[J].材料导报,2008,22(1):110-112.
[3]王勇,高家诚,张艳,等.纯镁在模拟体液中的腐蚀机理[J].中国有色金属学报,2007,17(12):1981-1986.
[4]黄晶晶,任伊宾,张炳春,等.镁及镁合金的生物相容性研究[J].稀有金属材料与工程,2007,36(6):1102-1104.
[5]张广道,黄晶晶,杨柯,等.动物体内植人镁合金的早期实验研究[J].金属学报,2007,43(11):1187-1188.
[6]徐丽萍,张二林,杨柯.医用可降解镁合金体外体内的降解[C]//中国材料研究学会2006年会论文集.北京:2006:345-346.
[7]于国宁,张二林,徐丽萍.骨组织对镁合金植入材料的骨反应[G]//中国材料研究学会 2006年会论文集.北京:2006:331-332.
[8]张广道.AZ31B生物可降解镁合金植入兔下颌骨生物学行为研究[D].北京:中国医科大学,2009.
[9]信运昌.医用镁合金在生理环境中降解机理及其表面改性研究[D].北京:清华大学,2009.
[10]华楠.生物降解材料的体内降解机理[J].国外医学:生物医学工程分册,2004,27(3):181-185.
[11]Ting Lei,Chun Ouyang,Wei Tang,Lian-Feng Li,Le-Shan Zhou.nhanced corrosion protection of MgO coatings on magnesium alloy deposited by an anodic electrodeposition process.Corrosion[J].Science.2010(52):3504-3506.
[12]李姝,董寅生,盛晓波,等.医用AZ31镁合金表面复合膜层的制备及其性能表征[J].表面技术,2010,29(1):41-44.
[13]王飞,王钢,孟祥翔,等.新型镁合金皮内刺激与致敏实验研究[J].中国矫形外科,2009,17(13):1013-1015.
[14]CHEN Jun,ZENG Rongchang,HUANG Weijiu,ZHENG Ziqing,WANG Zhenlin,WANG Jun.Characterization and wear resistance of macro-arc oxidation coating on magnesium alloy AZ91 in simulated body fluids[J].Transactions of Nonferrous Metals Society of China,2008(18):361-364.
[15]Shi P,Ng WF,Wong MH.Improvement of corrosion resistance of pure magnesium in Hank's solution by microarc oxidation with sol-gel TiO2 sealing[J].Journal of Alloys and Compounds,2008(1):102-109.
[16]Song Yang,Zhang Shaoxiang,LiJianan,Zhao Changli,Zhang Xaonong.Electrodeposition of Ca-P coatings on biodegradable Mg alloy:In vitro biomineralization behavior[J].Acta Biomaterialia,2010(6):1736-1742.
[17]Wang HX,Guan Wang SK.Ren X.WangLG.In vitrodegradation and mechanical integrity of Mg-Zn-Ca alloy coated with Ca-deficient hydroxyapatite by the pulse electrodeposition process[J].Acta Biomaterialia,2010(6):1743-1748.
[18]Li Jianan,Song Yang,Zhang Shaoxiang,Zhao Changli ,Zhang Fan,ZhangXiaonong,CaoLei,Fan Qiming,Tang Tingting.In vitro responses of human bone marrowstromal cells to a fluoridated hydroxyapatite coated biodegradable Mg-Znalloy[J].Biomaterials,2010,31:5782-5788.
[19]Gu XN,Zheng W,Cheng Y,Zheng YF.A study on alkaline heat treated Mg-Ca alloy for the control of the biocorrosion rate[J].Acta Biomaterialia.2009(5):2790-2799.
[20]Hideyuki Kuwahara,Al-Abdullat Yousel,Naoko Mazaki,et al.Precipitation of magnesium apatite on pure magnesium surface during immersing in Hank's solution[J].Materials Transactions.2001,42:1317.
[21]颜廷亭,谭丽丽,熊党生,等.生物医用AZ31B镁合金表面稀土转化膜的制备及其性能研究[J].稀有金属材料与工程,2009,38(5):918-922.
[22]颜廷亭.A231B镁合金的生物医用表面改性研究[D].南京:南京理工大学,2010.
[23]高亚丽,熊党生,王存山,等.医用镁合金激光熔覆羟基磷灰石涂层初探[J].特种铸造及有色合金,2009,29(4):55-57.
[24]Mei ZGuo LF Yue TM.The effect of laser cladding on tlxcossosion resistance of magnesium ZK60SiC composite[J].Mater Proc Tech,2006:161(3):462.
[25]TAN Lili,WANG Qiang,GENG Fang,XIXiaosong,QIU Jian-hong,YANG Ke.Preparation and characterization of Ca-P coating on AZ31 magnesium alloy[J].Transactions of Nonferrous Metals SocietyofChina,2010,20:648-654.
[26]Liping Xu,Erlin Zhang,Dongsong Yin,Songyan Zeng,Ke Yang.In vitro corrosion behaviour of Mg alloys in a phosphate buffered solution for bone implant application [J].Journal of Materials Science:Materials in Medicine,2009,19(3):1017-1025.
[27]黄晶晶,任伊宾,张炳春.可降解镁植入材料表面涂层的制备及其性能[J].中国有色金属学报,2007,17(9):1466-1468.
[28]许鑫华,程静,张春怀,等.医用镁合金的生物腐蚀及高分子涂层处理[J].稀有金属材料与工程,2008,37(7):1226-1228.

