湿地松猝倒病拮抗细菌的筛选与定殖1)
霍宪起
(临沂大学,临沂,276005)
湿地松猝倒病拮抗细菌的筛选与定殖1)
霍宪起
(临沂大学,临沂,276005)
通过平板对峙培养,从320株分离于湿地松根部的拮抗细菌中筛选出27株对湿地松猝倒病病原菌有拮抗作用的菌株,再结合抑菌指数测定,进一步筛选出了抑菌作用最强的10株拮抗细菌。经16S rDNA分子测序方法鉴定,B4、C4、C23、C25、C28、C33、C41为洋葱伯克霍尔德菌,C3和 C8为枯草芽孢杆菌,C27无法测定全部序列有待其它细菌鉴定方法确定其分类地位。在室内防病试验时,B4和C41表现出显著的防病效果,但在室外,C23表现出显著的防病效果。10个菌株都可在湿地松根部定殖,但是在松苗根部不同部位的分布并没有规律。定殖过程中,各个菌株在松苗根部的菌量随着时间的增长而增加,在某一时刻达到峰值后数量逐渐减少。
湿地松;猝倒病;拮抗;细菌
湿地松(Pinus elliottii Engelm)是裸子植物门松属的多年生常绿乔木,于20世纪30年代由美国引入我国。因其苍劲而速生、适应性强、产脂量高,在我国山东平邑以南的园林、自然风景区和山区广泛种植[1]。但是经常于湿地松育苗期发生猝倒病,严重影响湿地松育苗工作的正常进行。国内外资料显示,湿地松猝倒病主要是由丝核菌(Rhizoctonia)、镰刀菌(Fusarium)、链格孢菌(Alternaria)、腐霉菌(Pythium)等属的多种真菌引起,且不同地区导致发病的病原菌种类不尽相同[2-4]。由于该病害病原菌寄主广泛,在土壤中普遍存在,且对选择性杀菌剂易产生抗药性,因此湿地松猝倒病仍然是目前湿地松育苗期的主要病害之一。为了可持续地防治湿地松猝倒病,避免其病原菌因单一的化学防治而过快地产生抗药性,生物防治已成为湿地松猝倒病防治的重要研究领域。笔者曾对国外分离到的荧光假单胞菌防治湿地松猝倒病的情况进行过报道[5],本研究对从国内湿地松根系中分离到的拮抗细菌进行了鉴定,并对其在湿地松根际的定殖进行了研究,以期为湿地松猝倒病的生物防治提供科学依据。
1 材料与方法
1.1 材料
湿地松猝倒病病原菌丝核菌ZJ31、链格孢菌ZJ11和镰刀菌ZJ36,均由笔者从发病的湿地松幼苗根颈处分离得到,丝核菌B为南京林业大学森林病理实验室提供。湿地松猝倒病拮抗细菌320个,采用平板稀释法[6]191分离自湿地松根际,根据采样时间和地点依次编号为A1-160、B1-21、C1-45、D1-25、E1-11、F1-16、G1-18、H1-9、I1-15。除 C1-C22 分离自松滋湿地松苗圃外,其它均分离自荆门市彭场林场湿地松苗圃。大肠杆菌DH5α为中国农业科学院郑州果树研究所古勤生博士提供。湿地松种子由彭场林场种子园提供。引物由北京三博远志公司合成:上游5′-AGA GTT TGA TCC TGG CTC AG-3′;下游 5′-ACG GCT ACC TTG TTA CGA CTT-3′。Taq DNA聚合酶为GIBCO公司产品,T4 DNA连接酶、蛋白酶为KNEB公司产品,pMD-18T为TaKaRa公司产品,dNTP为Promega公司产品,PCR产物纯化试剂盒为Bio 101公司产品。病原真菌的保存、活化和培养用PDA培养基。平皿拮抗测定用1/2PDA+培养基[5]。拮抗菌的培养、活化和培养用 LB培养基[6]188。拮抗菌抗利福平突变体的分离、培养和检测用LB+培养基(其他成分不变,在倒平板时另加利福平,质量浓度为3.0×10-4g/L)。
1.2 方法
拮抗细菌的初步筛选:病原真菌培养5d,取直径8mm菌块置于1/2PDA+平皿中央,培养24h。拮抗细菌在LB液体培养基中振荡培养24~72h,至浑浊,取10μL滴于1/2PDA+平板上,每皿对角线接种,菌液与平皿中央等距,培养5d,观察效果。25℃,黑暗培养。拮抗性强弱的划分标准为,①无拮抗性。真菌覆盖全部细菌;②弱拮抗性。至少一种真菌包围细菌,但是细菌上无真菌;③中拮抗性。至少一种真菌的边缘与近真菌端细菌接触,但远真菌端未接触;④强拮抗性。至少一种真菌边缘与近真菌端细菌未接触。
细菌拮抗性定量测定:拮抗细菌抗性的测定参照文献[5]进行。
拮抗细菌的分子鉴定:选择强拮抗性的菌株进行分子鉴定。拮抗细菌基因组DNA通过CTAB法[7]提取,基因组16S rRNA扩增与扩增条件参照文献[8]进行,大肠杆菌感受态细胞通过氯化钙法[9]209制备,质粒 DNA 通过碱裂解法[9]115-116提取,目标片段的质粒测序后送 GenBank进行对比,用 DNAMAN 4.0(Lynnon Biosoft)分析,确定细菌分类地位。鉴定标准:所测序列与GenBank中的参比菌株的16S rDNA序列同源性不小于99%的为同一个种,与参比菌株的16S rDNA序列同源性不小于97%的为同一个属[10]。
拮抗细菌抗利福平突变体的诱导:根据参考文献[11]的方法对10个拮抗菌株进行抗利福平诱导,直到筛选到稳定的抗利福平300×10-6g/L的菌株突变体。观察10个菌株突变体的培养性状,并测定各个突变体在平板上对松苗猝倒病病原菌的拮抗效果,计算各个菌株的抑菌率。
拮抗细菌的防病试验:拮抗菌防病试验参照文献[5]进行。
拮抗细菌的根部定殖:对湿地松种子催芽,待根长1~2cm时,接种细菌菌株,然后将幼苗于种芽间剪断。根段置于装有10mL蒸馏水的三角瓶(内置少量玻璃珠)中振荡25min,然后将菌液稀释至10-5涂平皿,每皿200μL菌液,4次重复,25℃恒温培养4d,细菌计数,统计结果。根段称鲜质量,计算初始菌量。用菌液浸泡湿地松幼苗后植入装有灭菌土的塑料花盆中,在湿地松的茎木质化前分别于15、30、45、60、75d及木质化后的90d取样,检测细菌在根际的密度,以不接菌作为对照。每钵中取松苗10株,以根颈处为起点,按1cm一段截取,直至根尖,将相同根段置于装有无菌磷酸缓冲液(PSB,pH值7.0)的三角瓶中,振荡30min,稀释涂平皿。1~10、11~20、21~30mm 根段用 10-5涂皿,其余根段用 10-4涂皿,称出根段鲜质量,最后计数并统计结果。
数据分析:用软件SPSS17.0对测定数据进行处理,并计算差异显著性(邓肯法)。
2 结果与分析
2.1 拮抗细菌的筛选
经过筛选获得27株具有拮抗活性的细菌菌株,其中12株具有弱拮抗性,5株具有中拮抗性,10株具有强拮抗性,其余无拮抗性。强拮抗性菌株分别为:B4、C3、C4、C8、C23、C25、C27、C28、C33和C41(图1)。由于10株细菌具有非常明显的生防潜力,因此对它们全部进行16S rDNA的序列测定以确定其分类地位,并进行防病和根部定殖试验。
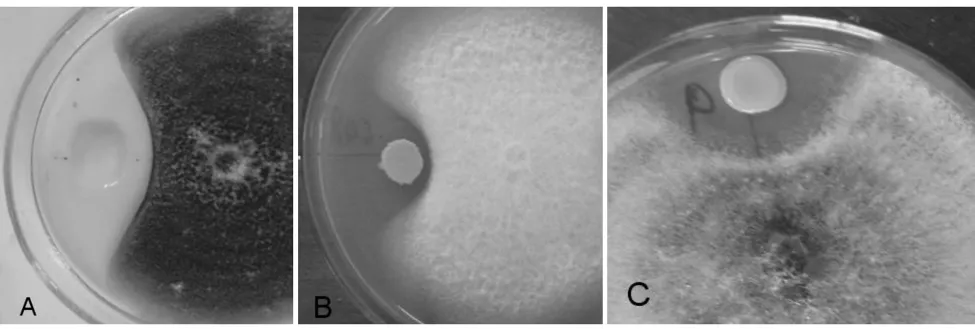
图1 湿地松猝倒病拮抗细菌的筛选
2.2 拮抗细菌的定量测定
对于镰刀菌,T=0.7时,C28的拮抗能力最强,抑制指数为0.24,其次为C25 和 B4,抑制指数分别为0.22 和 0.17,并且3个菌株的拮抗能力在同一水平,差异不显著,最弱的为C4;T=1时,除了 B4和 C41抑制指数分别为0.11和0.12外,其余8个菌的抑制指数均为0。对于链格孢菌,拮抗活性最强的为C23,T=0.7时抑制指数达 0.26,T=1时抑制指数为0.19;较弱的为C3和C4,在T=0.7时,2个菌株抑制指数分别为0.05和0.07,T=1 时,2 菌的抑制指数均为0,与其它8个拮抗菌株的差异极显著。对丝核菌ZJ31,拮抗活性最强的为C23,其次为C28和C25,较弱的为C4和C8,无论T=0.7还是T=1,抑制指数均显著低于其它8个拮抗菌株。对于丝核菌B,拮抗活性较强的为C23和C33,较弱的为C3、C4和C27。总体看来,10个拮抗菌株对链格孢菌和丝核菌的拮抗能力相对较强,对镰刀菌的拮抗能力都相对较弱。C23对链格孢菌和丝核菌表现出很好的抗性,但对镰刀菌表现出的抗性较差;B4和C41对4个供试病原菌均表现出一定的拮抗效果;C4对4种病原菌的拮抗效果均较差,特别是对于镰刀菌和链格孢菌几乎没有拮抗作用(表1)。
室内对峙试验的分析表明,供试拮抗菌中C23对松苗猝倒病病原菌中的丝核菌和链格孢菌有显著的拮抗作用,但对镰刀菌拮抗效果不明显;B4和C41对4个供试病原菌均表现出一定的拮抗效果,而C4几乎对所有病原菌拮抗效果都不明显。
2.3 拮抗细菌16S rDNA序列测定
根据16S rDNA 鉴定细菌的标准,鉴定 B4、C4、C23、C25、C28、C33、C41为洋葱伯克霍尔德菌(Burkholderia cepacia);C3和C8为枯草芽孢杆菌(Bacillus subtilis);C27菌株可能存在着复杂的高级结构,无法精确地测定出其16S rDNA的全部序列,有待于用另外的细菌鉴定手段进行鉴定(表2)。
2.4 拮抗细菌抗利福平突变体的诱导
观察10个拮抗菌株抗利福平突变体的培养性状,及各个突变体在平板中对松苗猝倒病病原菌的拮抗效果,各个菌株突变体与原始菌株培养性状基本相同,计算抑菌率亦无显著差异。以抗利福平突变体进行湿地松体内拮抗菌株的定殖检 测是可行的。
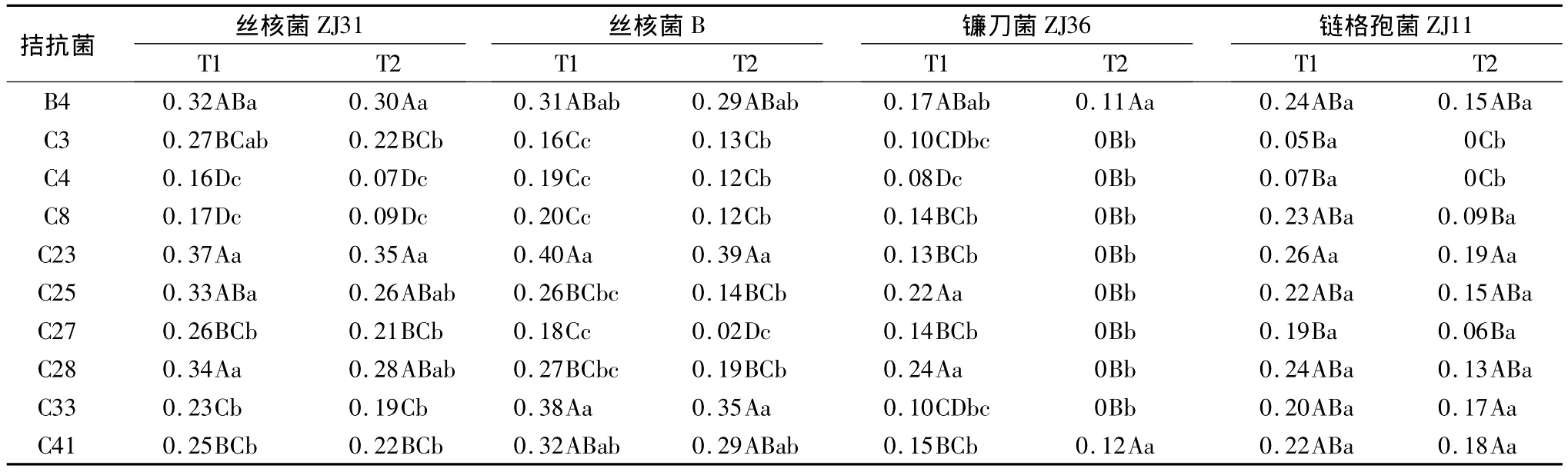
表1 拮抗菌抑制指数的多重比较结果

表2 生防菌株与其同源菌株的16S rDNA同源性及其碱基差异
2.5 拮抗细菌的防治试验
室内防治试验中,土壤为取自湿地松苗圃的未经灭菌的土。浸过供试拮抗菌的湿地松苗种植15d后,7种供试菌表现出一定的防病效果,用 B4、C4、C8、C23、C27、C33、C41 浸过的松苗成活率分别为87.3%、62.5%、60.5%、75.0%、65.4%、66.4%、84.3%,均大于对照的56.1%,其中B4和C41与对照差异极显著。而用C3、C25和C28浸过的松苗成活率均小于对照,分别为54.7%、55.8%、52.2%(表3)。
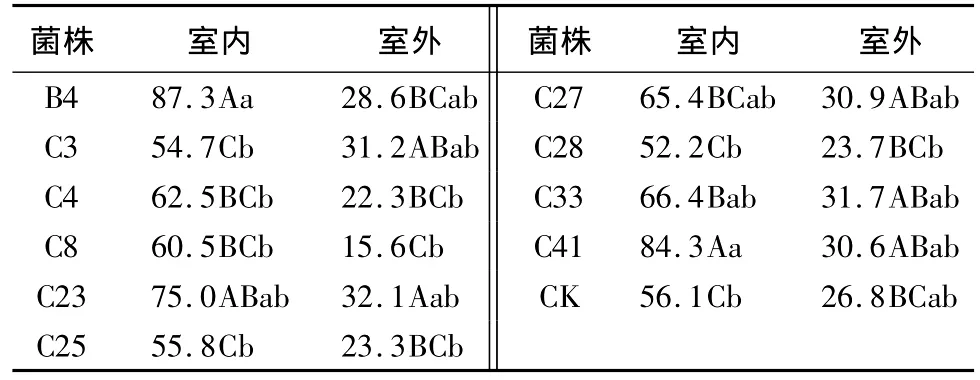
表3 拮抗菌株浸根后的松苗种植15d的成活率 %
室外防治试验中,无论是否用菌液处理过成活率均不高,但用 B4、C3、C23、C27、C33、C41 处理过的湿地松幼苗成活率高于对照,其中C23与对照的差异性达到显著水平。而C4、C8、C25、C28的成活率均低于对照,但差异性不显著。
2.6 拮抗细菌在根际的定殖
2.6.1 各个菌株在湿地松苗根部不同根段的分布
在湿地松幼苗接种拮抗菌后的近1个月内,从根的不同部位均可分离到所接种的菌株。从表4可以看出:10个拮抗菌株都可在湿地松幼苗根部定殖,并随着根的生长而扩展,但无规律。C3、C4、C28和C33在湿地松苗根基部的密度大于根尖部的密度,但差异不明显。而 B4、C8、C23、C25、C27和C41在根尖的密度大于根基部密度,而C4、C23在根中间的密度大于根尖和根部的密度。
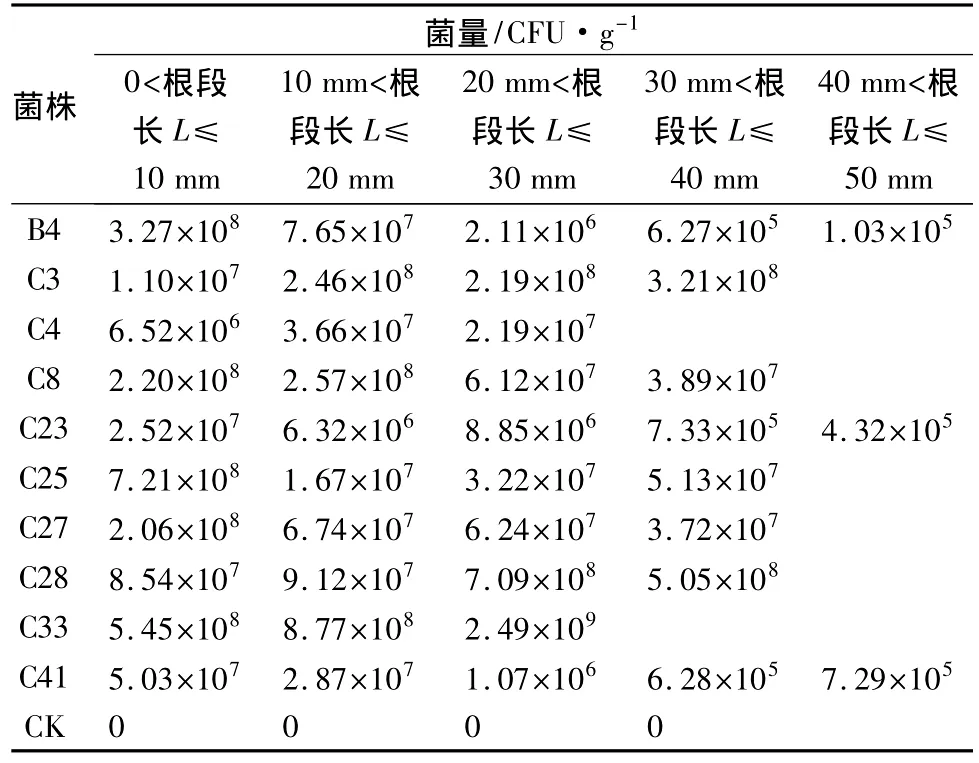
表4 定殖25d时各菌株在湿地松苗根部不同根段上的分布
2.6.2 各个菌株在湿地松苗根部的定殖动态
在3个月的试验期内,10个拮抗菌株在湿地松幼苗根际的定殖密度差异很大,但定殖的动态基本相似,均是在定殖后菌群密度逐渐增加,并在达到某一峰值后逐渐下降。C25定殖时的初始菌密度为2.5×104CFU/g,15d时菌群密度略有下降(1.7×104CFU/g),但随后菌群密度逐渐增加,并在60d时达到峰值3.2×108CFU/g,然后又逐渐下降。C28的菌群密度变化趋势与C25基本相同。B4、C4和C23的菌量密度峰值出现在第75天,C3、C25、C27、C28和C41的菌量密度峰值出现在第60天,而C8和C33的峰值出现在第45天(表5)。
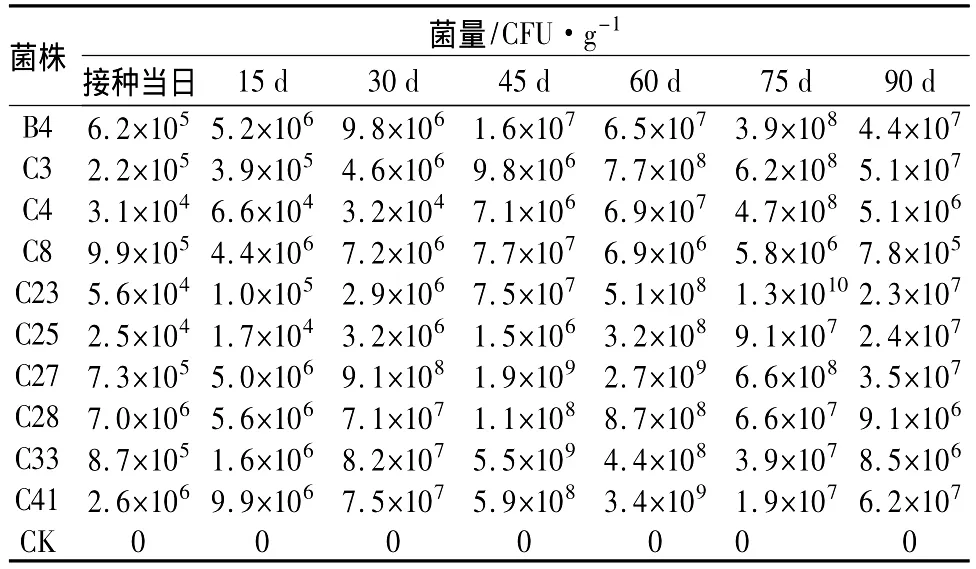
表5 拮抗菌株在湿地松幼苗根际定殖的动态
3 讨论
通过平皿拮抗试验,从320个湿地松根际分离物中筛选出27株对湿地松猝倒病具有一定抑制效果和防治作用的菌株。其中12株具有弱拮抗性,5株具有中拮抗性,10株具有强拮抗性。经16S rDNA序列测定,10株强拮抗性菌株中,7株为洋葱伯克霍尔德菌,2株为枯草芽孢杆菌,1株无法精确测定出16S rDNA的全部序列。洋葱伯克霍尔德菌和枯草芽孢杆菌是当前国内外研究比较多且具有开发潜力的2种菌,已有研究人员利用枯草芽孢杆菌开发出生防药剂,用于生产实践。但是,利用洋葱伯克霍尔德菌进行生物防治还处于试验研究阶段。
为了让拮抗菌更好地附着于幼苗根部,用菌液浸泡后在无菌操作台上晾3~5min,这个过程可能会造成湿地松幼苗失水,生命力下降,这可能是造成室内、室外防治试验中,无论处理过的幼苗还是对照成活率都不高的原因。室内防治试验中,B4和C41表现出相对较好的防治效果,与对照差异极显著。但在室外防治试验中,只有C23表现出显著的防治效果,其它9个菌株的防治效果与对照相比差异不显著。这可能与室内、外的试验环境有关,室内防治试验于实验室内进行,温度、湿度、光照比较稳定,且无不利的天气情况影响;而室外试验时,温度、湿度、光照、风速变化较大,并且在试验其间下过3次雨,没有及时排水。
定殖试验显示,10个菌株均可以湿地松根际定殖,分布无规律,这与荧光假单胞菌在湿地松幼苗根际定殖时的结果相似[5],但与哈茨木霉在辣椒根际定殖时总是根尖部位菌量最多不同[12]。在定殖前期,除C25和C28外,其余8个菌株在湿地松根部的密度均随着时间的推移而增加,并在某一时间达到峰值后逐渐下降,这与褐球固氮菌YKT41和伯克霍尔德菌B418在小麦根际定殖时的规律相似[13],但与B296在小麦根际定殖时数量逐渐减少不同[14],这种菌量变化趋势的不同可能与菌株本身、寄主、环境有关,具体原因有待于进一步的试验来揭示。
[1] 陈有民.园林树木学[M].北京:中国林业出版社,1990.
[2] 霍宪起,陈京元,雷清虎,等.1种松苗猝倒病的病原鉴定及其生物学特性观察[J].华中农业大学学报,2006,25(6):606-609.
[3] McKellar M E,Nelson E B.Compost-induced suppression of Pythium damping-off is mediated by fatty-acid-metabolizing seed-colonizing microbial communities[J].Applied and Environmental Microbiology,2003,69(1):452-460.
[4] Islam M T,Hashidoko Y,Deora A,et al.Suppression of dampingoff disease in host plants by the rhizoplane bacterium Lysobacter sp.strain SB-K88 is linked to plant colonization and antibiosis against soilborne peronosporomycetes[J].Applied and Environmental Microbiology,2005,71(7):3786-3796.
[5] 霍宪起,陈京元.4种荧光假单胞菌拮抗菌株对湿地松猝倒病病原菌的抑制效果[J].东北林业大学学报,2010,38(9):108-109,115.
[6] 方中达.植病研究方法[M].3版.北京:中国农业出版社,1998.
[7] 李德葆,周雪平,许建平,等.基因工程操作技术[M].上海:上海科学技术出版社,1996.
[8] McSpadden Gardener B B,Weller D M .Changes in populations of rhizosphere bacteria associated with take-all disease of wheat[J].Appl Environ Microbiol,2001,67(10):4414-4425.
[9] 卢圣栋.现代分子生物学实验技术[M].北京:中国协和医科大学出版社,1999.
[10] 乔纳森·佩夫斯纳.生物信息学与功能基因组学[M].孙之荣,译.北京:化学工业出版社,2006.
[11] 张兴锋,陈振明,何红,等.红树植物内生海洋细菌CⅢ-1在植物体内及根际土壤中的定殖测定[J].中国农学通报,2007,23(2):384-388.
[12] 鲁海菊,刘云龙.哈茨木霉强根际定殖能力菌株的筛选[J].中国生物防治,2008,24(2):138-142.
[13] 李纪顺,杨合同,陈凯,等.两株多功能生防细菌在小麦根际定殖及其对小麦病害的防治效果[J].山东农业科学,2005(4):38-39.
[14] 钱圆,王振跃,刑小萍,等.小麦纹枯病生防细菌筛选及其定殖特性研究[J].河南科学,2007,25(3):420-422.
Screening and Colonization of Antagonistic Bacteria Against Damping-off of Slash Pine Seedlings
/Huo Xianqi(School of Life Sciences,Linyi University,Linyi 276005,P.R.China)//Journal of Northeast Forestry University.-2011,39(7).-86~88,119
Slash pine;Damping-off;Antagonism;Bacteria
S763.15;Q939.92
1)国家林业局“948”项目(2003-4-39);湖北省国际科技合作重点项目(2007CA022);国家外专局项目(Y20080327002)。
;霍宪起,男,1977年1月生,临沂大学生命科学学院,讲师。
2011年1月2日。
责任编辑:程 红。
Twenty seven strains of bacteria with obviously antagonistic ability to pathogens of damping-off were screened out from 320 strains isolated from the soil near the roots of slash pine by the dual culture method.Then ten strains with strong antagonistic ability were selected out in accordance with the determination result of inhibition index.They were identified by 16S rDNA sequencing.Results show that seven isolates of B4,C4,C23,C25,C28,C33 and C41 are Burkholderia cepacia,two isolates of C3 and C8 are Bacillus subtilis,and C27 is an unknown species.B4 and C41 showed prominent control effects in the indoor experiment,while C23 showed a prominent control effect in the outdoor experiment.Ten strains could be colonized in the roots of slash pine,but the distribution of the ten strains was irregular in different parts of the root system.In the process of colonization,the quantity of the ten strains kept rising over time.At a certain hour,the amount of the ten antagonistic strains would reach a peak,then gradually reduced.
