产纤维素酶霉菌的筛选及初步鉴定
陈 燕,王小芬,金 伟,胡申才,曾 驰
(武汉工业学院生物与制药工程学院,湖北武汉430023)
产纤维素酶霉菌的筛选及初步鉴定
陈 燕,王小芬,金 伟,胡申才,曾 驰
(武汉工业学院生物与制药工程学院,湖北武汉430023)
在长期有腐烂植物的潮湿处采集8种样品,用羧甲基纤维素液体培养基富集培养,分离得到34株产纤维素酶的霉菌。利用刚果红染色法对所得菌株进行染色并以水解圈/菌落直径大小为筛选标准进行初筛,得到11株菌。再用DNS法测定初筛所得菌株发酵液中纤维素酶的活力,得到两株纤维素酶活性较高的菌株wx0503、wx1005,其发酵液纤维素酶活力分别可达31.31 U/mg、47.46 U/mg。此外,用苏丹混合液染色法对初筛所得到的产纤维素酶菌株染色,镜检观察其产油脂情况,得到2株产油量较大的纤维素酶产生菌株wx0403、wx1007。
纤维素酶;真菌;酶活;油脂
纤维素是由葡萄糖残基以β-1,4糖苷键连接而成的高分子聚合物[1]。纤维素是生物圈里最丰富的有机物质,是植物细胞壁的主要成分,也是绿色植物光合作用的主要产物[1]。全世界每年产生的纤维素大部分以焚烧的形式处理掉,这不仅造成大量资源的浪费还造成环境污染。纤维素完全降解后的产物葡萄糖是食品、饲料、燃料和化学原料的重要来源。假如人类掌握了经济的水解纤维素的技术,不但可以提高纤维素的利用率,而且还可以减少森林工业、农业、造纸工业、木材加工业以及纺织工业所产生的废料对自然环境的污染。近几年来,随着人口增长、粮食短缺、石油危机的出现,将纤维素水解为小分子单糖再通过微生物发酵生产各种有用的产品显得尤为重要[1]。
纤维素酶是将纤维素水解成纤维二糖和葡萄糖的一种复杂酶系,又称纤维素酶系[2]。纤维素酶的种类繁多,来源也很广。大多数纤维素酶主要来自微生物体[2]。目前,人们对各种微生物(包括真菌和细菌)的纤维素酶的关注较多,尤其是源于真菌的纤维素酶。所有能分解微晶纤维素的真菌,均能或多或少地分泌纤维素酶,所以纤维素酶的真菌源非常广泛。而真菌中的霉菌由于纤维素酶产量高、活性高,因此成为目前纤维素酶的主要生产菌种[2]。发展具有自主知识产权的产纤维素酶霉菌菌种是近年来的研究热点。
本研究使用羧甲基纤维素液体培养基富集培养环境样品,分离得到34株产纤维素酶的霉菌。使用刚果红染色初筛和DNS法复筛,得到2株纤维素酶活较高的霉菌菌株wx0503、wx1005。同时还使用苏丹混和液染色检测初筛所得到的产纤维素酶菌株,筛选得到2株纤维素酶活与产油量均较高的霉菌菌株 wx0403、wx1007。
1 材料与方法
1.1 样品、参照菌株、培养基与试剂
样品:采集不同来源的10份样品,编号(来源)分别为wx01(钟祥竹林)、wx02(钟祥棉秆)、wx03(钟祥柴堆)、wx04(钟祥稻草堆)、wx05(枣阳树林)、wx06(枣阳柴堆)、wx07(武汉土豆)、wx08(武汉茶叶)、wx09(武汉生菜)、wx10(武汉芹菜)。
参照菌株:020219,020408,本实验室保藏。
培养基:PDA培养基[3]、羧甲基纤维素培养基[4]。如配固体培养基则另外添加总重1.5%的琼脂粉。
试剂:刚果红染色试剂(刚果红染色液、NaCl脱色剂)[5]、DNS法测羧甲基纤维素钠发酵液酶活力所用试剂[4]、苏丹混和染液[5]。
1.2 样品采集、产纤维素酶真菌的富集与分离
在湿润且含有大量腐烂植物的环境采集样品,接种到加有青霉素(100×10-6)和庆大霉素(20×10-6)的羧甲基纤维素钠液体培养基中,28℃摇床培养。将培养液系列稀释后涂布PDA固体培养基平板(加入庆大霉素 20×10-6,青霉素 100×10-6抑制细菌生长)上,28℃培养2—3 d,分离得到霉菌菌株。
1.3 可降解纤维素真菌的初筛方法(刚果红染色)
向长有霉菌的羧甲基纤维素钠固体培养基平板上加入浓度为0.5%的刚果红溶液3 mL,染色30 min,然后依次用蒸馏水和1 mol/L的NaCl溶液彻底洗去染液,再用5%(m/v)的醋酸固定颜色。若霉菌产生纤维素酶,则在菌落的周围会出现清晰的透明圈。以透明圈直径与菌落直径之比的大小为参考指标对菌株进行初筛:比值大的证明该菌株的纤维素酶产量高;反之,则证明该菌株的纤维素酶产量低,可以将其剔除掉。
1.4 可降解纤维素真菌的复筛
将参照菌株及初筛获得的纤维素钠水解圈/菌落直径比值较大的菌株接种到PDA培养基上,28℃培养4—5 d进行活化,之后接种到30 mL(250 mL三角瓶)PDA液体培养基中,于28℃ 、180 r/min下摇床发酵,3 d后取样测定上清发酵液中的CMC酶活力。
1.5 DNS法测CMC酶活
本实验将酶活力定义为:在适当的温度和pH值条件下,每1 min水解相应的底物转化成1 mg还原糖的酶量定义为1个酶活力单位(U)。方法:在试管中加入0.2 mL的粗酶液,2 mL的CMC液(浓度为1%)和2 mL的醋酸缓冲液(pH为4.8),40℃水浴1 h。接着往试管中加入DNS显色液2 mL,再放进沸水中水浴10 min,然后定容到15 mL,最后用分光光度计测其在540 nm下的OD值。
计算纤维素酶类的活性单位依据以下公式:

式中x:样品OD值的平均值;b、a:由葡萄糖浓度和相应的OD值通过回归方程求得;n:酶液的稀释倍数;T:酶促反应的时间;0.2:所加酶液的量。
1.6 产油脂的纤维素酶产生菌检测
近几年来产油微生物的研究越来越引起人们的关注。如果一株菌既产纤维素酶又产油脂,那么它的应用价值将会大大提高。因此本文也对筛得的产纤维素酶真菌进行了产油脂的检测。所用的方法为苏丹混和液染色法[5]。
苏丹混合液染色法:取PDA液体培养基发酵培养的菌丝少许,置10 mL小烧杯中,吸干液体培养基,加人苏丹混和液1—2 mL于室温染色5 min,取出菌丝于水中洗涤5 min,挑取菌丝制作临时装片,镜检观察。根据油滴颗粒大小及密集程度作出产油量(以+来评价产油量)的评价,同时作好菌丝体形态的观察记录。对镜检评价为++以上的菌株,转入斜面培养基上,冷藏保种。
2 结果与分析
2.1 可降解纤维素霉菌的分离
将采集的样品接种到CMC-Na液体培养基中富集培养,经分离纯化后共得到34株产纤维素酶的霉菌。所得的菌株如表1所示。

表1 分离得到的可降解纤维素霉菌
2.2 刚果红初筛的结果
刚果红法是目前公认的鉴别真菌是否产纤维素酶的有效方法[5]。刚果红染色初筛得到生长迅速且透明圈直径/菌落直径大的菌株有 wx0101、wx0305、wx0402、wx0503、wx0602、wx0603、wx0604、wx0904、wx1005、wx1006、wx1007,共11 株。
2.3 DNS法测定粗酶液中CMC酶活力的大小
将初筛得到的菌株用PDA液体培养基进行发酵,用DNS法测定发酵液的CMC酶活力,发现菌株wx0503、wx0603、wx1005等菌株的酶活力都比实验室保存的参照菌株020219和020408大。结果见表2。
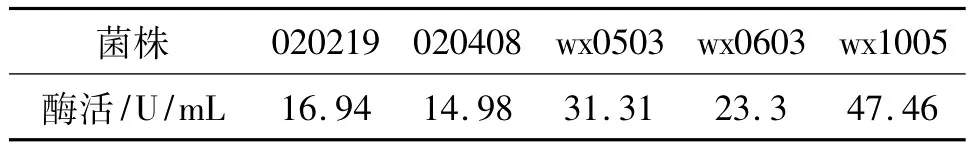
表2 纤维素酶活力
2.4 产油脂检测
对刚果红初筛的菌株进行产油脂的检测,并对产油情况进行评价。评价结果如表3。油滴多少分别以+++、++、+、<+表示。

表3 菌株产油脂检测结果
2.5 菌株形态观察
对筛得的纤维素酶活力最高的2株菌株——wx0503和wx1005、纤维素酶活与产油量均较高的2株菌株——wx0403和wx1007进行显微镜观察并拍照,结果见图1。从图片中可以清晰地看见纤维素酶活与产油量均较高的2株菌株菌丝间有大量的黄色油滴。

图1 菌株形态观察
3 讨论
本研究中观察到一种现象——并不是在CMC-Na培养基上长的最好(就是菌落直径最大)的菌株其刚果红染色水解圈最大,DNS法所测得的纤维素酶活力最高,可能的原因是有些菌所产生的纤维素酶为胞内酶。这对酶活力是一个很好的解释,但用于解释刚果红染色水解圈就有些牵强了。
研究中还遇到另一个问题:在用刚果红做染色鉴定时,我们首先尝试将能在CMC-Na培养基上生长的菌直接接种到纤维素-刚果红培养基(配方为:CMC-Na 2.0 g,(NH4)2SO42.0 g,MgSO4·7H2O 0.5 g,K2HPO41.0 g,NaCl 0.5 g,刚果红0.4 g,水1000 mL,琼脂20 g)平板培养。结果所接种的菌大部分无法生长,有生长的菌株也没产生预期的明显的水解圈。因此我们设计了2组平行实验,一组是将菌接种到纤维素-刚果红培养基(即在CMC-Na培养基配方中增加了0.4 g/L的刚果红)固体平板上培养,另一组是将菌接种到CMC-Na培养基上,然后用刚果红染色法进行染色鉴定。理论上刚果红鉴定培养基和刚果红染色法均应看见水解圈,但实际上菌株在加了刚果红的培养基上的生长情况同纤维素-刚果红培养基,而后一种方案确实达到了预期效果——菌株生长状况较好,经染色后也都出现了水解圈。原因可能是所加入的刚果红抑制了菌株对CMC-Na的利用,从而影响菌株的生长。
[1] Bhat M K,Bhat S.Cellulose degrading enzymes and their potential industrial applications[J].Biotechnol Adv,1997,15(3-4):583-620.
[2] Bayer E A,Lamed R,Himmel M E.The potential of cellulases and cellulosomes for cellulosic waste management[J].Curr Opin Biotechnol,2007,18(3):237 -245.
[3] 沈萍,范秀容,李广武.微生物学实验(第三版)[M].北京:高等教育出版社,1999.
[4] 高克学,郭润芳,于宏伟,等.蚀木链霉菌KX6耐热内切葡聚糖酶的产生及酶学性质研究[J].中国生物工程杂志,2009,29(5):83-88.
[5] 岳思君,李学斌,李爱华,等.高酶活纤维素分解菌分离筛选的研究[J].安徽农业科学,2009,37(1):11 -12,15.
Screening and characterization of cellulase-producing fungi strains
CHEN Yan,WANG Xiao -fen,JIN Wei,HU Shen -cai,ZENG Chi
(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
In this study,eight samples were collected from moist environments with plants decaying,in which thirty-four cellulase-producing fungi strains were isolated through enrichment culturing by CMC-Na liquid medium.These cellulase-producing fungi strains were then screened using congo red staining and eleven strains producing big hydrolysis circle were selected.Subsequently,the DNS method was employed to screen the selected strains.Two strains,wx0503 and wx1005,were shown to produce the highest cellulase activity,which were 31.31 U/mg and 47.47 U/mg,respectively.Besides,sudan mixture staining was performed to evaluate the oil production by the cellulase-producing strains and two strains,wx0403 and wx1007,were selected.
cellulase;fungi;enzyme activity;oil
Q 939.96
A
1009-4881(2011)03-0006-03
10.3969/j.issn.1009-4881.2011.03.002
2011-04-08.
陈燕(1990 -),女,本科生,E -mail:541565140@qq.com.
曾驰(1980 -),男,讲师,E -mail:zeng_chi@yahoo.com.cn.
湖北省教育厅科学项目(B20111701);武汉工业学院校立科研项目(2009Q08);武汉工业学院校级大学生创新性实验计划项目(CX200909).

