长白山区常见药用植物中常规成分的检测及其活性扫描
张涛, 朴艳, 赵萍, 李熙峰
(长白山生物资源与功能分子教育部重点实验室(延边大学),吉林延吉133002)
长白山区常见药用植物中常规成分的检测及其活性扫描
张涛, 朴艳, 赵萍, 李熙峰*
(长白山生物资源与功能分子教育部重点实验室(延边大学),吉林延吉133002)
利用高效液相色谱法(HPLC法)对长白山地区常见的100种药用植物中芦丁、槲皮素、金丝桃苷、山柰酚、齐墩果酸、熊果酸、β-谷甾醇等常规成分的含量进行定性定量分析,并且对这些药用植物提取物的DPPH自由基清除活性和酪氨酸酶抑制活性进行了扫描.结果显示:芦丁、槲皮素、金丝桃苷、山柰酚、齐墩果酸、熊果酸、β-谷甾醇的最高含量分别达到了1.39%、0.34%、1.11%、0.13%、3.12%、12.06%和 7.13%;对酪氨酸酶的抑制率在50%以上的有30种,对DPPH的抑制率在80%以上的有83种.实验表明,本分析方法简便、快捷、准确、可靠,可为长白山地区常见的药用植物的开发提供基础实验依据.
常规成分;长白山地区;高效液相色谱法;含量测定;活性扫描
0 引言
长白山地区植物资源非常丰富,其中药用植物就达约900余种(包括低等植物)[1],对这些药用植物开发一直是国内外研究的热点.邹盛勤、郑珺等[2-3]先后建立了同时测定齐墩果酸、熊果酸和槲皮素、山奈酚的分析方法;刘之力、王继龙等[4-5]分别对54味中药乙醇提取物和16种长白山野生植物提取物对酪氨酸酶活性抑制作用的进行了研
究.有关同时测定植物中芦丁、槲皮素、金丝桃苷、山柰酚、齐墩果酸、熊果酸、β-谷甾醇常规成分的分析方法以及对长白山区常见药用植物提取物的DPPH自由基清除活性及酪氨酸酶抑制活性尚未有文献报道.本文以长白山区常见的100种药用植物做实验样品,对这些药用植物进行常规成分的含量分析,并对这些植物提取物的DPPH自由基清除活性及酪氨酸酶抑制活性进行了扫描,为研究长白山常见药用植物中常规成分的定量分析和活性信息分析提供基础实验依据.
1 实验部分
1.1 仪器与试剂药品
Agilent 1100高效液相色谱仪(美国安捷伦公司);VersaMax型酶标仪(美国分子仪器公司);色谱柱为Hypersil GOLD C18(250mm×4.6 mm,5μm);电子天平(德国 SARTORIUS公司/BT224S型);超声波清洗器(ASCIENCE公司/AS3120B型);0.45μm微孔滤膜;芦丁、槲皮素、金丝桃苷、山柰酚、齐墩果酸、熊果酸、β-谷甾醇(上海源叶科技有限公司);甲醇(色谱纯);乙酸(分析纯);蒸馏水;市售中药.
1.2 色谱条件
测定熊果酸、齐墩果酸和β-谷甾醇的含量时,采用水为流动相A,甲醇为流动相B,流速为1.0 mL/min;检测波长为210 nm,柱温为室温;进样量为5μL.洗脱程序为:0~10 m in,90%B;10~11 min,90%~100%B;11~33 min,100%B;33~35min,100%~90%B;35~50min,90%B.测定芦丁、槲皮素、金丝桃苷、山柰酚的含量时,采用0.5%的CH3COOH溶液为流动相A,甲醇为流动相B,流速为0.8 m L·min-1;检测波长为350 nm;柱温为室温;进样量为 5μL.洗脱程序为:0~2 m in,45%B;2~15 m in,45%~60%B;15~20min,60%B;20~30min,60%~100%B;30~40 m in,100%B;40~45 min,100%~45%B;45~50min,45%B.
1.3 溶液的配制
1.3.1 标准品溶液的配制 精密称取标准品芦丁、槲皮素、金丝桃苷、山柰酚、熊果酸、齐墩果酸和β-谷甾醇各5 mg,用甲醇溶解制成浓度为0.1 mg/m L的溶液,0.45μm滤膜过滤,即得标准品溶液,备用.
1.3.2 样品溶液的配制 分别称取3份干燥的植物样品约10 g,加入30mL甲醇,超声提取3次(每次20m in),过滤,收集提取液,合并3次提取液,浓缩干燥得提取物.精密称取适量提取物,用甲醇溶解,制成10 mg/mL的溶液,0.45μm滤膜过滤,即得样品溶液,备用.
1.4 精密度实验
精密吸取浓度为0.1 mg·m L-1的齐墩果酸、熊果酸、β-谷甾醇标准品混合溶液和芦丁、槲皮素、金丝桃苷、山柰酚标准品混合溶液5μL进样,连续进样4次,测定峰面积.计算得齐墩果酸、熊果酸、β-谷甾醇、芦丁、槲皮素、金丝桃苷和山柰酚面积的RSD分别为 0.5%、0.3%、0.4%、0.7%、0.5%、0.1%、0.2%,这表明仪器精密度良好.
1.5 样品含量测定
精密吸取植物样品甲醇溶液5μL注入高效液相色谱仪中,分别测定芦丁、槲皮素、金丝桃苷、山柰酚、熊果酸、齐墩果酸和β-谷甾醇的色谱峰峰面积,按照公式(1)计算植物样品中芦丁等常规成分的含量.

1.6 样品活性扫描
1.6.1 自由基清除实验 将干燥的植物样品提取物配制成1 mg/m L的甲醇溶液,向微孔板中移取160μL样品和 40μL DPPH(1.5×10-4mol/L),平行样品为3个.阳性参照物选用0.1 mL/min维生素C,对照溶液为160μL甲醇和40 μL DPPH混合液,点样完毕后在室温下反应30 min,用酶标仪在520 nm下测其吸光值.按照公式(2)计算其抑制率.
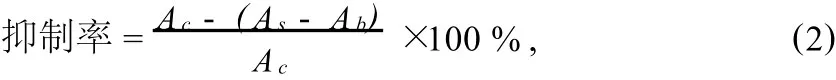
式中Ac为对照溶液吸光度,As为样品溶液吸光度,Ab为空白溶液吸光度.
1.6.2 酪氨酸酶抑制活性实验 精密称取1 m g干燥的植物样品提取物,溶于50%DMSO溶液中,配制成1mg/m L的样品溶液.分别移取40μL样品、40μL 酪氨酸溶液、80μL Na2HPO4-NaH2PO4缓冲溶液及40μL酪氨酸酶溶液于微孔板中,平行样品为3个.阳性参照物选用0.1 mg/mL曲酸溶液,对照溶液为40μL 50%DMSO溶液、40μL 酪氨酸溶液、80μL Na2HPO4-NaH2PO4缓冲溶液及40μL酪氨酸酶溶液的混合液.在37℃下反应30 min后在475 nm下测其吸光值.抑制率按照公式(2)计算.
2 结果与讨论
2.1 样品的提取
本实验采用常用的有机溶剂提取法.在室温条件下,分别用甲醇、丙酮、70%丙酮溶液浸泡植物样品多次,每次超声提取20 min,浓缩干燥称重.经计算,甲醇的提取率为49.4%,丙酮的提取率为5.0%,70%丙酮溶液的提取率为17.6%,由此可知甲醇为最佳提取溶剂.
2.2 流动相的选择
本实验在测定芦丁、槲皮素、金丝桃苷、山柰酚的含量时,选用甲醇-0.5%CH3COOH溶液体系以及各种不同的梯度洗脱方案,而在测定齐墩果酸、熊果酸、β-谷甾醇的含量时,使用了甲醇-水体系以及各种不同的梯度洗脱方案进行洗脱.结果显示,在本实验所采用的流动相以及梯度洗脱程序条件下(1.2色谱条件),分离效果最佳,样品的色谱峰达到了基线分离,得到的色谱峰峰形对称.每次运行梯度后,柱平衡至少需要10 m in[6].
2.3 检测波长的选择
经HPLC-DAD检测器检测,在1.2色谱条件下,在吸收波长200~400 nm区间进行扫描.从中找出最大吸收波长,并且在此吸收波长下混合标准溶液的色谱峰分离效果最佳,达到了基线分离,由此确定熊果酸、齐墩果酸和β-谷甾醇的检测波长为210 nm[7],芦丁、槲皮素、金丝桃苷、山柰酚的检测波长为350 nm[8].
2.4 植物样品含量测定结果
由于本实验所选用的芦丁、槲皮素、金丝桃苷、山柰酚、齐墩果酸、熊果酸、β-谷甾醇等7种标准品均是活性较好的化合物,因此本文选用了这7种标准品做为常规成分含量的分析,测定结果见表1.

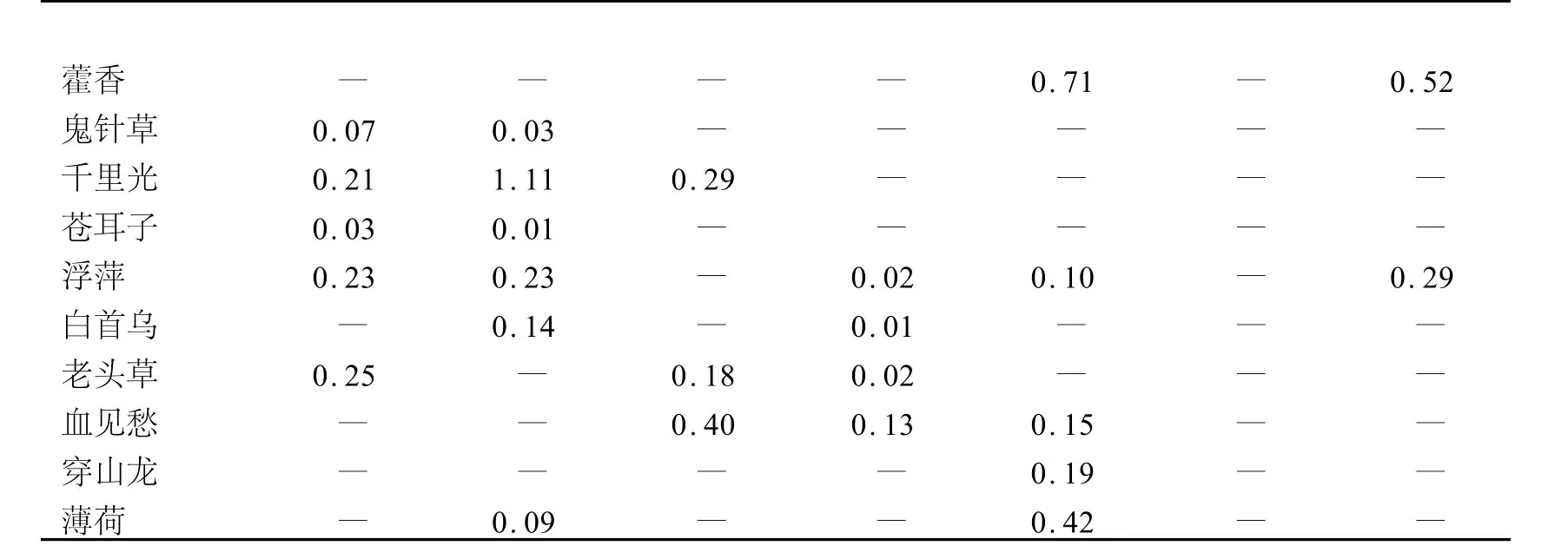
表1 植物样品中芦丁、槲皮素、金丝桃苷、山柰酚、齐墩果酸、熊果酸和β-谷甾醇的含量 %

续表1_________________________________________________________________________
续表1__________________________________________________________________________
由表1可知,芦丁的含量在0.02%~1.39%之间的植物样品有32种,其中肉芙蓉中含量最高;槲皮素的含量在0.01%~0.34%之间的有22种,血见愁中含量最高;金丝桃苷的含量在0.01%~1.11%之间的有47种,千里光中的含量最高;山柰酚的含量在0.01%~0.13%的有19种,血见愁中的含量最高;齐墩果酸的含量在0.08%~3.12%之间的有26种,山楂中的含量最高;熊果酸的含量在0.05%~12.06%之间的有21种,山楂中的含量最高;β-谷甾醇的含量在0.13%~7.13%之间的有28种,芦根中的含量最高.
2.5 植物样品活性扫描结果
对DPPH的清除实验结果和对酪氨酸酶的抑制实验结果见表2.表2表明:对酪氨酸酶的抑制率在50%以上的植物有30种,在30%~40%的有42种,其中土大黄提取物对酪氨酸酶的抑制率达到99.4%,而百合提取物仅为1.3%;DPPH的抑制率在80%以上的有83种,其中土大黄、尾叶香茶菜、旱莲草提取物对DPPH的抑制率均达到99.9%,而南沙参提取物仅为34.4%.
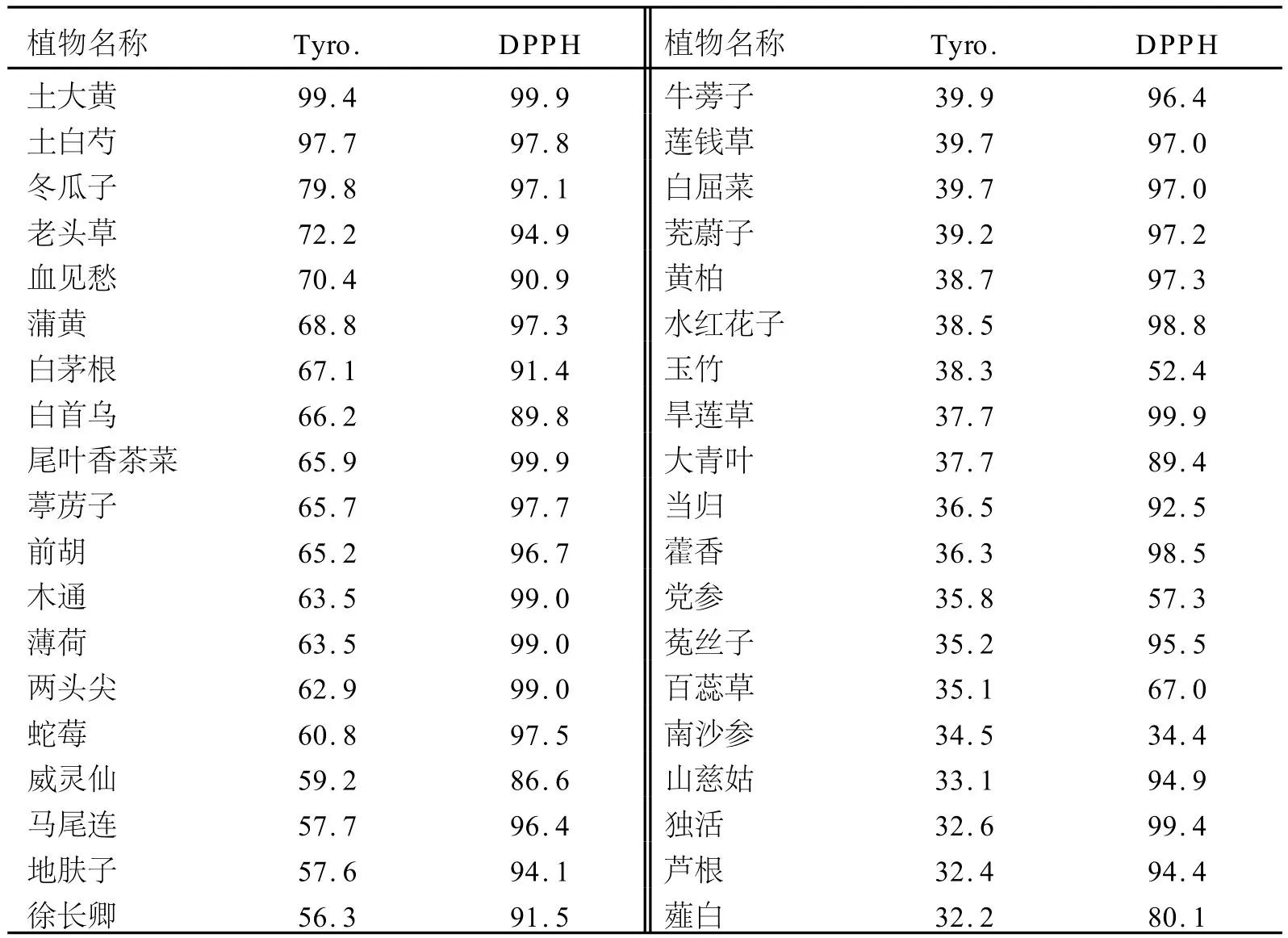
表2 药用植物样品提取物对DPPH及酪氨酸酶的抑制率 %

续表2_____________________________________________________________________
3 结论
本实验在室温条件下使用不同的有机溶剂对药用植物样品的提取工艺做了试验研究,通过对比提取率,筛选出甲醇为最佳提取溶剂.通过对流动相体系、流速、最大吸收波长等色谱条件的筛选,建立了简便、准确、可靠的高效液相色谱-紫外检测的分析方法,从而准确地测定了长白山地区常见药用植物样品中芦丁、槲皮素、金丝桃苷、山柰酚、齐墩果酸、熊果酸和β-谷甾醇等常规成分的含量,这些数据将为长白山地区常见的药用植物的开发提供基础实验依据.
[1]张继有,严仲铠,李海日,等.长白山植物药志[M].长春:吉林人民出版社,1982.
[2]邹盛勤,陈武.反相高效液相色谱法测定不同产地紫苏子和白苏子中乌索酸和齐墩果酸[J].生物加工过程,2008,6(4):65-68.
[3]郑珺,孙兰香,王紫秋,等.油菜花粉中槲皮素和山柰素总含量的 HPLC法测定[J].中国新药杂志,2005,14(5):592-594.
[4]刘之力,涂彩霞,史月君,等.54味中药乙醇提取物对酪氨酸酶活性抑制作用的研究[J].中国麻风皮肤病杂,2003,19(3):257.
[5]王继龙,李江楠,赵伟,等.16种长白山野生植物提取物对酪氨酸酶抑制作用[J].中国野生植物资源,2008,27(3):42-44.
[6]靳晓秋,陈黎.HPLC法同时测定野马追中金丝桃苷、槲皮素和山奈酚[J].中草药,2008,39(8):1254-1255.
[7]谢莹,杭太俊,程赞,等.高效液相色谱法测定中药中齐墩果酸和熊果酸含量[J].中国中药杂志,2001,26(9):615-616.
[8]郑一敏,胥秀英,杨艳红,等.HPLC测定菟丝子中金丝桃苷与槲皮苷的含量[J].华西药学杂志,2005,20(3):261-262.
The Detection of Component and Activity Scanning from Common Medicinal Plants in Changbai Mountain Area
ZHANG Tao, PIAO Yan, ZHAO Ping, L IXi-feng*
(KeyLaboratoryofNaturalResourcesoftheChangbaiMountain&FunctionalMolecules(YanbianUniversity),MinistryofEducation,Yanji133002,China)
U sing high perfo rmance liquid Chromatography(HPLC)to determine the content of rutin,quercetin,hyperoside,kaempferol,oleanolic acid,ursolic acid,β-sitosterol of the 100 species which were commonly used in traditional Chinesemedicine in Changbaimountain area.The DPPH radical scavenging activity and tyrosinase inhibito ry activity of extracts of these medicinal p lants were scanned.The inhibition rate of 83 kinds medicinal plants against DPPH radical are mo re than 80%,and 30 kindsmedicinal p lants against tyrosinase is above 50%.Experiments sho wthat the simple,fast,accurate and reliablemethod isestablished,and the basis experimental evidence is p rovided for the development of medicinal p lants in Changbaimountain area.
general components;Changbaimountain area;high performance liquid chromatography;content test;activity scanning
R284.1
A
1004-4353(2011)02-0165-06
2011-05-21
*通信作者:李熙峰(1969—),男,博士,教授,研究方向为天然物化学.

