小蜡树提取物多组分的同步结构分析方法研究
贺玖明, 刘影, 刘明韬, 张瑞萍, 石建功, 再帕尔·阿不力孜
(中国医学科学院/北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室,北京100050)
小蜡树提取物多组分的同步结构分析方法研究
贺玖明, 刘影, 刘明韬, 张瑞萍, 石建功, 再帕尔·阿不力孜*
(中国医学科学院/北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室,北京100050)
以小蜡树乙醇提取物为研究对象,基于不完全分离分析的策略,采用Sephadex LH-20凝胶柱色谱分离手段,获取了含量呈连续动态变化的系列混合物;运用NMR/LC-MS平行动态谱方法,对系列混合物中含有氢醌苷及苯乙醇苷类化合物的成分进行了快速结构分析.在小蜡树提取物M-9中,实现了12个成分无需完全分离的同步结构鉴定,其中4个成分为首次在本属植物中发现.本研究进一步拓宽了NMR/LC-MS PDS新型分析方法的应用范围.
NMR/LC-MS平行动态谱;不完全分离分析;小蜡树;苯乙醇苷;氢醌苷
0 引言
从中草药中发现新颖结构的活性成分,将其进一步开发成新药是推动中药现代化进程的重要内容.中草药发挥药效作用的物质基础是结构复杂、化学多样性的天然产物组分群,但传统的分析方法对其有效成分或活性分子群的发现率较低,而且需要的样品量大,提取分离及其鉴定耗时费力,还易导致微量活性或不稳定未知成分的丢失[1-3].近年来,随着各种联用技术的迅速发展,其在复杂混合物体系分析中的作用也越来越重要.高效液相色谱(HPLC)与质谱(MS)和核磁共振
谱(NMR)的联用技术,如 LC-MS/MS、LC-NMR及LC-MS-NMR等融合了高效分离和丰富结构信息获取的强大功能,实现了混合物复杂成分的高效、快速的分析鉴定[4-17],并且此类联用技术还具有“先分离、后分析”的特点.
针对复杂体系混合物的快速、准确分析,本课题组[18]提出了无需完全分离分析的研究策略,建立并发展了两种新型的谱学分析方法,即NMR/LC-MS平行动态谱(NMR/LC-MS parallel dynamic spectroscopy,NMR/LC-MS PDS)和异相关谱(NMR/LC-MS hetero-correlation spectroscopy,NMR/LC-MS HCS).该方法在不完全分离研究策略的基础上,结合化学计量学方法对系列混合物样品的LC-MS及NMR谱数据进行整合分析,从而发掘来自于同一成分的LC-MS及NMR谱数据的内在相关性,简化了复杂药用植物提取物的分离分析过程;在离线的情况下,通过“数学联用的方式”获得了与LC-MS-NMR联用技术相似的分析结果,最终实现了多组分无需完全分离且快速的分析鉴定,为复杂混合物中多组分的高效、快速结构分析提供了新的方法.目前,该方法已成功地应用于新疆维吾尔民族药用植物草棉活性提取物、常用中药连翘提取物和珍惜濒危药用植物福建金线莲中黄酮醇苷类、苯乙醇苷类和有机酸类等成分的分析中[18-21].
本研究在前期研究的基础上,以编号为M-9的小蜡树乙醇提取物为研究对象,采用Sephadex LH-20凝胶柱色谱分离手段,基于不完全分离分析的策略获取含量呈连续动态变化的系列混合物,然后运用NMR/LC-MS PDS方法,对系列混合物中含有氢醌苷及苯乙醇苷类化合物的成分进行了分析鉴定.
1 实验部分
1.1 仪器和试剂
仪器有:Agilent 1100系列高效液相色谱仪(A gilent Technologies,Waldbronn,Germany);美国AB公司QTRAPTM型四极杆-线性离子阱串联质谱仪,配有电喷雾离子源(ESI)及Analyst 1.4.2数据处理系统;美国 Varian公司 INOVA-600型核磁共振仪.试剂有:甲醇(色谱纯,Merk,德国);甲醇(色谱纯,天津永大化学试剂开发中心);水(娃哈哈纯净水);氘代二甲基亚砜,含0.03%(体积比)的四甲基硅烷(Cam bridge Isotope Labo rato ries,Inc.).
1.2 样品及其浓度呈连续动态变化的系列混合物的制备
编号为M-9的小蜡树提取物由中国医学科学院药物研究所石建功研究员的课题组提供.制备步骤为:小蜡树茎枝乙醇提取物经大孔树脂分离获得水洗脱部分,再经硅胶柱层析梯度洗脱得到流份;称取0.7 g提取物M-9,加入10%甲醇适量将其溶解,上样至Sephadex LH-20凝胶柱;以甲醇/水(体积比为10∶90)为洗脱液进行洗脱,从有颜色的流份开始收集,以每10 m L为一管收集并编号,共获得40个流份,备用.
1.3 测试条件
色谱条件:Extend-C18(4.6×250 mm,5μm,Agilent,USA)色谱柱;以水和乙腈为流动相进行梯度洗脱,在0~20min内,乙腈的比例从7%增加到10%;流速为0.7 m L/min;柱后3∶1分流(1/4进入质谱仪);紫外吸收检测波长为190~400 nm.
质谱条件:负离子检测方式(喷雾电压为-4.5 kV);DP电压(-70 V);EP电压(-10 V);源温度为375℃;GS1(雾化气)为65 arb;GS2(干燥气)为50 arb;碰撞能量(CE)为-15~-30 eV;扫描均选用线性离子阱(L IT)模式,速度为1 000Da/s;各种气路均为氮气.
1H-NMR谱测定条件:操作温度为298 K;采用z梯度三共振探头;操作软件为Varian Vnm r 6.0 C soft ware;1H-NMR谱测定的谱宽为-1~14 ppm(9 615 Hz);弛豫时间为20 s;采样时间为8.82 m in;采样次数为24次;采样数据点为64 K(65 536个数据点);1D TOCSY谱混合时间为120 ms;1H-1H COSY谱弛豫时间为1.3 s;NOESY实验的预饱和时间为1.6 s,混合时间为800ms.
1.4 LC-MSn及1 H-NMR谱的测定
LC-UV-MS及LC-MSn谱的测定:取上述经凝胶色谱分离获得的系列混合物流份,从每个流份中取出0.5 m L的溶液,经微孔滤膜过滤后进行LC-MSn谱分析,进样量为10μL.
1H-NMR谱的测定:LC-UV-MS谱的分析结果表明,提取物M-9中的组分主要分布在15~35号系列流份中.依据该分析结果,选取其中的18个流份,分别经旋转蒸发除去溶剂后,用适量甲醇溶液转移到5 mm的NMR谱用测试管中,用氮气吹干,然后加入0.5 m L氘代二甲基亚砜(DMSO-d6)溶解,进行1H-NMR谱测定.
1.5 原始数据处理
数据处理参照文献[18-20]进行.
2 结果与讨论
2.1 提取物M-9的LC-UV-MS谱分析
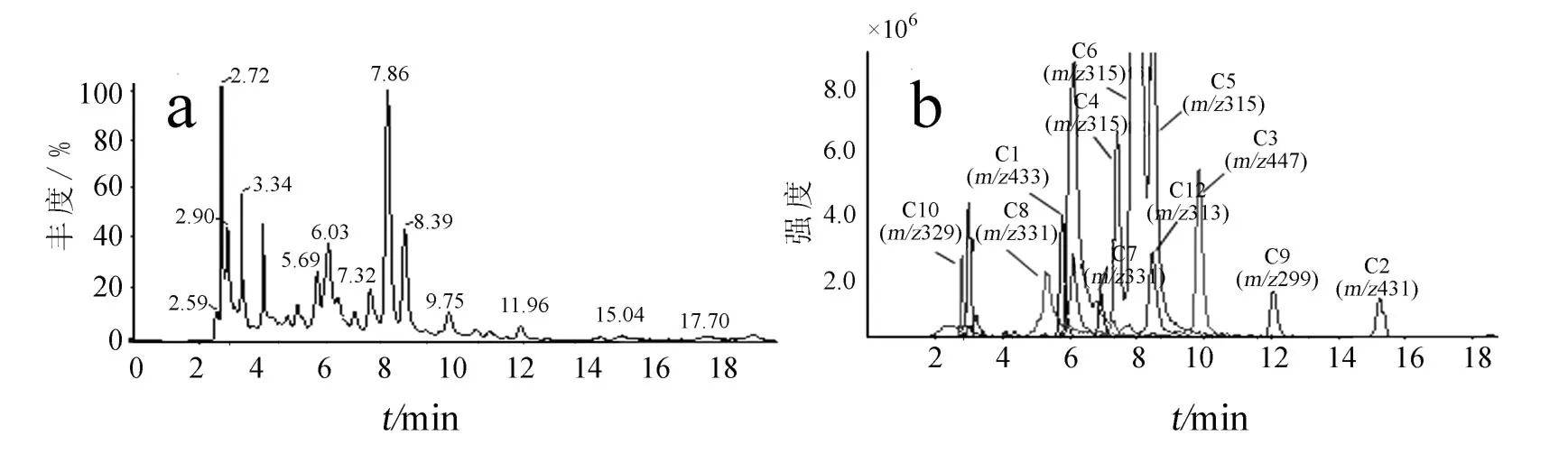
图1 a.提取物M-9的 UV 190~400 nm检测 HPLC谱;b.由提取物M-9中相关成分的[M-H]-离子获得的提取离子色谱图
图1a为提取物M-9的UV 190~400 nm检测 HPLC谱.从图中可以看出,该混合物所含组分较为复杂,各成分之间的相对含量差异较大,并且含有一些微量成分.考察这些组分的紫外吸收光谱发现,其最大紫外吸收峰位于200~220 nm之间,表现出苯环的结构特征.系列流份的LCMS谱分析结果表明,提取物M-9中主要有12个成分,按照这些成分在凝胶色谱柱上洗脱的顺序,将各成分编号为C1—C12.从提取物M-9的总离子流色谱图中提取各成分的[M-H]-离子,得到提取物M-9的提取离子色谱图(见图1b),从图中可以清楚地看到一组[M-H]-离子为m/z315的同分异构体.此外,由于各成分间的极性比较接近,即使在优化的 HPLC谱分离条件下,色谱峰的重叠仍然比较严重,这表明在常规分离条件下难以制备得到单体的化合物,因此,本研究采用NMR/LC-MS PDS方法力求解决这类复杂体系组分群的同步结构鉴定.
2.2 各成分在系列混合物流份中的分布情况
分别取上述12个成分在系列流份中的紫外吸收峰强度值,然后通过绘制折线图得到各成分在系列流份中的分布曲线,如图2所示(因成分C6的含量很高,为了清楚地显示其他成分的分布情况,该图中不包括成分C6的变化趋势).从图中可以看出,通过凝胶色谱柱的分离,这些成分被洗脱到不同的流份中,同时每个成分的含量在系列流份中呈动态变化,且成分间互相重叠,它们按不同的组成和含量比例构成了一系列不完全分离的混合物样品.这表明,凝胶色谱柱具有和闪式快速分离系统[18]、制备型液相色谱[19]相似的功能,它同样可以将复杂的粗提物制成组分含量呈动态变化的系列混合物流份.此外,凝胶色谱柱还具有上样量少、样品不易被吸附等优点,适合于分离制备少量的样品及结构中含酚羟基的组分.
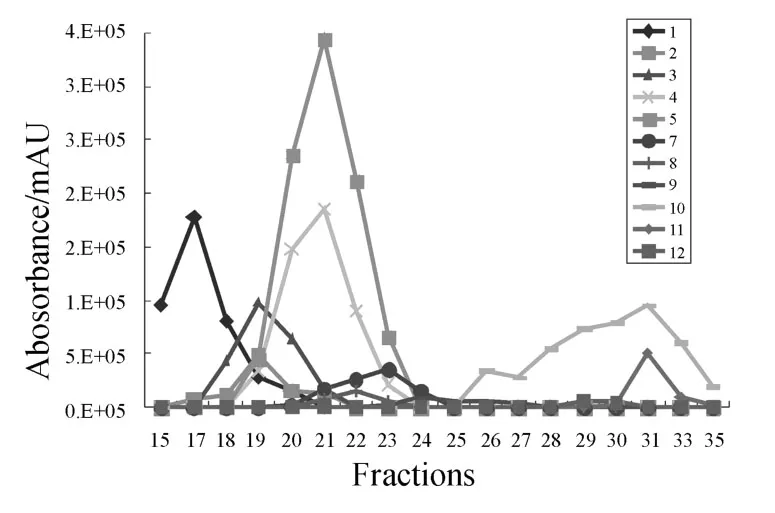
图2 提取物M-9中12个成分在系列流份中的强度(UV检测峰面积)分布曲线
2.3 NMR/LC-MS PDS谱的构成
对提取物M-9的18个(15,17-31,33和35号)系列混合物流份分别进行 LC-MS和1H-NMR谱测定,然后采用 NMR/LC-MS PDS方法的数据处理程序,将系列混合物样品中[M-H]-离子的选择离子色谱图(XIC)与1H-NMR谱构成 NMR/LC-MS PDS平行动态谱,如图 3所示.在 NMR/LC-MS PDS谱中,横轴为化学信息轴,包括选择离子色谱图(XIC)的保留时间和1H-NMR谱的化学位移值(δ);纵轴为样品轴(共18个样品),组分的谱学信号沿着这个轴呈现出动态的强度变化趋势.此外,不同质荷比(m/z)的XIC图用不同颜色的谱线显示,有助于快速识别混合物中存在的同分异构体及区分共流出的组分.例如,m/z315离子分别有3个信号峰出现在保留时间6.65,7.48和8.05 m in处,这清楚地表明在混合物样品中含有3个相对分子质量为316 Da的同分异构体.

图3 提取物 M-9经凝胶色谱获取其系列流份的NMR/LC-MSPDS谱
2.4 提取物M-9中各成分的综合结构解析
成分信号强度的动态变化与含量变化呈正比,即来自于同一成分的谱学信号会在系列混合物样品中随同变化,表现为具有相同的成分分布范围和强度变化趋势[18-21].根据这一原理,混合物中属于同一成分的MS与1H-NMR谱信号就会被相关及归属.本文以C1的结构解析为例,说明应用NMR/LC-MS PDS方法开展混合物中组分群的同步结构鉴定过程.
从NMR/LC-MS PDS谱(图 3)左侧的LCMS信息中可以看出,保留时间为5.69 min,m/z433.2[M-H]-离子的成分C1分布在15~19号流份范围内;在右侧与之对应的1H-NMR谱中,也可以看到几组具有相似强度变化趋势的化学位移值,见图4.其中包括δ4.25和δ4.68处双峰,芳香区δ6.5~6.7范围内的一组芳香族质子信号.

图4 提取物M-9系列流份的 NMR/LC-MS PDS谱部分放大图
高场区显示C1两个糖的端基质子信号为δ 4.68(1H,d,J=7.2 Hz)和δ4.25(1H,d,J=7.8 Hz,),结合它们的偶合常数可推断其为葡萄糖和木糖;在低场区可观察到与C1相关的一组芳香环上的ABX系统质子信号,包括δ6.70(d,J=1.8 Hz,H-2),δ6.65(d,J=7.8 Hz,H-5)和δ6.55(d,J=7.8,1.8 Hz,H-6).另外,在高场区可观察到一个与芳香环相连的甲氧基质子信号δ3.77(3H,s).根据以上分析及归属,可推断出该结构中存在葡萄糖、木糖和苷元2-methoxybenzene-1’4-diol.图 5为成分 C1的[M-H]-离子(m/z433)的MS2谱.由图5可知,m/z433离子主要丢失了140Da而产生m/z293离子,同时还观察到了m/z233,m/z215及m/z191等子离子,这表明[M-H]-离子并不发生常规的丢失糖基裂解,而是生成糖链交叉环切除反应的产物离子.综合上述归属的1H-NMR和[MH]-离子的裂解行为,可以确认C1为氢醌苷类化合物,且为氢醌O-双糖苷类化合物.因此,在相同的 HPLC-MS/MS谱条件下分析4-hydroxy-3-methoxyphenyl-β-D-xylopyranosyl(1 →6)-O-β-D-glucopyranoside,发现其保留时间与成分C1相同,且MS2谱中各离子的相对强度及峰型基本一致.
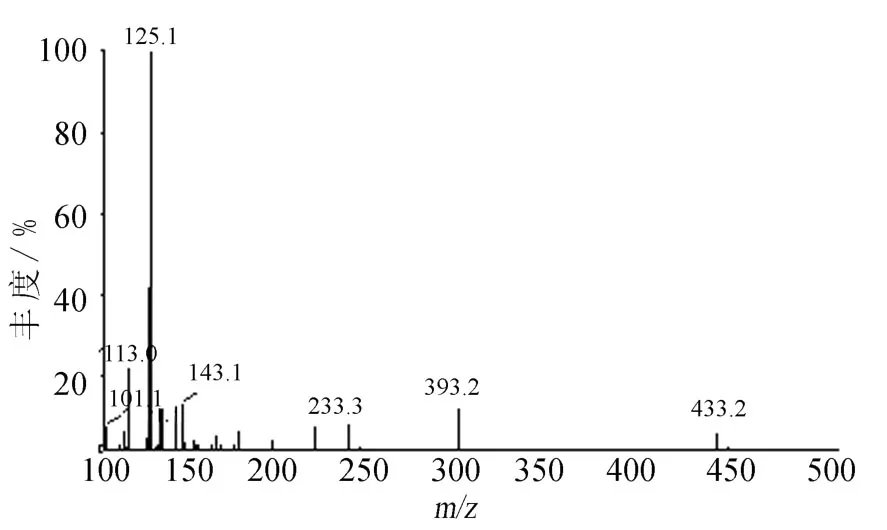
图5 成分C1的[M-H]-离子(m/z 433)的MS2谱
其他成分的信息挖掘及结构解析如下:如图3所示,在NMR/LC-MS PDS谱中可以观察到,成分C2的分布范围为17~20号流份,与成分C3的分布范围(17~22号流份)相似,并发现δ2.72附近有一组多重峰专属于成分C3,而δ4.92处的糖端基质子信号专属于成分C2.成分C4,C5和C6有着相同的色谱峰颜色以及质荷比(m/z315),表明这3个成分是一组同分异构体,其相对分子质量为316 Da,其中成分C4和C5的保留时间分别为6.95 min和8.04 min.成分C6可以清晰地观察到一组保留时间为7.48 min的色谱峰,且分布在22~29号流份范围内;在右侧与之对应的1H-NMR谱中,也可以观察到几组具有相似变化趋势的化学位移值,其中包括δ4.23处的双峰,δ2.73,3.65和3.96处的多重峰,以及芳香区δ6.5~6.7范围内的一组芳香质子信号.成分C7和C8有着相同的色谱峰颜色及质荷比(m/z331),它们是一组同分异构体,其分子量为332 Da,二者的保留时间分别为 6.65 min和5.54 min.在NMR/LC-MS PDS谱右侧的1H-NMR谱中(见图3),也可以观察到几组与成分C7和C8具有相似强度变化趋势的化学位移值,其中包括属于成分C7的δ6.48和3.75处的单峰,δ4.69处的双峰;属于成分C8的δ6.07和3.72处的单峰,δ4.61处的双峰.成分 C9的保留时间为11.70min,且[M-H]-离子为m/z299.2;在NMR/LC-MS PDS谱右侧的1H-NMR谱中可以确定δ4.46处的糖端基氢质子信号、芳香区δ7.01和6.63处双峰的芳香质子信号等一组谱学信号与其相关.成分C10相关的信号可以确定为:保留时间在2.96 min处的[M-H]-离子为m/z329.2,δ3.84处的单峰、δ4.96处的糖端基氢质子信号和芳香区δ7.1~7.6范围内的芳香质子信号.保留时间在8.06 min的[M-H]-离子m/z313.2,与之对应的δ3.88,3.60,4.47处的双二重峰,δ4.37处的糖端基氢质子信号和芳香区δ6.5~6.8范围内的芳香质子信号等一组谱学信号来自于成分C11.C12的[M-H]-离子为m/z313,其保留时间为6.56 min,由于该成分的含量很低,通过观察放大的NMR/LC-MS PDS谱,发现在相应流份的1H-NMR谱中可找到几组与上述[M-H]-离子强度具有相似变化趋势的化学位移值,其中包括δ4.39处的双峰,芳香区δ6.5~7.0范围内的一组芳香质子信号,δ4.64,4.43处的双峰及δ4.09处的双二重峰等相关性信息.
通过上述 NMR/LC-MS PDS谱分析,同时实现了混合物谱中12个成分的保留时间、分子离子、取代糖端基氢的化学位移及耦合裂分、苷元部分关键氢的化学位移及峰型等关键结构信息的相关和归属.在上述已归属的信息引导下,进一步结合 LC-MS/MS、1H-1H COSY、2D NOESY 谱以及组分间1H峰的积分比例,实现了混合物中12个成分无需完全分离的同步结构鉴定.上述12个成分中,包括3个氢醌苷类化合物,8个苯乙醇苷类化合物和1个香草酸苷类化合物,其中成分C5,C10,C11和C12为首次从本属植物中发现,各成分的LC-MS和1H-NMR谱数据及结构见表1.
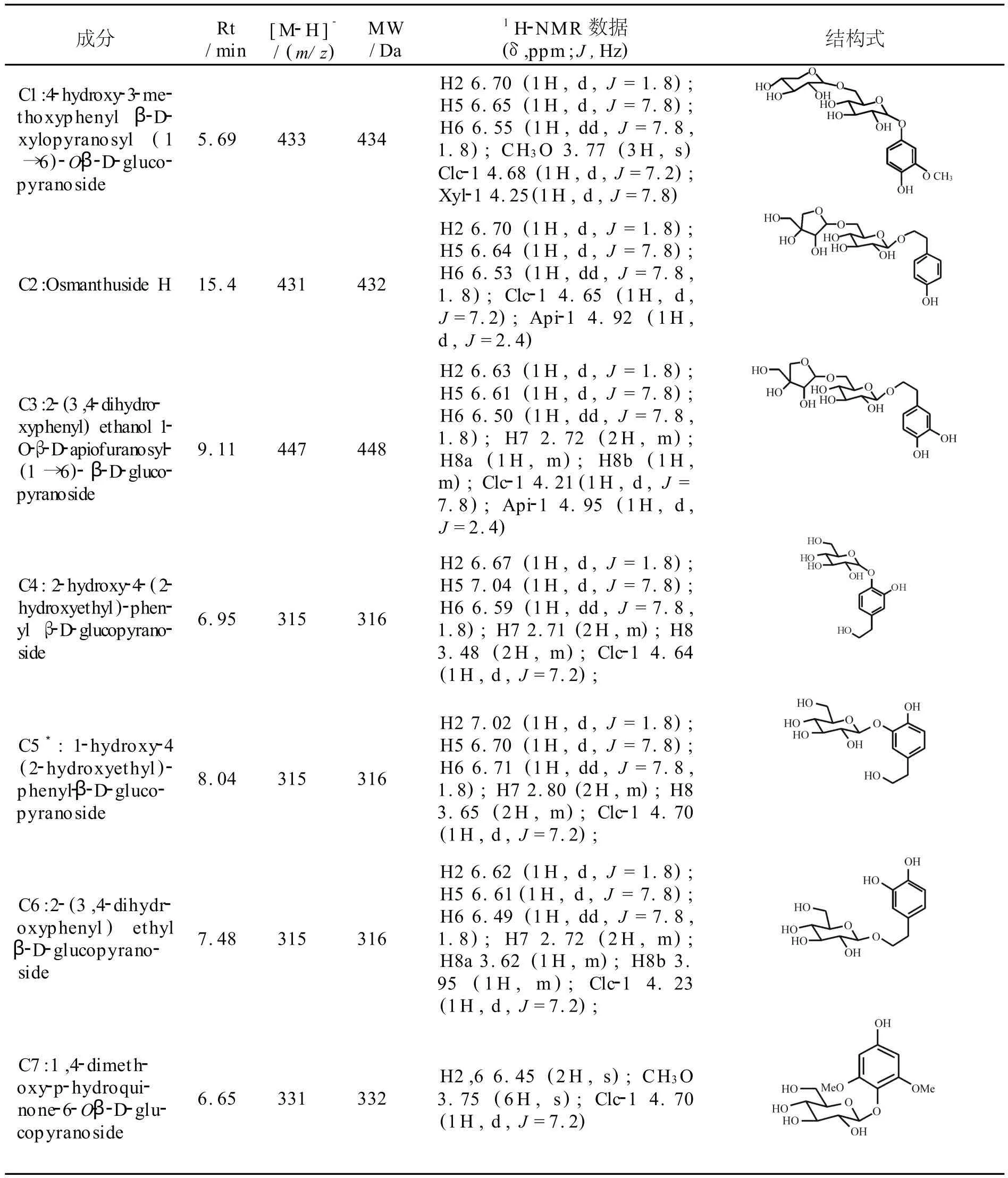
表1 小腊树提取物M-9中12个成分的LC-MS和1 H-NMR谱数据及其结构式
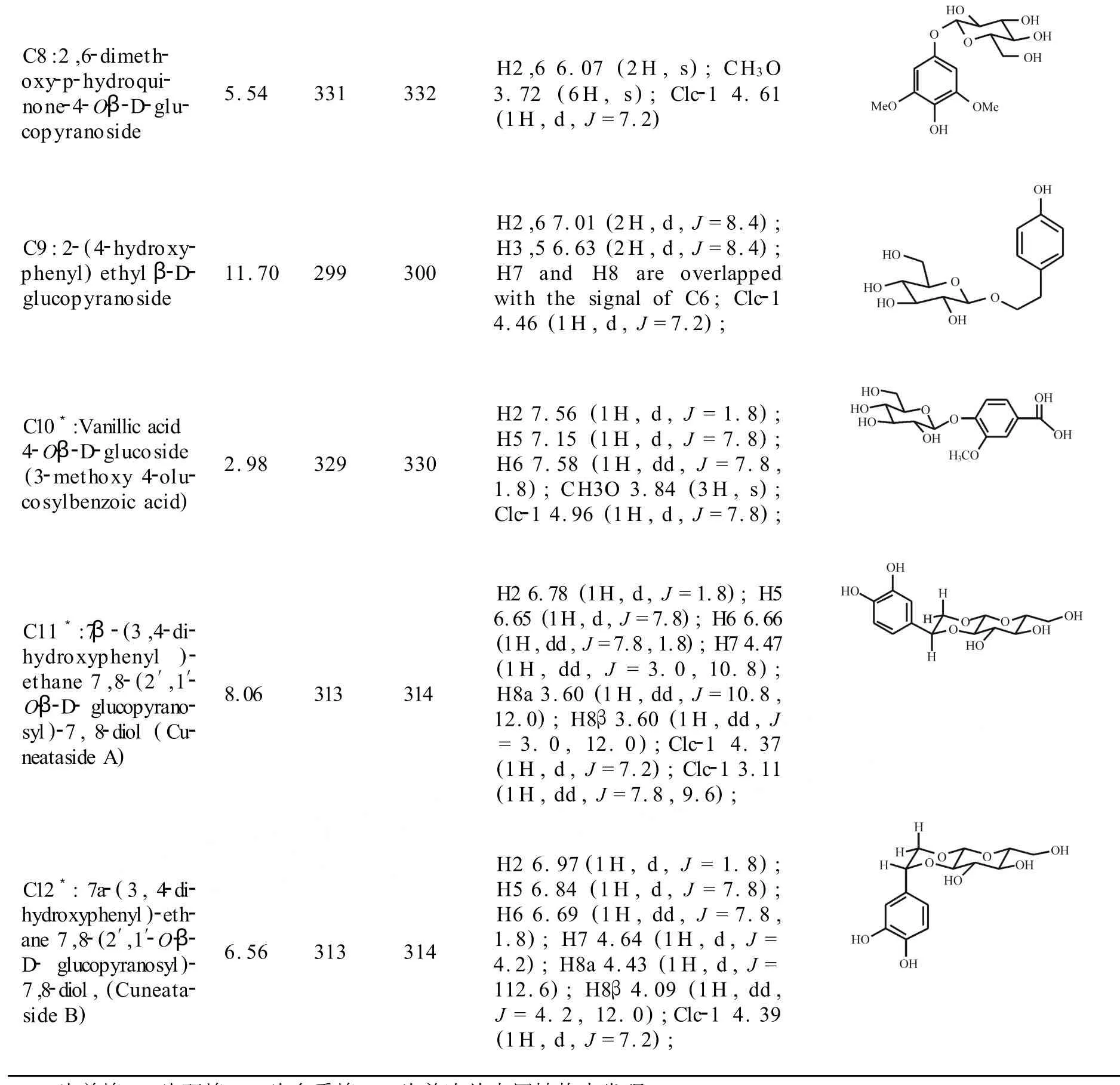
___续表1
3 结论
根据混合物中组分的结构特点,选择合适的凝胶色谱柱作为分离手段,可以制备组分交叉、含量呈连续动态变化的系列混合物流份,而且凝胶色谱柱具有上样量少,样品不易被吸附等优点,适合于分离制备少量样品及结构中含酚羟基的组分.在利用NMR/LC-MS PDS谱解析成分的结构时,对于样品分布范围及其含量变化趋势接近的成分,可根据其成分相对应的流份范围,结合各成分的紫外吸收及提取离子流的强度差异,以及1H-NMR谱信号积分比例的差异,可以将1H-NMR谱信号进行归属,从而实现这类性质相近成分的结构鉴定.
本文运用NMR/LC-MS PDS新型谱学分析方法 ,并结合 LC-MS/MS、1H-1H COSY、1D 及2D NOESY谱等进行综合分析,实现了对小蜡树提取物M-9中12个成分的同步结构鉴定,其中4个成分为首次从本属植物中发现.实验表明,本分析方法可以简化复杂混合物的分离分析过程,实现了多组分无需完全分离的快速结构鉴定.
[1]Strege,MA.High-performance Liquid Chromatographic-Electrosp ray Ionization Mass Spectrometric Analyses fo r the Integration of Natural Products with Modern High-Throughput Screening[J].J Chromatogr B Biomed Sci,1999,725:67-78.
[2]Wolfender J L,Ndjoko K,Hostettmann K.Liquid Chromatography with U ltraviolet Abso rbance-Mass Spectrometric Detection and with Nuclear Magnetic Resonance Spectrometry:a Powerful Combination fo r the On-line Structural Investigation of Plant Metabolites[J].J Chromatogr A,2003,1000:437-455.
[3]Wolfender JL,Queiroz E F,Hostettmann K.Phytochemistry in the Microgram Domain:a LC-NMR Perspective[J].Magn Reson Chem,2005,43:697-709.
[4]Cai Z,Lee F SC,Wang X R,et al.A Capsule Revie wof Recent Studies on the App lication of Mass Spectrometry in the Analysis of Chinese Medicinal Herbs[J].J Mass Spectrom,2002,37:1013-1024.
[5]项赟,李立军,再帕尔·阿力不孜.液相色谱-质谱联用方法在药用植物成分分析中的作用 [J].药学学报,2002,37:389-385.
[6]刘荣霞,果德安.液质联用技术(LC-MS)在中药现代研究中的应用[J].世界科学技术:中医药现代化(新技术与新方法),2005,7(5):33-40.
[7]Oleszek W,Bialy Z.Chromatographic Determination of Plant Saponins:An Update(2002—2005)[J].J Chromatogr A,2006,1112:78-91.
[8]Chang Y,Zeper A,Li L J,et al.Study on Fragmentation Behavior of 5/7/6-Type Taxoids by Tandem Mass Spectrometry[J].J Mass Spectrom,2000,35:1207-1214.
[9]Xiang Y,Zeper A,Li L J,et al.Characteristic Fragmentation Behavio r of Deoxytetranucleotides by Positive Ion Electrosp ray Ionization Tandem Mass Spectrometry[J].Rapid Commun Mass Spectrom,2003,17:1220-1224.
[10]Cui L J,Zeper A.Xia M,et al.On-Line Identification of Phenanthroindolizidine A lkaloids in a Crude Extract fromTylophoraAtrofolliculataby Liquid Chromatography Combined with Tandem Mass Spectrometry[J].Rapid Commun Mass Spectrom,2004,18:184-190.
[11]Liu Y Z,Liang F,Cui L J,et al.Multi-stage Mass Spectrometry of Furostanol Saponins Combined with Electrosp ray Ionization in Positive and Negative Ion Modes[J].Rapid Commun Mass Spectrom,2004,18:235-238.
[12]Li B,Zeper A,Fu G,et al.Characteristic Fragmentation Behavio r of Some Glucuronide-type Triterpenoid Saponins Using Electrosp ray Ionization Tandem Mass Spectrometry[J].Rapid Commun Mass Spectrom,2005,19:381-390.
[13]Li B,Zeper A,Tang M,et al.Rapid Structural Characterization of Triterpenoid Saponins in Crude Extract fromSymplocosChinensisUsing Liquid Chromatography Combined with Electrosp ray Ionization Ttandem Mass Spectrometry[J].J Chromatogr A,2006,1101:53-62.
[14]Ablajan K,Zeper A,Shang X Y,et al.Structural Characterization of Flavonol 3,7-di-O-glycosides and Determination of the Glycosylation Position by Using Negative Ion Electrosp ray Ionization Tandem Mass Spectrometry[J].J Mass Spectrom,2006,41:352-360.
[15]Makio Shibano,Lin A S,Hideji Itokawa,et al.Separation and Characterization of Active Flavonolignans ofSilybumMarianumby Liquid Chromatography Connected with Hybrid Ion-Trap and Time-of-Flight Mass Spectrometry(LC-MS/ITTOF)[J].J Nat Prod,2007,70:1424-1428.
[16]Wolfender J L,Ndjoko K,Hostettmann K J.Liquid Chromatography with U ltraviolet Absorbance-Mass Spectrometric Detection and with Nuclear Magnetic Resonance Spectroscopy:a Powerful Combination for The On-line Structural Investigation of Plant Metabolites[J].J Chromatogr A,2003,1000:437-455.
[17]Schaller F,Wolfender J L,Hostettmann K,et al.Ne wAntifungal Quinone Methide Diterpenes fromBobgunniaMadagascariensisand Study of Their Interconversion by LC/NMR[J].Helv Chim Acta,2001,84:222-229.
[18]Dai D M,He JM,Sun R X,et al.Nuclear Magnetic Resonance and Liquid Chromatography-Mass Spectrometry Combined with an Incomp leted Separation Strategy for Identifying the Natural Products in Crude Extract[J].Anal Chim Acta,2009,632(2):221-228.
[19]刘影,贺玖明,孙瑞祥,等.核磁共振和液相色谱-质谱平行动态谱学方法对连翘活性提取物的同步结构分析[J].分析化学,2011,39:323-329.
[20]代冬梅,贺玖明,刘超,等.采用 NMR/LC-MS异相关谱方法开展药用植物草棉活性提取物中多组分的同步结构分析研究[J].分析化学,2011,39(6):781-787.
[21]Wang X X,He JM,Wang C L,et al.Simultaneous Structural Identification of Natural Products in Fractions of Crude Extract of the Rare Endangered PlantAnoectochilusroxburghiiUsing1H-NMR/RRLC-MS Parallel Dynamic Spectroscopy[J].Int JMol Sci,2011,12:2556-2571.
Simultaneous Structural Identification of Constituents in Extract of Fraxinus Sieboldiana Using NMR/LC-MS Parallel Dynam ic Spectroscopy
HE Jiu-ming, L IU Ying, L IU Ming-tao, ZHANG Rui-ping, SH IJian-gong, Abliz Zeper*
(StateKeyLaboratoryofBioactiveSubstancesandFunctionsofNaturalMedicines,InstituteofMateriaMedica,
ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100050,China)
Based on the incomp lete separation analysis strategy,the extract ofFraxinussieboldianawas separated into seriesof fractions with the concentration dynamic variation of constituents by gel chromatography.The LC-MS and1H-NMR data of series of fractions were acquired and then p rocessed by Matlab to form NMR/LC-MS PDS.The co rrelation relationship between ions(m/z)and chemical shift(δ)deriving from the same molecule can be extracted simultaneously from themixture spectra.Combined with HPLC-MSn,1H-1H COSY,1D o r 2D NOESY spectra,twelve constituents including three hydroquinone glycosides,eight phenylethanoid glycosides and one vanillic glycoside were identified successfully,in which four compoundswere found from genusFraxinusfo r the first time.
NMR/LC-MS parallel dynamic spectroscopy;incomp lete separation strategy;sim ultaneous structural identification in mixture;Forsythiasuspensa;phenylethanoid glycosides
N55
A
1004-4353(2011)02-095-08
2011-05-04
国家自然科学基金项目资助(20775091)
*通信作者:再帕尔·阿不力孜(1961—),男,博士,研究员,研究方向为质谱分析.

