草酸青霉液体发酵产果胶酶条件的优化及其产物的酶学性质
蓝丽精,蔡琪敏,宋迤明,董夏梦,蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华 321004)
果胶酶是分解果胶质的多种酶的总称,最初是在桔子中提取出来的[1]。其主要来源于动植物及微生物,尤其是微生物,因具有生长速度快、生长条件简单、代谢过程特殊等特征,成为果胶酶的重要来源[2],在食品工业、纺织工业、环境保护等方面都有重大的应用价值,是四大酶制剂之一[3]。目前中国果胶酶的生产主要采用固体发酵,但是固体发酵产生的杂蛋白较多,分离纯化成本较高,回收率较低,其产品的质量及产量较难达到食品行业的使用要求[4]。所以在液体发酵产果胶酶方面也有较多的研究,如Tari[5]采用Aspergillus sojae ATCC 20235液体发酵产果胶酶;尤华[6]利用Aspergillussp.XZ-131液体发酵产果胶酶,通过正交实验优化培养基,最终酶活达300 U/mL;杨欣伟等[7]利用E IM-6菌株通过响应面法优化了液体发酵产果胶酶的条件,酶活提高了2.07倍。由于响应面分析法可以对影响产量的因子水平及其交互作用进行优化与评估,可以有效确定最佳生产条件,所以本研究在单因素的基础上利用该方法对草酸青霉产果胶酶的培养基进行了优化,得到最佳培养基配方,提高了果胶酶活性[8]。
1 材料与方法
1.1 材料
1.1.1 菌株 本实验室分离筛选获得的高产果胶酶的草酸青霉(Penicillium oxalicum)L5菌株。
1.1.2 培养基 ①斜面一级种子培养基:马铃薯葡萄糖培养基(PDA);②摇瓶种子培养基:果胶4 g,(NH4)2SO41 g,KH2PO43.8 g,K2HPO4·3H2O 0.2 g,水100 mL,pH 6.0;③摇瓶基础培养基:桔皮粉4 g,米糠4 g,(NH4)2SO41 g,KH2PO43.8 g,K2HPO4·3H2O 0.2 g,水100 mL,pH 6.0。
1.2 方法
1.2.1 摇瓶培养 将经PDA试管斜面培养后的菌株,用无菌水配成1.0×106个/mL孢子悬浮液,按5%的接种量(体积比)接入种子摇瓶培养基中,回转式摇床转速160 r/min,28℃,培养24 h后,取一定量的种子液接入摇瓶培养基,继续培养70 h。装液量均为250 mL三角瓶中装40 mL。1.2.2 粗酶液的提取 发酵液在4℃,10 000 r/min离心10 min,取上清液作为粗酶液。
1.2.3 酶活测定 采用DNS(3,5-二硝基水杨酸)法[9],规定每毫升果胶酶液降解果胶底物每分钟产生1μg还原糖为1个酶活单位。
1.2.4 单因素实验 以摇瓶基础培养基为配方,按照上述摇瓶培养的方法,分别以碳源、氮源、接种量及摇瓶初始pH为单因素进行实验,测定果胶酶活性。
1.2.5 优化实验[10]在单因素的基础上,选择影响较显著的桔皮粉含量(A)、米糠含量(B)、硫酸铵含量(C)为响应面的考察因素,以果胶酶产量(Y)为响应值,采用Minitab 15软件进行数据处理,对液体发酵产果胶酶的工艺参数进行优化。RS M实验设计因素水平见表1。
1.2.6 酶学特征[8]①反应温度对酶活的影响:将粗酶液分别置于30、40、50、60、70、80、90℃下测量其酶活;②热稳定性:将粗酶液分别在30、40、50、60、70℃温水浴下保温1、2、3、4 h后分别测定其酶活;③反应pH对酶活的影响:配制pH 3.0~9.0的果胶底物溶液,分别测定在不同pH情况下的酶活;④pH稳定性:将粗酶液分别在pH值为4.0~8.0的缓冲液中处理1、2、3、4 h,分别测定其酶活。
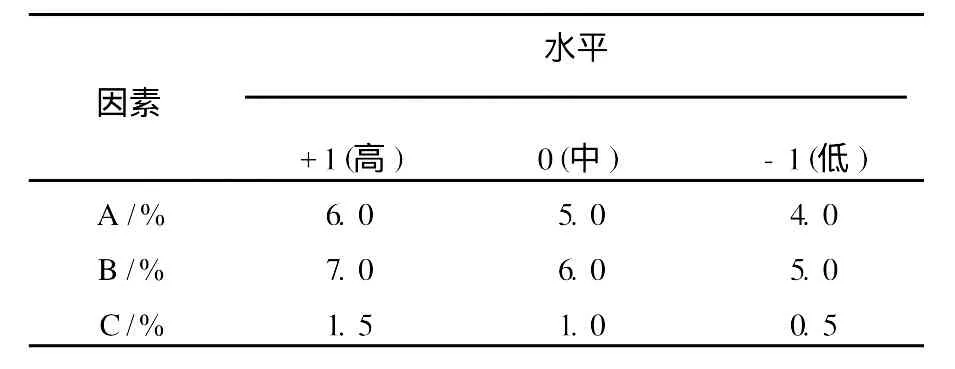
表1 RSM实验设计因素水平Table 1 Factors of response surface method and its level
2 结果与分析
2.1 液体发酵产果胶酶的单因素实验
分别研究了添加不同的碳源(桔皮粉、柚子皮粉、香蕉皮粉等)和不同的碳源添加量;不同的氮源(硫酸铵、硫酸铵+米糠、米糠等)和不同的氮源添加量;接种量;摇瓶初始pH等对L5菌株液体发酵产果胶酶的影响。结果显示(图1),在添加的碳源中,桔皮粉为最适碳源,添加量以5%为宜;在10种氮源中,添加复合氮源米糠+硫酸铵时,果胶酶活最佳,此外,硫酸铵、蛋白胨和牛肉膏也是较适合的氮源,其中米糠的添加量为6%,硫酸铵的添加量为1%;接种量为9%时果胶酶产量最佳;较适宜的初始pH在6.0~8.0左右。
2.2 液体发酵产果胶酶的优化实验
在单因素的基础上,采用Minitab 15软件,以桔皮粉含量、米糠含量、硫酸铵含量为自变量,果胶酶产量为响应值设计RS M实验,其实验结果见表2。最终拟合的回归方程如下:Y=-460 130+138 200A+53 266.2B+46 168.1C-15 247.76A2-4 769.55B2-29 403.7C2+960.830AB+4 322.01AC-1 701.47BC。由表3、表4可知,回归极显著(P<0.001),失拟不显著(P=0.241>0.05),该回归方程高度显著,能很好地对响应值进行预测。在考察的因素中A、A2、B2、C2表现为极显著(P<0.001),说明它们对响应值的影响极大及其考察的因素对响应值的影响不是简单的一次线性关系。
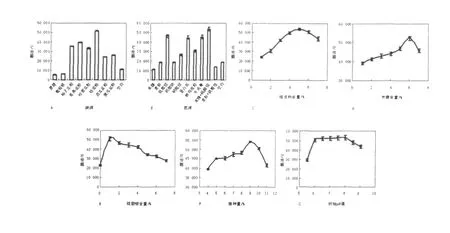
图1 不同因素对果胶酶产量的影响Fig.1 The effect of different factors on the pectinase-producting
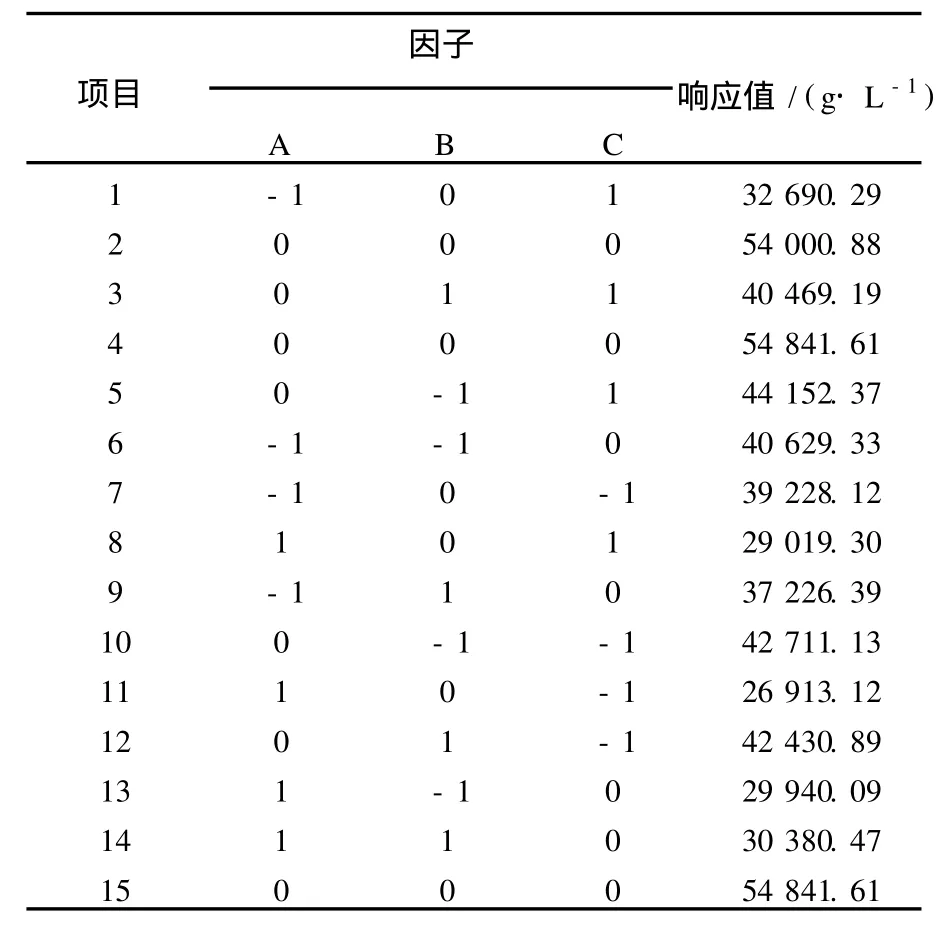
表2 RSM实验项目及结果Table 2 The experimentproject and resultsofResponse surfacemethod

表4 方差分析结果Table 4 Results of regression analysis
通过Minitab 15分析,绘制出等高线及曲面图2~5,直观地反映出了各因素的交互作用对响应值的影响,由图可知各因素存在极点值。同时,通过进一步绘制优化图,得出产果胶酶的最佳条件:桔皮粉4.848 5%、米糠5.888 9%、硫酸铵0.974 7%,此时的果胶酶产量预测值为54 924.00 U。考虑到实际操作的现实性,将最佳条件修正为桔皮粉4.85%、米糠5.89%、硫酸铵0.97%,进行3次平行实验,得到的果胶酶产量分别为54 964.29、53 246.53、54 964.29 U,平均产量为54 391.70 U,与预测产量无显著差别,证明此次RS M实验参数准确可靠,具有实用价值。

图2 果胶酶产量与米糠、硫酸铵的等值线及曲面图Fig.2 The isogram and surface chart of pectinase-producting on rice bran and(NH4)2SO4

图3 果胶酶产量与桔皮粉、硫酸铵的等值线及曲面图Fig.3 The isogram and surface chart of pectinase-producting on citrus peel powder and(NH4)2SO4

图4 果胶酶产量与桔皮粉、米糠的等值线及曲面图Fig.4 The isogram and surface chart of pectinase-producting on citrus peel powder and rice bran
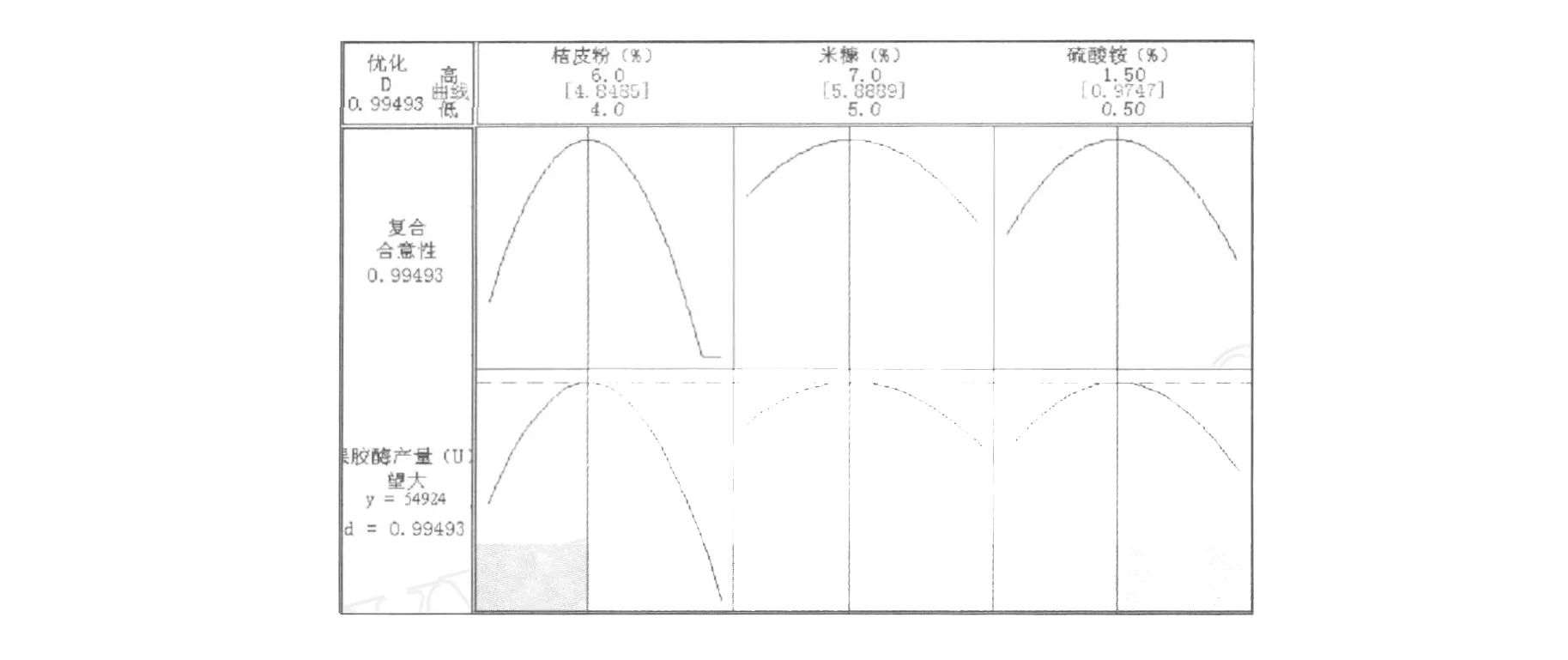
图5 果胶酶产量与桔皮粉、米糠、硫酸铵的优化图Fig.5 The optimization figure of pectinase-producting on citrus peel powder,rice bran and(NH4)2SO4
2.3 酶学特性
2.3.1 反应温度对酶活的影响及其热稳定性图6A可知,当反应温度为30~50℃时,酶活上升;反应温度为50~90℃时,酶活下降。由图6C可知,酶在30~50℃时有较好的热稳定性,并且在此范围内,温度在50℃时,酶活达最大值。
2.3.2 反应pH对酶活的影响及其热稳定性图6B显示,在pH范围为3.0~5.0时,酶活随着酶作用的底物pH增大而上升;在pH范围为5.0~9.0时,酶活随着酶作用底物pH的增大而下降。由图6D可见,酶在pH值为4.0~6.0的范围内有较好的稳定性,pH值为5.0时稳定性最佳,并且当底物pH为5.0时酶活力达到最大值。

图6 L5菌株的酶学性质Fig.6 The enzymatic properties ofL5
3 讨 论
在碳源筛选过程中选择了多种果皮粉及可溶性糖类,结果表明桔皮粉等含果胶的有机物质作为碳源时促进产酶;而葡萄糖等可溶性糖类作为碳源时,酶活较低,可能是因为其分解产物阻遏了酶的合成[11]。桔皮粉作为碳源的同时,又作为诱导剂,促进了酶的合成[12]。氮源的筛选结果表明,同时添加无机氮源(NH4)2SO4和有机氮源米糠时更有利于酶的合成。其中米糠主要起到持效氮源的作用,硫酸铵则起到速效氮源的作用,这样的组合更有利于草酸青霉持续快速的生长和发育[7]。
本研究通过单因素实验及RS M优化,得到该菌株在桔皮粉4.85 g,米糠5.89 g,(NH4)2SO40.97 g,KH2PO43.8 g,K2HPO4·3H2O 0.2 g,水100 mL,初始pH 6.0,温度28℃,摇床转速160 r/min,接种量9%,培养70 h时酶活最高,最终可达54 391.70 U,较原来提高了3倍。在草酸青霉液体发酵产果胶酶的研究中处于较高水平。
对草酸青霉菌株在液体发酵提取液中果胶酶的酶学性质进行了探讨,结果显示该酶的最适反应温度为50℃,最适反应pH为5.0,在30~50℃时有较好的热稳定性,在pH值为4.0~6.0的范围内有较好的稳定性,pH值为5.0时稳定性最佳。与彭霞薇等[13]对草酸青霉BZH_2002果胶酶酶特性的研究结果略有不同。
本研究的菌株利用浙江来源丰富的桔皮和米糠作为摇瓶培养基,不仅实现了废物再利用,同时可以使其高产,可见对该菌株的研究具有潜在的应用价值。
[1] Lund B.M..Bacterial spoilage of vegetables and certain fruits[J].Journal ofAppliedMicrobiology,1971,34(1):9-20.
[2] PandeyA.,Soccol C.R.,MitchellD..New developments in solid state fermentation:I-bioprocess and products[J].Process Biochemistry,2000,35(10):1153-1169.
[3] 许均华,李高阳,李志坚.高产果胶酶菌株的选育及其发酵生产的研究进展[J].食品与机械,2011,27(1):146-150.
[4] 张浩森,缪静,余晓斌.几种因素对黑曲霉产果胶酶不同酶系的影响[J].食品工业科技,2008,29(1):57-60.
[5] Tari C,Gogus N,Tokafli F.Optimization of biomass,pellet size and polygalae-turonase production byAspergillus sojae ATCC 20235 using response surface methodology[J].Enzyme andMicrobial Technology,2007,40(5):1108-1116.
[6] 尤华,陆兆新,冯红霞.曲霉液体发酵产原果胶酶的条件优化研究[J].微生物学通报,2003,30(1):26-30.
[7] 杨欣伟,林伟铃,田宝玉,等.果胶酶高产菌株E IM-6的筛选鉴定及其液体发酵产酶条件优化[J].福建师范大学学报(自然科学版),2009,25(2):68-74.
[8] 杨秀荣,王雪莲,王敏,等.利用响应面分析方法优化生防细菌B579增殖培养基[J].微生物学杂志,2010,30(3):35-39.
[9] 张浩森,缪静,余晓斌.果胶酶高产菌株的筛选及产酶条件的研究[J].生物学杂志,2008,25(1):28-30,46.
[10] 尹利,阎金勇,杨江科,等.响应面法优化洋葱假单胞菌产脂肪酶液体发酵工艺[J].微生物学杂志,2007,27(3):11-15.
[11] 林树花,李高阳,谭欢,等.果胶酶高产菌选育研究进展[J].农产品加工·创新版,2009(12):53-58.
[12] 刘明启,刘光富,戴贤君,等.优化米曲霉固体发酵产果胶酶及产物酶学性质[J].中国计量学院学报,2010,21(2):146-151.
[13] 彭霞薇,谢响明,白志辉,等.草酸青霉BZH-2002产果胶酶特性研究[J].生物技术,2005,15(6):27-30.

