不同海水浓度和培养时间对海洋真菌抗菌活性的影响
杜希萍,杨玖钦,杨秋明,伍菱,郑忠辉,苏文金,*
(1.集美大学生物工程学院厦门市食品生物工程技术研究中心,福建厦门361021;2.厦门大学生命科学学院细胞生物学与肿瘤细胞工程教育部重点实验室福建省药物工程实验室,福建厦门361005)
海洋中蕴藏着丰富的微生物资源,其特殊复杂的海洋环境(高盐度、高压力、低温、特殊光照、寡营养等)赋予海洋微生物特殊的代谢方式,代谢物化学结构具有极大的复杂性和多样性[1]。不少研究也表明,原来分离自海洋动植物的活性物质是与其共生的微生物产生的[2-5]。此外,海洋微生物具有繁殖快、易培养、代谢易于调控,菌种较易选育等优点,可以结合现代发酵工程技术进行工业化生产,既降低海洋药物的生产成本,又无药源之忧。因此,目前国际许多大制药企业已投资海洋微生物实验室及工业化大规模培养,以优化培养条件达到高产定向培养生物活性物质的目的。海洋真菌是海洋微生物的一个重要分支,Schiehser等[6]报道了第一个从海洋真菌中分离的有抗菌活性的天然产物Leptosphaerin。近年来,随着对海洋真菌研究的深入,已从中发现许多结构新颖、活性多样的化合物,包括抗肿瘤、抗病毒、抗菌化合物,细胞周期抑制剂、酶抑制剂等[7-12]。本文通过研究不同海水浓度和培养时间对海洋真菌抗菌活性的影响,旨在提高发现活性物质的几率,为大规模发酵海洋真菌提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源10株海洋真菌(zl01a-2、ty03b-11、ty03b-8、ty03b-1、ty01a-7、zl01a-9、zl01a-11、zl03b-2、zl03b-5、zl04b-4)为厦门大学微生物药物学课题组保存菌种。
1.1.2 指示菌金黄色葡萄球菌CMCC26003(Staphylococcus aureus CMCC26003,SA)、短小芽胞杆菌(Bacillus pumilus,BP)、枯草芽胞杆菌CMCC63501(Bacillus subtilis CMCC63501,BS)。
1.1.3 培养基马铃薯葡萄糖培养基(PD/PDA):马铃薯200 g(去皮,切成小块,加水煮沸30 min,4~6层纱布过滤,收集滤液),葡萄糖20 g,用不同浓度的海水(0%、20%、50%、80%和100%)定容至1 000 mL;固体培养基则加2%琼脂,121℃高压灭菌20 min;牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,水1 000 mL,pH 7.2~7.4,121℃高压灭菌20 min。
1.2 方法
1.2.1 菌株的活化从斜面挑取菌丝块分别接种于50%海水PDA培养基平板上,28℃培养4 d。1.2.2菌株的固体发酵挑取活化后菌株的菌丝块分别接种于海水浓度为0%、20%、50%、80%、100%的PDA培养基平板上,每个海水浓度发酵100 mL,28℃培养20 d。
1.2.3 菌株的液体发酵挑取活化后菌株的菌丝块分别接种于海水浓度为50%的PD培养基中,每个菌株发酵200 mL,180 r/min,28℃分别培养7 d和14 d。
1.2.4 固体发酵产物的提取将固体发酵产物切成小块,用乙酸乙酯∶甲醇∶乙酸(80∶15∶5)混合溶剂浸提3次,合并提取液于45℃减压浓缩至干,称量后用甲醇稀释备用。
1.2.5 液体发酵产物的提取液体发酵产物用4层纱布过滤,得到发酵液上清和菌体。发酵液上清用等体积乙酸乙酯萃取2次,合并有机相减压浓缩至干,称量后用甲醇稀释备用。
1.2.6 抗菌活性测定用滤纸片琼脂扩散法测定发酵提取物的抗菌活性[13]。加入适量指示菌菌悬液于冷却至45℃的牛肉膏蛋白胨培养基中,迅速摇匀(终浓度为105cfu/mL),倾注法制成平板待用。用微量进样器吸取含300 μg发酵提取物的稀释液滴加于已灭菌的滤纸片上,待溶剂挥干后,将含样品的滤纸片贴于琼脂平板上,37℃培养24 h后,测定抑菌圈大小。
2 结果与分析
2.1 海水浓度对抗菌活性的影响
在供试的10株海洋真菌中,5株海洋真菌的抗菌活性受海水浓度的影响较大。从图1可以看出,当海水浓度为0%、20%、50%和80%时,菌株zl03b-5对金黄色葡萄球菌、枯草芽胞杆菌和(或)短小芽胞杆菌表现出较强的抗菌活性;而海水浓度为100%时,菌株zl03b-5仅对金黄色葡萄球菌表现出抗菌活性,抑菌圈为6 mm。
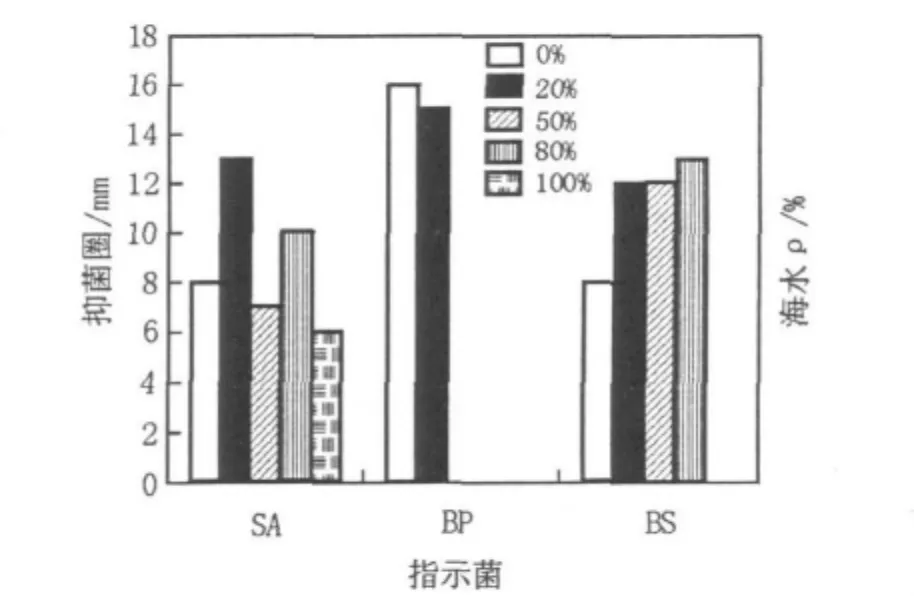
图1 菌株zl03b-5的抗菌活性Fig.1 Antimicrobial activity of zl03b-5
当海水浓度为0%时,菌株zl01a-2表现出最强的抗菌活性,对金黄色葡萄球菌、短小芽胞杆菌和枯草芽胞杆菌的抑菌圈分别为14、8和17 mm;当海水浓度为20%和50%时,菌株zl01a-2表现出相似的抗菌活性,对短小芽胞杆菌和枯草芽胞杆菌的抑菌圈均为8 mm;而海水浓度为80%和100%时,菌株zl01a-2表现出最弱的抗菌活性,对短小芽胞杆菌和枯草芽胞杆菌的抑菌圈均为7 mm(表1)。
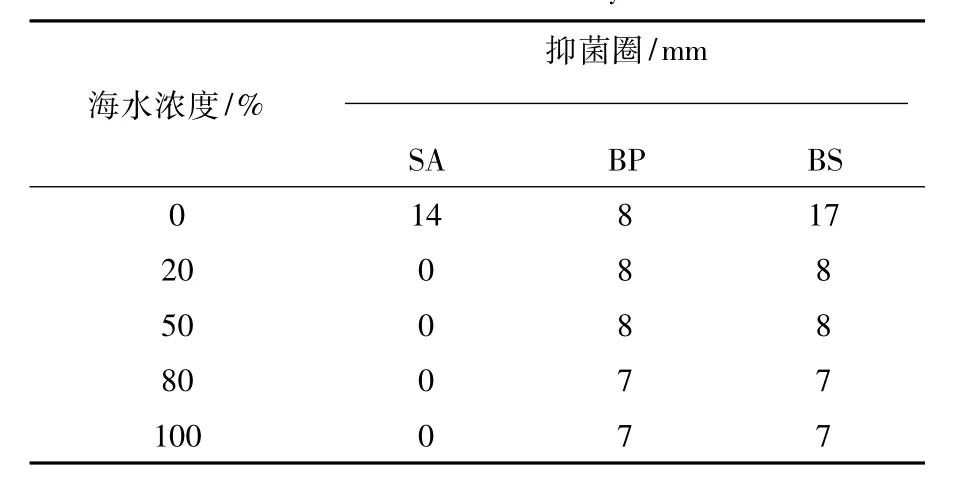
表1 菌株zl01a-2的抗菌活性Table 1 Antimicrobial activity of zl01a-2
从表2可以看出,当海水浓度为0%、20%和100%时,菌株zl04b-4对指示菌具有抗性,而海水浓度为50%和80%时,菌株zl04b-4对3种指示菌均没有抗性。
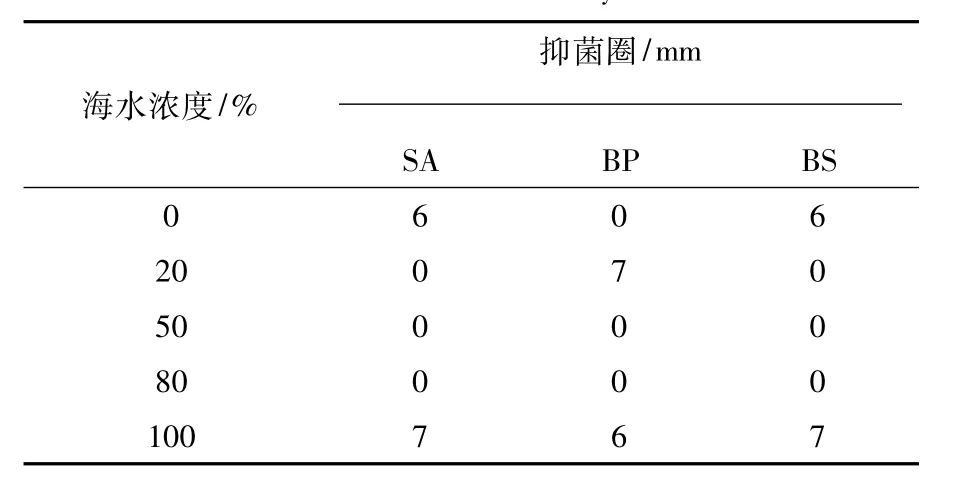
表2 菌株zl04b-4的抗菌活性Table 2 Antimicrobial activity of zl04b-4
菌株ty03b-11和zl03b-2对短小芽胞杆菌的抗性受海水浓度的影响不大,而对金黄色葡萄球菌和枯草芽胞杆菌的抗性受海水浓度的影响较大。当海水浓度为0%时,菌株ty03b-11和zl03b-2对金黄色葡萄球菌的抑菌圈分别为0、14 mm;而海水浓度为80%时,其抑菌圈分别为9、17 mm;海水浓度为50%时,菌株ty03b-11和zl03b-2对枯草芽胞杆菌均表现出最弱的抗性(表3和表4)。
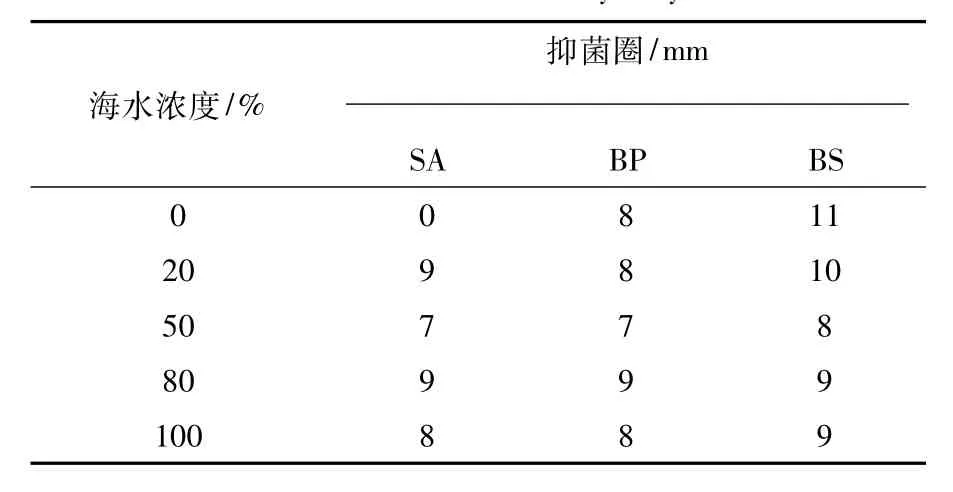
表3 菌株ty03b-11的抗菌活性Table 3 Antimicrobial activity of ty03b-11
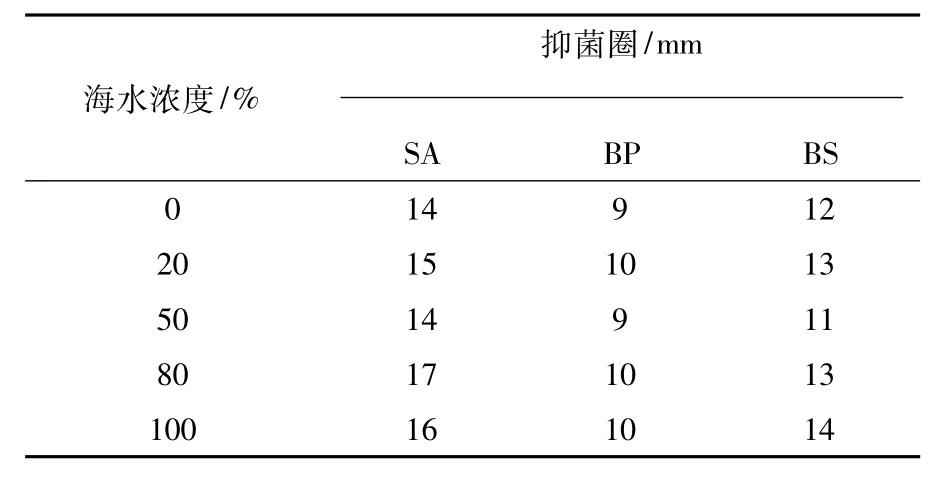
表4 菌株zl03b-2的抗菌活性Table 4 Antimicrobial activity of zl03b-2
2.2 培养时间对抗菌活性的影响
在供试的10株海洋真菌中,6株海洋真菌的抗菌活性受培养时间的影响显著。表5的结果表明,菌株zl03b-2、ty01a-7和zl01a-2培养14 d时抗菌活性较好,而菌株zl04b-4培养14 d时对3种指示菌均没有抗性,培养7 d时能抑制枯草芽胞杆菌的生长,其抑菌圈为14 mm。菌株ty03b-11和zl03b-5的抗菌活性不仅与培养时间有关,而且与指示菌种类的关系很大。培养7 d时,ty03b-11对金黄色葡萄球菌、短小芽胞杆菌和枯草芽胞杆菌的抑菌圈分别为15、8和7 mm;而培养14 d时,其抑菌圈分别为12、10和14 mm。培养7 d时,zl03b-5对金黄色葡萄球菌、短小芽胞杆菌和枯草芽胞杆菌的抑菌圈分别为7、9和17 mm;而培养14 d时,其抑菌圈分别为6、9和10 mm。

表5 培养7 d和14 d时海洋真菌的抗菌活性Table 5 Antimicrobial activity of marine fungi harvested at 7 days and 14 days
3 讨论
不同海水浓度和培养时间对海洋真菌抗菌活性的影响国内外已有一些报道。如Bugni等[14]对9株海洋真菌进行了发酵条件的研究。发现菌株Penicillium brocae(F97S76)培养10 d时,人工海水比例为20%~60%的抽提物对耐甲氧西林金黄色葡萄球菌(MRSA)表现出抗性;而人工海水比例为80%和100%的抽提物对甲氧西林敏感的金黄色葡萄球菌(MSSA)表现出抗性,表明人工海水浓度变化时,代谢产物的类型也发生了变化;菌株Penicillum sp.(F97I21)表现出人工海水浓度与抗菌活性具有极大的关系,当人工海水比例为20%~40%时活性物质的产量较高。Masuma等[15]研究了不同海水浓度对海洋真菌菌丝生长及抗菌活性的影响,发现3株海洋真菌的抗菌活性随着海水浓度的增加而增加,表明它们更适应海洋环境。郭江等[16]发现海洋真菌菌株M-401对藤黄八叠球菌抑菌效果最好培养时间是在48 h,而对大肠埃希菌抑菌效果最好培养时间是在72 h。
本文的实验结果也显示,海水浓度和培养时间对海洋真菌的抗菌活性具有显著影响。海水浓度和培养时间不同,抗菌物质的种类和产量可能有较大差别。菌株zl03b-5和zl01a-2在海水浓度为0%时具有较强的抗菌活性,而海水浓度为100%时的抗菌活性较弱(图1和表1),表明它们可能来源于陆地或淡水,不属于专性海洋真菌,而属于兼性海洋真菌。菌株zl04b-4在海水浓度为0%、20%和100%时具有抗菌活性,而海水浓度为50%和80%时没有抗菌活性(表2),表明zl04b-4可能产生抗菌活性物质用于渗透调节来适应特殊的高盐环境。菌株zl03b-2、ty01a-7和zl01a-2培养14 d时具有较强的抑菌作用,表明其抗菌活性物质可能来源于初级代谢产物;而菌株zl04b-4培养14 d时没有抑菌作用,培养7 d时能抑制枯草芽胞杆菌的生长,表明其抗菌活性物质可能来源于次级代谢产物,抗菌活性物质的化合物类型有待进一步研究。
[1] 王鸿,沈丽丽,梅建凤,等.不同培养时间海洋来源真菌Penicillium spp.701挥发性成分分析[J].中国药学杂志,2010,45(1):11-13.
[2] 焦炳华.海洋生命活性物质和海洋药物的研究与开发[J].第二军医大学学报,2006,27(1):5-7.
[3] Sponga F,Cavaletti L,Lazzarini A,et al.Biodiversity and potentials of marine-derived microorganisms[J].J Biotechnol,1999,70(1-3):65-69.
[4] 陈建国,李国明.海洋生物抑菌物质的研究进展[J].国际检验医学杂志,2006,27(9):820-822.
[5] König G M,Kehraus S,Seibert S F,et al.Natural Products from Marine Organisms and Their Associated Microbes[J].Chembiochem.,2006,7(2):229-238.
[6] Schiehser G A,White J D,Matsumoto G,et al.The structure of leptosphaerin[J].Tetrahedron Lett,1986,27(46):5587-5590.
[7] You J L,Dai H Q,Chen Z H,et al.Trichoderone,a novel cytotoxic cyclopentenone and cholesta-7,22-diene-3β,5α,6β-triol,with new activities from the marine-derived fungus Trichoderma sp.[J].J Ind Microbiol Biotechnol,2010,37(3):245-252.
[8] Du X P,Lu C H,Li Y Y,et al.Three New Antimicrobial Metabolites of Phomopsis sp.[J].J.Antibiot.,2008,61(4):250-253.
[9] Bugni T S,Bernan V S,Greenstein M,et al.Brocaenols A-C:Novel Polyketides from a Marine-Derived Penicillium brocae[J].J.Org.Chem.,2003,68(5):2014-2017.
[10] Tsukamoto S,Hirota H,Imachi M,et al.Himeic acid A:a new ubiquitin-activating enzyme inhibitor isolated from a marine-derived fungus,Aspergillus sp.[J].Bioorg Med Chem Lett.,2005,15(1):191-194.
[11] Cui C B,Kakeya H,Okada G,et al.Tryprostatins A and B,novel mammalian cell cycle inhibitors produced by Aspergillus fumigatus[J].J.Antibiot.,1995,48(11):1382-1384.
[12] Rowley D C,Kelly S,Kauffman C A,et al.Halovirs A-E,New Antiviral Agents from a Marine-Derived Fungus of the Genus Scytalidium[J].Bioorg Med Chem.,2003,11(19):4263-4274.
[13] 熊枫,郑忠辉,黄耀坚,等.从深海沉积物中筛选具有抗菌、抗肿瘤活性的海洋真菌[J].厦门大学学报,2006,45(3):419-423.
[14] Bugni T S,Ireland C M.Marine-derived fungi:a chemically and biologically diverse group of microorganisms[J].Nat.Prod.Rep.,2004,21(1):143-163.
[15] Masuma R,Yamaguchi Y,Noumi M,et al.Effect of sea water concentration on hyphal growth and antimicrobial metabolite production in marine fungi[J].Mycoscience,2001,42(5):455-459.
[16] 郭江,祖国仁,孔繁东,等.1株海洋真菌菌株M-401产抑菌物质发酵条件研究[J].微生物学杂志,2007,27(1):76-79.

