利用叶绿素荧光技术揭示光照、温度和盐度对鼠尾藻嫩芽的影响
梁洲瑞, 王飞久, 孙修涛, 汪文俊, 丁昌玲, 李 涛
(1. 农业部海洋渔业资源可持续利用重点开放实验室, 中国水产科学研究院黄海水产研究所, 山东青岛266071; 2. 上海海洋大学 水产与生命学院, 上海201306)
利用叶绿素荧光技术揭示光照、温度和盐度对鼠尾藻嫩芽的影响
梁洲瑞1,2, 王飞久1, 孙修涛1, 汪文俊1, 丁昌玲1, 李 涛1
(1. 农业部海洋渔业资源可持续利用重点开放实验室, 中国水产科学研究院黄海水产研究所, 山东青岛266071; 2. 上海海洋大学 水产与生命学院, 上海201306)
采用鼠尾藻嫩芽为实验材料, 研究了不同光强(25~220 μmol/(m2·s))、温度(5~34℃)和盐度(0~60)对其叶绿素荧光参数的影响。测定的叶绿素荧光参数包括光系统II最大荧光产量(Fv/Fm)、最大潜在相对电子传递速率(RrET,max)、快速光曲线的初始斜率等。结果表明:(1)鼠尾藻嫩芽易受强光、高温胁迫, 在强光照射下, 其Fv/Fm值明显降低, 温度大于30℃时对其光合作用有显著影响; (2)5℃低温处理1 h或0~60盐度处理9 h对光系统Ⅱ均有明显影响, 但24 h恢复后, 除了盐度60组, 其他组的叶绿素荧光参数均可基本恢复正常。初步分析了鼠尾藻嫩芽的抗逆生理, 可为鼠尾藻的人工栽培提供参考。
鼠尾藻(Sargassum thunbergii); 胁迫条件; 叶绿素荧光参数
鼠尾藻(Sargassum thunbergii)属于褐藻门马尾藻属(Sargassum)。鼠尾藻具有很高的生态、经济价值:如净化重金属污染海区、降低海区富营养化; 可提取碘、褐藻胶、甘露醇等食品或医药原料; 作为海参鲍鱼的饲料等[1-6]。
鼠尾藻作为一种重要的大型经济海藻, 其自然资源日益减少, 开展鼠尾藻人工繁殖、育苗及栽培技术的研究势在必行。虽然近年来这些方面的研究工作已广泛展开[7-12], 但许多生物基础科学问题研究不深入(如光合作用有关基础理论等), 不能完全满足鼠尾藻产业发展需求并由此限制了鼠尾藻应用价值的更大发挥。鼠尾藻的自然生长环境是受到海水涨落潮及雨水影响较大的潮间带, 光照、温度、盐度等环境因子的变化较大, 其能在环境变化剧烈的潮间带生长必有其独特的生理特性。植物通过光合作用获取能量, 为此对鼠尾藻光合作用生理的研究显得尤为重要, 但目前有关这方面的研究尚未见报道。在人工养殖鼠尾藻过程中, 附着生物尤其是贻贝、杂藻(如水云属和多管藻属中的藻类)等对鼠尾藻的生长十分不利。在鼠尾藻、羊栖菜、铜藻等马尾藻属的养殖实践过程中, 可利用其具有较强的耐受渗透压变化的能力, 通过干露苗绳、自来水冲洗等方法除掉这些对渗透压较为敏感的附着生物[9,13-14]。但鼠尾藻耐受渗透压变化的范围有多大, 还没有深入的研究报道。由此, 鼠尾藻盐度胁迫的研究对在人工养殖过程中如何更有效除掉鼠尾藻附着生物有重要的指导意义。
叶绿素荧光于1834年被首次发现[15], 由于其是测定植物光合作用的有效、快速、无损伤的探针, 现已被广泛应用于植物光合机理的研究。目前国内外利用叶绿素荧光技术对高等植物生理胁迫、作物增产潜力预测等方面的研究报道较多[16-17], 对微型海藻[18-20]和大型海藻(如条斑紫菜, 龙须菜, 浒苔等)[21-23]的研究也有报道。在褐藻门中, 有关温度、盐度和光照胁迫机制的研究已有一些报道[13-14,24]。
经过有性繁殖阶段后, 鼠尾藻枝条糜烂脱落,嫩芽从其假根基部生出, 开始新一轮的营养繁殖[25]。温度与光照强度是鼠尾藻新生枝条生长的主要限制因子[26]。在鼠尾藻人工养殖实践中, 可利用其营养繁殖特性——固着器(假根)多年生, 实行多茬养殖[9]。本实验利用叶绿素荧光技术研究光照、温度和盐度对鼠尾藻嫩芽的影响, 初步分析了鼠尾藻嫩芽的抗逆生理, 这对鼠尾藻人工栽培有理论和应用上的价值。
1 材料和方法
1.1 材料
于2010年11月中旬在青岛太平角潮间带礁石区(该时段该地区海水温度约为16~19℃)采集鼠尾藻,置于GXZ智能型光照培养箱进行暂养一周, 培养条件:温度 18℃, 光照度约为 60 μmol/(m2·s), 用灭菌海水(盐度 33)作为培养液, 并添加营养盐3 mg/L)和二氧化锗(2 mg/L, 抑制硅藻繁殖)。
1.2 方法
实验于光照培养箱中进行, 鼠尾藻嫩芽长度为1~2 cm, 放于盛有200 mL培养液的烧杯中培养。叶绿素荧光参数的测定均采用水下饱和脉冲叶绿素荧光仪(DIVING-PAM, WALZ, Germany)。测定方法如下:嫩芽进行暗适应30 min后再测Fv/Fm; 测定快速光曲线时, 设置的光合有效辐射(PAR)分别为26、48、88、131、176、254、399、499 μmol/(m2·s), 每个 PAR照射10 s。所测定的参数由数据采集软件wincontrol计算出。以下每个处理组做4个平行。
光强实验设置3个光照度(低、中、高光强分别为:30~40 μmol/(m2·s)、60~80 μmol/(m2·s)和 180~220 μmol/(m2·s), 培养条 件为:白色日光灯, 光周期12L:12D, 温度18℃, 盐度33。测定培养1 h后鼠尾藻嫩芽的Fv/Fm值。
温度实验设置 7个温度组(5、10、26、28、30、32 和 34℃)与对照组(18℃)。培养条件为:白色日光灯, 光照度 60~80 μmol/(m2·s), 光周期12L:12D, 盐度33。分别测定培养 1 h后和在对照条件下恢复培养24 h后鼠尾藻嫩芽的Fv/Fm及快速光曲线。
盐度实验设置 6个盐度组(0、10、20、40、50和60)与对照组(盐度33)。培养条件为:白色日光灯, 光照度 60~80 μmol/(m2·s), 光周期 12L:12D, 温度 18℃。分别测定培养 0.5、1、2、4、6、9 h后和在对照条件下恢复培养24 h后鼠尾藻嫩芽的Fv/Fm及快速光曲线。
1.3 数据处理
采用Excel和SPSS软件进行方差、显著性分析等数据处理(以P<0.01作为极显著性差异, 以P<0.05作为显著性差异), 用 GraphPad Prism 软件绘制图形。为了对快速光曲线进行定量比较, 需进行曲线拟合, 利用下面公式拟合曲线[27]:
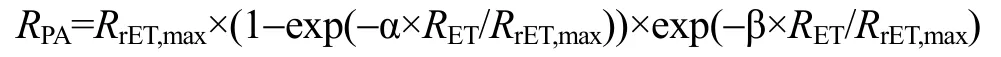
曲线拟合采用最小二乘法, 用 Statistica软件进行。公式中的符号含义是:RPA为光合有效辐射;RET为电子传递速率;RrET,max为最大潜在相对电子传递速率; α为快速光曲线的初始斜率; β为快速光曲线下降阶段的斜率。
2 结果
2.1 光强实验
鼠尾藻嫩芽在中等光强下, 处理1 h后Fv/Fm值略微升高; 在低光强下, 处理1 h后Fv/Fm值略微降低。中、低光强组, 处理前后Fv/Fm值差异不显著(P>0.05)。而在高光强下,Fv/Fm值在处理前后差异显著(P<0.05), 见图1。另外, 高光强组的鼠尾藻换为在60~80 μmol/(m2·s)的光照度下培养 24 h 后测其Fv/Fm值, 发现其Fv/Fm值能恢复正常。
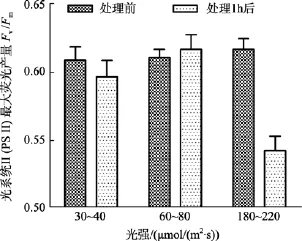
图1 不同光强处理前及处理1 h后鼠尾藻嫩芽的 Fv/Fm(n=4)Fig. 1 The optimal chlorophyll fluorescence quantum yields (Fv/Fm) of newborn branches of S. thunbergii before and 1 h after exposure to different light intensity respectively
2.2 温度实验
除了5℃和34℃处理组, 其他温度组在处理1 h后光系统 II(PSII)最大荧光产量Fv/Fm值与对照组(18℃)间差异不显著(P>0.05)。在恢复培养 24h后,34℃处理组的Fv/Fm值与对照组间差异显著(P<0.05),而5℃组的Fv/Fm值可基本恢复正常(P>0.05), 见图2。
由图3看出, 10℃和26℃组处理1 h后的RrET,max值与对照组(18℃)的相差较小。32℃和34℃组处理1 h后的RrET,max值均明显低于对照组(P<0.05), 分别为对照组的81.06%、64.81%。5、28和30℃组处理1 h后的RrET,max值低于对照组, 但未达到显著程度(P>0.05)。恢复培养24 h后, 32℃和34℃处理组的RrET,max值均明显低于对照组(P<0.05), 分别为对照组的82.64%、71.84%。
5℃和34℃组处理1 h后快速光曲线的初始斜率α值均显著低于对照组(P<0.05), 分别为对照组的81.08%、83.36%。恢复培养24 h后, 32℃和34℃处理组的初始斜率α值均明显低于对照组(P<0.05), 分别为对照组的90.06%、89.59%, 见图4。
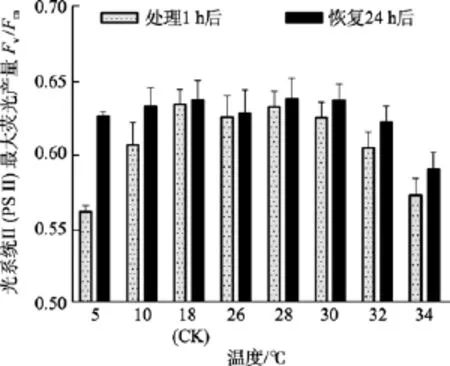
图2 不同温度处理1 h及恢复培养24 h后鼠尾藻嫩芽的Fv/Fm(n=4)Fig. 2 The optimal chlorophyll fluorescence quantum yields (Fv/Fm) of newborn branches of S. thunbergii after exposure to different temperatures for 1 h and the corresponding values 24 h after recovered culture

图3 不同温度处理1 h及恢复培养24 h后鼠尾藻嫩芽的最大相对电子传递速率RrET,max(n=4)Fig. 3 The maximum relative electron transport rate(RrET,max) of newborn branches of S. thunbergii after exposure to different temperatures for 1 h and the corresponding values 24 h after recovered culture

图4 不同温度处理1 h及恢复培养24 h后鼠尾藻嫩芽的快速光曲线初始斜率α(n=4)Fig. 4 The initial slope (α) of the rapid light curve of newborn branches of S. thunbergii after exposure to different temperatures for 1 h and the corresponding values 24 h after recovered culture
2.3 盐度实验
无论是高盐处理还是低盐处理, 随着时间的延长, 鼠尾藻嫩芽各个处理组的Fv/Fm值、RrET,max值均呈降低的趋势。
由图5可知, 对于Fv/Fm值, 盐度 0、50和 60组在处理 6 h时,Fv/Fm值与对照组间差异极显著(P<0.01)。盐度60组在处理9 h后恢复培养24 h, 其Fv/Fm和RrET,max值与对照组间差异显著(P<0.05), 见图6和图7。
由图8可知, 盐度0和60组的RrET,max值在处理9 h内均明显低于对照组(盐度33), 其大致在对照组的 74%~88%范围内波动变化。盐度 10、20、40和50处理组的RrET,max值大致呈线性下降变化。
3 讨论
叶绿素荧光与光合作用密切相关, 环境因子对光合作用的影响可通过叶绿素荧光参数反映出来[28]。经过充足暗适应后测出的Fv/Fm反映了当时所有的PSII反应中心均处于开放态时的量子产量, 即植物的潜在最大光合能力, 是衡量 PSII完整性的指标[29]。在正常生理状态下,Fv/Fm是一个很稳定的值,藻类约为0.65[30], 当受到胁迫时, 其值显著下降[31]。PSII的相对光合电子传递速率(RET)是反映实际光强下的表观电子传递速率; 快速光曲线的初始斜率,反映了光能利用效率[29,32]。

图5 不同盐度处理0.5 h、1 h、2 h、4 h、6 h及9 h后鼠尾藻嫩芽的Fv/Fm(n=4)(图的左边是高盐, 右边是低盐)Fig. 5 The otimal chlorophyll fluorescence quantum yields (Fv/Fm) of newborn branches of S. thunbergii after exposure to different salinities for 0.5, 1, 2, 4, 6 and 9 h respectively(Left side:high salinities; Right side:low salinities)

图6 不同盐度处理9 h和恢复培养24 h后鼠尾藻嫩芽的Fv/Fm(n=4)Fig. 6 The Fv/Fm of newborn branches of S. thunbergii after exposure to different salinities for 9 h and the values 24 h after recovered culture
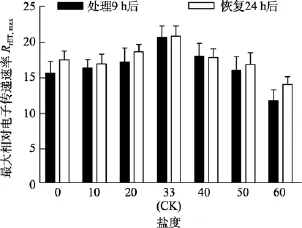
图7 不同盐度处理9 h和恢复培养24 h后鼠尾藻嫩芽的RrET,max(n=4)Fig. 7 The RrET,max of newborn branches of S. thunbergii after exposure to different salinities for 9 h and the values 24 h after recovered culture

图8 不同盐度处理0.5 h、1 h、2 h、4 h、6 h及9 h后鼠尾藻嫩芽的RrET,max(n=4)(图的左边是高盐, 右边是低盐)Fig. 8 The maximum relative electron transport rate (RrET,max) of newborn branches of S. thunbergii after exposure to six salinities for 0.5,1,2,4 ,6 and 9 h respectively(Left side:high salinities; Right side:low salinities)
一般来说,Fv/Fm值下降是植物叶片发生光抑制的重要特征[33-34]。本实验中, 高光强处理下,Fv/Fm值明显下降, 说明高光强可能使鼠尾藻嫩芽产生了光抑制, 即其光合机构由于吸收了过剩光能而引起光合能力和光合活性下降; 而换为中光强下培养后则能恢复正常, 说明在本实验条件下鼠尾藻嫩芽受强光胁迫是可逆失活。有研究指出, 有效的能量耗散过程是强光胁迫下防御光破坏的一个重要机制, 而PSII反应中心的可逆失活可能是防御PSII反应中心免受光破坏的主要保护机制[35-36]。
研究表明, PSII的活性在高温时受到抑制, 它是最易热敏感的色素蛋白复合体之一[37-38]。类囊体膜含有光合色素和电子传递链组分, 是进行光反应的部位, 其对高温也非常敏感, 高温可导致其结构的改变[39]。本次温度实验, 5℃处理1 h后鼠尾藻嫩芽Fv/Fm、RrET,max和初始斜率α值均发生不同程度的降低, 但恢复培养24 h后上述参数均能基本恢复正常(P>0.05), 而32℃和34℃组处理1 h后上述参数均显著降低且不能恢复正常。这表明短时间的低温处理对鼠尾藻嫩芽的光合系统没有大的破坏性, 而温度大于 32℃时使鼠尾藻嫩芽光合电子传递过程受抑制和损伤, 光合电子传递速率下降, 光能利用效率下降。同为马尾藻属, 铜藻的幼苗在 35℃高温下胁迫1 h也对其PSII造成了非逆转的损伤, 其可耐受的温度上限为28℃[14], 而羊栖菜幼苗却能耐受长达6 h的40℃高温[13]。
羊栖菜的幼苗能耐受淡水 6 h的低盐胁迫[13];铜藻幼苗同样具有较强耐受盐度变化的能力, 其能耐受高盐60处理6 h和低盐0处理1 h[14]。本次盐度胁迫的实验结果说明即使是低盐度0和高盐度50处理 9 h, 在恢复培养 24 h后鼠尾藻嫩芽的Fv/Fm和RrET,max值也基本能恢复到正常水平(P>0.05), 表明鼠尾藻嫩芽也能够耐受较大范围的渗透压变化。有研究指出, Na+传递系统是藻类耐盐的最重要决定因素[40]; Na+转运ATP酶在藻细胞质离子动态平衡中起着关键作用[41]。那么, 鼠尾藻嫩芽是否可能具有较强大的离子传递系统, 还有待进一步研究验证。
综上所述, 鼠尾藻嫩芽易受强光、高温胁迫, 在强光照射下, 其Fv/Fm值明显降低, 温度大于30℃时对其光合作用有显著影响。5℃低温处理1 h或0~60盐度处理9 h后, 鼠尾藻嫩芽的光系统Ⅱ受到显著影响, 但24 h恢复后, 除了盐度60组, 其他组的叶绿素荧光参数均可基本恢复正常。所以在养殖过程中,鼠尾藻嫩芽生长阶段应采取遮光、降温等措施, 若要除去对低盐敏感的附生生物, 可用淡水冲洗或浸泡数小时。
[1]韩晓弟, 李岚萍. 鼠尾藻特征特性与利用[J]. 特种经济动植物, 2005, (1):27.
[2]林超, 于曙光, 郭道森, 等. 鼠尾藻中褐藻多酚化合物的抑菌活性研究[J]. 海洋科学, 2006, 30(3):94-97.
[3]刘朝阳, 孙晓庆, 范士亮. 当前刺参养殖面临的主要困境及发展策略[J]. 饲料工业, 2006, 27(22):28-30.
[4]史大永, 李晓红, 李敬, 等. 海藻提取物环氧加酶-2抑制活性研究[J]. 海洋科学, 2009, 33(7):30-32.
[5]魏玉西, 于曙光. 两种褐藻乙醇提取物的抗氧化活性研究[J]. 海洋科学, 2002, 26(9):49-51.
[6]吴海一, 詹冬梅, 刘洪军, 等. 鼠尾藻对重金属锌、镉富集及排放作用的研究[J]. 海洋科学, 2010, 34(1):69-74.
[7]王飞久, 孙修涛, 李锋. 鼠尾藻的有性繁殖过程和幼苗培育技术研究[J]. 海洋水产研究, 2006, 27(5):1-6.
[8]孙修涛, 王飞久, 汪文俊, 等. 基于有性繁殖的鼠尾藻规模化繁育试验[J]. 渔业科学进展, 2010, 31(3):84-91.
[9]邹吉新, 李源强, 刘雨新, 等. 鼠尾藻的生物学特性及筏式养殖技术研究[J]. 齐鲁渔业, 2005, 22(3):25-29.
[10]张泽宇, 李晓丽, 韩余香, 等. 鼠尾藻的繁殖生物学及人工育苗的初步研究[J]. 大连水产学院学报, 2007,22(4):255-259.
[11]詹冬梅, 李美真, 丁刚, 等. 鼠尾藻有性繁育及人工育苗技术的初步研究[J]. 海洋水产研究, 2006, 27(6):55-59.
[12]潘金华, 张全胜, 许博. 鼠尾藻有性繁殖和幼孢子体发育的形态学观察[J]. 水产科学, 2007, 26(11):589-592.
[13]Pang S J, Zhang Z H, Zhao H J, et al. Cultivation of the brown algaHizikia fusiformis(Harvey) Okamura:stress resistance of artificially raised young seedlings revealed by chlorophyll fluorescence measurement[J].Journal of Applied Phycology, 2007, 19(5):557-565.
[14]张玉荣, 刘峰, 单体锋, 等. 利用叶绿素荧光技术揭示人工培育的铜藻幼苗对胁迫温度、光照和盐度的反应[J]. 南方水产, 2009, 5(2):1-9.
[15]Govindje E. Sixty-three years since Kautsky:Chlorophyll a fluorescence[J]. Australian Journal of Plant Physiology, 1995, 22(2):131-160.
[16]陈建明, 俞晓平, 程家安. 叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J]. 浙江农业学报, 2006,18(1):51-55.
[17]陈贻竹, 李晓萍, 夏丽, 等. 叶绿素荧光技术在植物环境胁迫研究中的应用[J]. 热带亚热带植物学报,1995, 3(4):79-86.
[18]梁英, 冯力霞, 尹翠玲, 等. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景[J]. 海洋科学,2007, 31(1):71-76.
[19]王帅, 梁英, 冯力霞, 等. 重金属胁迫对杜氏盐藻生长及叶绿素荧光特性的影响[J]. 海洋科学, 2010,34(10):38-48.
[20]王昭玉, 王江涛. 叶绿素荧光检测技术在浮游植物营养盐限制研究中的应用[J]. 海洋科学, 2008, 32(12):97-101.
[21]Lin A P, Wang G C, Shen S D, et al. Two specific causes of cell mortality in freeze-thaw cycle of young thalli ofPorphyra yezoensis(Bangiales, Rhodophyta)[J]. Journal of Phycology, 2010, 46(4):773-779.
[22]Wang Z Y, Wang G C, Niu J F, et al. Optimization of conditions for tetraspore release and assessment of photosynthetic activities for different generation branches of Gracilaria lemaneiformis Bory[J]. Chinese Journal of Oceanology and Limnology, 2010, 28(4):738-748.
[23]Lin A P, Shen S D, Wang G C, et al. Comparison of chlorophyll and photosynthesis parameters of floating and attachedUlva prolifera[J]. Journal of Integrative Plant Biology, 2011, 53(1):25-34.
[24]Pang S J, Jin Z H, Sun J Z, et al. Temperature tolerance of young sporophytes from two populations ofLaminaria japonicarevealed by chlorophyll fluorescence measurements and short-term growth and survival performances in tank culture[J]. Aquaculture, 2007, 262(2):493-503.
[25]王增福. 鼠尾藻的生理生态和繁殖生物学研究[D].中国科学院海洋研究所, 2007.
[26]孙修涛, 王飞久, 刘桂珍. 鼠尾藻新生枝条的室内培养及条件优化[J]. 海洋水产研究, 2006, 27(5):7-12.
[27]Peter J R, Rolf G. Rapid light curves:A powerful tool to assess photosynthetic activity[J]. Aquatic Botany, 2005,82(3):222-237.
[28]Schreiber U, Gademann R, Ralph P J, et al. Assessment of photosynthetic performance of prochloron inLissoclinum patellain hospite by chlorophyll fluorescence measurements[J]. Plant and Cell Physiology, 1997,38(8):945-951.
[29]张守仁. 叶绿素荧光动力学参数的意义及讨论[J].植物学通报, 1999, 16(4):444-448.
[30]Kolber Z, Zehr J, Falkowski P G. Effects of growth irradiance and nitrogen limitation on photosynthesis energy conversion in photosystem II[J]. Plant Physiology, 1988, 88(3):923-929.
[31]许大全, 张玉忠, 张荣铣. 植物光合作用光抑制[J].植物生理学通讯, 1992, 28(4):237-243.
[32]Krause G H. Photoinhibition of photosynthesis:an evaluation of damaging and Protective mechanisms[J].Physiologia Plantarum, 1988, 74(3):566-574.
[33]Dodd I C, Critchley C, Woodall G S, et al. Photoinhibition in differently coloured juvenile leaves of syzygium species[J]. Journal of Experimental Biology, 1998,49(325):1 437-1 445.
[34]Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis:The basics[J]. Annual Reviews of Plant Physiology and Plant Molecular Biology, 1991, 42:313-349.
[35]郭连旺, 沈允钢. 高等植物光合机构避免强光破坏的保护机制[J]. 植物生理学通讯, 1996, 32(1):1-8.
[36]李新国, 孟庆伟, 赵世杰. 强光胁迫下银杏叶片的光抑制及其防御机制[J]. 林业科学, 2004, 40(3):56-59.
[37]Morgan-Kiss R, Ivanov A G, Williams J, et al. Differential thermal effects on the energy distribution between photosystemⅡ and photosystemⅠ in thylakoid membranes of a psychrophilic and mesophilic alga[J].Biochimicaet Biophysica Acta, 2002, 1 561(2):251-265.
[38]Wen X, Gong H, Lu C. Heat stress induces an inhibi-tion of excitation energy transfer from phycobilisomes to photosystem II but not to photosystem I in a cyanobacteriumSpirulina platensis[J]. Plant Physiology and Biochemistry, 2005, 43(4):389-395.
[39]郭延平, 周慧芬, 曾光辉, 等. 高温胁迫对柑橘光合速率和光系统活性的影响[J]. 应用生态学报, 2003,14(6):867-870.
[40]Serrano R, Mulet J M, Rios G, et al. A glimpse of the mechanisms of ion homeostasis during salt stress[J].Journal of Experimental Botany, 1999, 50:1023-1036.
[41]Balnokin Y, Popova L, Gimmler H. Further evidence for an ATP-driven sodium pump in the marine algaTetraselmis (Platymonas) viridis[J]. Journal of Plant Physiology, 1997, 150:264-270.
Effects of light intensity, temperature and salinity on newborn branches ofSargassum thunbergiievaluated with chlorophyll fluorescence assay
LIANG Zhou-rui1,2, WANG Fei-jiu1, SUN Xiu-tao1, WANG Wen-jun1, DING Chang-ling1, LI Tao1
(1. Key Laboratory for Sustainable Utilization of Marine Fishery Resources, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. Aquatic and Life School, Shanghai Ocean University, Shanghai 201306, China)
May, 13, 2011
Sargassum thunbergii; stress condition; chlorophyll fluorescence parameters
The effects of different light intensity (25~220 μmol/(m2·s)), temperatures (5~34℃) and different salinities (0~60) on chlorophyll fluorescence parameters of newborn branches ofSargassum thunbergiiwere studies in this paper. The optimal chlorophyll fluorescence quantum yield of photosystem II (Fv/Fm), maximum relative electron transport rate (RrET,max) and initial slope of rapid light curve were determined. The results show:(1) The newborn branch ofS. Thunbergiisuffered from high intensity light and high temperature stress easily and theFv/Fmdecreased significantly under high intensity light. The photosynthesis was remarkably affected when the temperature was higher than 30℃. (2) One hour treatment at 5℃ or nine-hour treatment at 0~60 salinity affected the photosystem II obviously. However, the chlorophyll fluorescence parameters could nearly recover to normal level after 24 hours under standard culture condition except those in 60 salinity group. The preliminary analysis of the newborn branches ofS. thunbergiiabout resistance physiology could provide reference for the artificial cultivation ofS.thunbergii.
Q945.78
A
1000-3096(2011)12-0021-07
2011-05-13;
2011-08-12
国家“863”计划项目(2006AA10A416, 2012AA100813); 公益性行业(农业)专项(200903030)
梁洲瑞(1986-), 男, 广西钦州人, 硕士研究生, 主要从事海藻生物学研究, E-mail:liangzhourui@163.com; 王飞久, 通信作者, 研究员, E-mail:wangfj@ysfri.ac.cn, 电话:0532-85838673
张培新)

