对照组和雌核发育牙鲆血清中睾酮与雌二醇水平的比较
孙 鹏, 尤 锋 李 军 宋宗城, 张培军
(1. 中国科学院 海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国水产科学研究院 东海水产研究所 农业部海洋与河口渔业资源及生态重点开放实验室, 上海 200090; 3. 威海圣航水产科技有限公司, 山东 威海 264200)
对照组和雌核发育牙鲆血清中睾酮与雌二醇水平的比较
孙 鹏1,2, 尤 锋1, 李 军1, 宋宗城3, 张培军1
(1. 中国科学院 海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国水产科学研究院 东海水产研究所 农业部海洋与河口渔业资源及生态重点开放实验室, 上海 200090; 3. 威海圣航水产科技有限公司, 山东 威海 264200)
采用放射性免疫方法测定和比较了人工诱导的雌核发育牙鲆(Paralichthys olivaceus)与对照组牙鲆血清中睾酮(T)和雌二醇(E2)水平。研究发现, 雌核发育牙鲆个体中的T含量显著高于对照组牙鲆个体(P<0.05), 而其 E2含量则略低于对照组个体; 在雌核发育牙鲆中, 卵巢发育不正常的个体比发育正常的个体中的T含量稍高, 而E2含量则显著低于正常雌核发育牙鲆个体和对照组牙鲆个体(P< 0.05)。可以推测, 雌核发育牙鲆和对照组牙鲆体内T和E2水平存在差异, 且雌核发育牙鲆中卵巢发育正常与不正常的个体之间T和E2也存在差异, 而这种差异可能导致了雌核发育牙鲆部分个体卵巢发育异常。本研究将为正常二倍体及雌核发育牙鲆性腺发育和内分泌学研究提供信息支持。
牙鲆(Paralichthys olivaceus); 雌核发育; 卵巢; T; E2
鱼类雌核发育是单性生殖的一种, 它是指卵子经过精子激活后正常进行胚胎发育, 但是卵原核并未与精原核融合, 而单独由卵核发育成个体的生殖现象。在人工雌核发育诱导时, 精子经过遗传物质灭活但仍有激活卵子正常发育的能力, 将其与正常卵子受精后, 通过抑制卵裂或者第二极体的排放而分别产生同质和异质雌核发育二倍体[1]。人工诱导雌核发育技术是20世纪50年代后期首先从国外发展起来的, 70年代末期, 我国也开始了这一领域的研究。目前, 国内外学者通过人工诱导雌核发育, 已经成功培育了虹鳟(Oncorhynchus mykiss)、牙鲆(Paralichthys olivaceus)、漠斑牙鲆(Paralichthys lethostigma)、庸鲽(Hippoglossus hippoglossus)、舌齿鲈(Dicentrarchus labraxL.)、大菱鲆(Scophthalmus maximus)等多种经济鱼类的克隆品系[2], 为养殖新品种的开发以及性别决定、单性生殖等生物学研究提供了宝贵的素材。
牙鲆雌性个体较雄性个体生长快, 培育全雌牙鲆可以缩短养殖周期, 增加经济效益。其染色体性别类型推测为XX-XY型, 故通过人工雌核发育技术可以诱导出100%的XX遗传型的牙鲆个体[3]。目前, 对于雌核发育牙鲆的诱导和性腺分化发育已有研究报道[1,4-5], 而对于其性类固醇激素水平方面还未见报道。众所周知, 性类固醇激素在性腺发育过程中起着极其重要的作用[6-7], 本研究通过对课题组诱导培育的雌核发育牙鲆进行抽血和解剖观察, 测定和比较了雌核发育和普通牙鲆个体以及雌核发育群体中性腺异常和性腺正常个体之间的睾酮(T)和雌二醇(E2)水平, 以期从内分泌学角度解释其性腺发育异常的原因, 并为今后全雌牙鲆培育提供组织学和内分泌学方面的参考。
1 材料与方法
1.1 材料及样品的采集
本研究所选取样品为2007年4月诱导获得、并经过两年多培育的雌核发育牙鲆成鱼。雌核发育诱导方法和条件为:将经紫外线照射(剂量为 3.6×10-3J/mm2)的牙鲆精子与正常卵受精, 受精后 5 min, 实施冷休克处理, 处理时间 45 min, 处理水温 0~2℃,处理后过渡到 15℃海水中进行孵化。鱼苗、苗种和成鱼培育采用常规方法。
2009年 2月, 随机选取其中 12尾(平均全长为28.7 cm±4.2 cm), 进行静脉取血, 之后进行解剖, 取其性腺进行观察和记录。同时, 选取6尾同期培育的普通牙鲆个体, 进行抽血、解剖观察作为对照。所取血液于常温下放置4~6 h, 然后在8 000 r/min下离心12 min,取上层血清, 储存于-20℃待测。
1.2 性腺样品的组织切片
所取性腺样品于Bouin’s液中固定24 h, 然后转入70%乙醇中保存。固定的样品用石蜡包埋, 做连续切片, 切片厚度 5~6 μm, H.E.染色, 用 Nikon 显微镜观察, 并拍照记录。
1.3 血清中T与E2含量的测定
上述获得的雌核发育和对照组牙鲆的血清样品用于T与E2含量的测定。T和E2测定所需的放射免疫测定试剂盒购自潍坊三维生物工程集团有限公司, E2的测定灵敏度为 1.1 pg/mL, 批内变异系数≤10%, 批间变异系数≤10%。T的测定灵敏度为0.05 μg/L, 批内变异系数≤10%, 批间变异系数≤10%。样品测定均采用双管平行。通过DFM-96型10管放射免疫γ计数器得出读数, 然后根据Log-logit法作出标准曲线, 再从标准曲线中读出相应的浓度。
1.4 数据分析
血清中T和E2含量均用平均值±标准误表示。用SSCP13.0统计软件包对不同组中血清T和E2含量进行统计分析, 当P<0.05时认为差异显著。
2 结果
2.1 雌核发育牙鲆性腺的解剖学和组织学观察
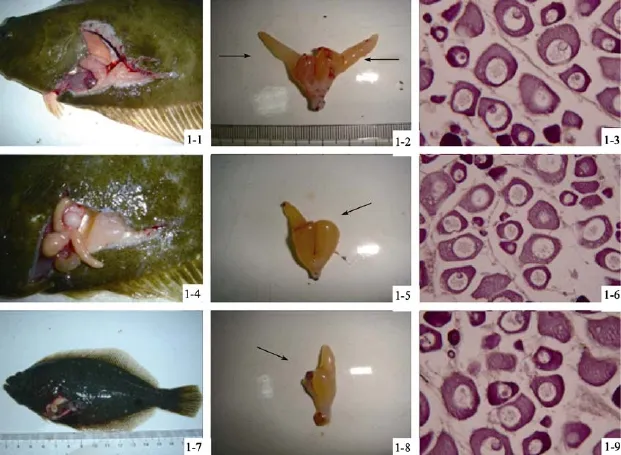
图1 雌核发育牙鲆中发育正常和异常的性腺比较Fig. 1 Comparison of normal and abnormal gonad in gynogenetic Paralichthys olivaceus
本研究共选取对照组2龄牙鲆雌性个体6尾和2龄雌核发育牙鲆12尾进行观察和分析。经解剖观察发现, 在对照组雌性牙鲆个体中, 性腺饱满, 为黄白色, 血管丰富。12尾雌核发育牙鲆的性腺均为卵巢,其中卵巢形态正常的有 5尾, 与对照组牙鲆的卵巢相似, 占总体的41.67%; 性腺发育不完全的有7尾。图1为雌核发育牙鲆性腺解剖学与组织学观察结果。从图上可以看出, 正常的雌核发育牙鲆卵巢为一对,呈对称分布。每个卵巢的一端向下延伸, 与泄殖孔相连接, 而另一端较饱满, 位于腹部靠近肾脏处, 并向后腹部延伸(图1-1~图1-3)。图1-4~图1-9为发育不完全或者畸形的卵巢组织, 卵巢两侧均不对称, 其中一侧或多或少地缺失一部分(图1-4、图1-5), 有的甚至整个性腺发育较差(图1-7、图1-8)。切片结果表明, 其性腺处于卵巢Ⅱ期, 主要以第2时相卵母细胞为主, 细胞多呈梨形或卵圆形, 细胞质强嗜碱性而呈蓝紫色, 细胞核位于卵细胞中央, 核内染色质成丝网状, 在细胞质中出现颗粒状的油滴。但是, 比较发现雌核发育牙鲆中性腺正常和畸形个体的性腺组织细胞结构方面并未有明显差异(图1-3、图1-6、图1-9)。
2.2 雌核发育牙鲆个体血清中T和E2水平的比较
图2为对照组雌性和雌核发育牙鲆血清中T水平的比较。从图中可以看出, 对照组牙鲆个体血清中的睾酮含量(0.109 μg/L±0.028 μg/L)显著低于雌核发育个体(P<0.05); 而在雌核发育群体中, 性腺发育较差的个体(0.171μg/L±0.095μg/L )比性腺发育正常的个体中(0.163μg/L±0.071μg/L )的睾酮含量稍高。

图2 对照组和雌核发育牙鲆血清中T水平的比较Fig. 2 Comparison of T levels among control diploid and gynogenetic P. olivaceus
图3为对照组和雌核发育牙鲆血清中E2水平的比较, 由此看出对照组的 E2含量(88.372 ng/L±29.457 ng/L)高于雌核发育牙鲆, 而在雌核发育牙鲆中, 性腺发育较差个体的 E2含量(39.989 ng/L±16.285 ng/L)显著低于正常雌核发育(78.40 ng/L±7.140 ng/L)和对照组牙鲆(P< 0.05)。
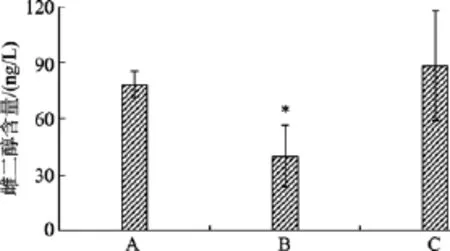
图3 对照组和雌核发育牙鲆血清中E2水平的比较Fig. 3 Comparison of E2 levels among control diploid and gynogenetic P. olivaceus
3 讨论
在人工诱导的许多鱼类雌核发育个体中, 往往会发现一些个体的性腺不能正常发育。不正常的现象不仅体现在外观上, 组织切片发现其卵巢中甚至含有大量不能完全成熟的卵细胞, 且常充满结缔组织。Fujioka[8]和Arai[9]等认为这可能是由于在雌核发育二倍体中某些隐性基因表达影响了其性腺发育的一些关键过程。这种现象在牙鲆[10]、鲤鱼[11]等种类中均有报道。但在某些种类中, 如泥鳅(Misgurnus anguillicaudatus)[12]、胡子鲶(Clarias macrocephalus)[13]、欧鲈(Dicentrarchus labrax)[14]雌核发育雌鱼性腺发育与其二倍体雌鱼对照相似, 没有发现异常现象。通过解剖学观察, 发现诱导培育的雌核发育牙鲆中, 有较多的个体性腺发育不正常。在这些个体中,性腺或者发育较小, 或者不能形成两个完整的卵巢,甚至有些个体仅有一边卵巢。
T和E2水平检测比较发现, 雌核发育个体中的E2含量也均低于对照组牙鲆个体中的含量, 这与欧鲈中的报道是类似的[15]。进一步比较发现, 性腺发育有缺陷的雌核发育牙鲆个体中E2水平显著低于性腺发育较好的个体, 而 T含量却比发育较好的个体中的高。在鱼类中, T作为雄激素(如 11-KT)和雌激素(如 E2)合成的前体物质间接地发挥作用[6,16-17], 而E2是卵巢的诱导源[6-7,18]。基于性激素在性腺发生、分化与发育成熟过程中的重要性, 目前多种鱼类中已有性激素相关的报道。对雌性斜带石斑鱼(Histriculus similes)[19]研究发现, 在生殖季节成熟雌鱼血清中E2和T含量最高, 平均性腺成熟系数(GSI)显著高于其他月份, 并且性激素水平的季节变化与GSI的变化基本一致。同时, 运用性激素处理也可以在一些鱼类中实现性逆转。例如, 利用甲基睾酮处理雌性赤点石斑鱼[20], 可以导致其发生不同程度的性逆转, GSI指数明显下降, 性腺中卵细胞退化, 精原细胞增值, 出现大量精母细胞和精子细胞, 性逆转雄鱼甚至可以变为功能性雄鱼, 经轻微的腹部挤压可以排精, 且精子活力与正常雄鱼相似。
此外, 雌性和雄性激素的比例常影响着鱼体性腺的分化与发育[19]。在对褐鳟(Salmo trutta)[18]的研究中发现, 雌性性腺从 9月份至第二年 2月份期间GSI指数和性激素水平变化不大, 2月份后GSI指数迅速上升, 5月份达到最高值; T和E2含量与GSI指数变化趋势相似, 也是5月份达到最高值, 之后均又开始下降。卵子成熟过程也与 GSI指数和性激素含量变化吻合。这与牙鲆性腺成熟规律很相似。但是,在相同性腺发育时期, 鲑鱼血清中E2/T含量的比值1.0~1.2左右, 雌核发育雌鱼性腺发育正常个体中为0.48, 发育异常个体中仅为 0.23, 显著低于正常二倍体的比值(0.18) (P<0.05)。我们推测这种差异引起了雌核发育群体中不同个体间性激素比值的差别。而雌性个体中雌性性激素水平比值的降低可能导致了其性腺发育不完全, 但这还需要进一步研究。
迄今, 有关雌核发育鱼类性腺发育情况的报道并不多, 其内分泌学方面的报道更少, 本研究从内分泌学水平研究了雌核发育与对照组牙鲆血清中 T和E2水平的差异, 为进一步开展相关研究提供了参考。
[1]徐成. 牙鲆雌核发育分析鉴定与性别决定机制研究[D]. 北京:中国科学院, 2000, 1-34.
[2]胡则辉, 徐君卓. 人工诱导海水鱼类雌核发育的研究进展[J]. 海洋渔业, 2007, 29(1):78-83.
[3]Yamamoto E. Studies on sex-manipulation and production of cloned populations in hirame,Paralichthys olivaceus(TemmincketSchlegel)[J]. Aquaculture,1999, 173:235-246.
[4]杨世勇. 雌核发育牙鲆的性腺发育和微卫星标记分析[D]. 大连:大连水产学院, 2005, 1-21.
[5]尤锋, 许建和, 倪静, 等. 牙鲆同质雌核发育人工诱导研究[J]. 高技术通讯, 2008, 18(8):874-880.
[6]Nakamura M, Bhandari R K, Higa M. The role estrogens play in sex differentiation and sex changes of fish[J]. Fish Physiology and Biochemistry, 2003, 28:113-117.
[7]Guzman J M, Norberg B, Ramos J, et al. Vitellogenin,steroid plasma levels and spawning performance of cultured female Senegalese sole (Solea senegalensis)[J].General and Comparative Endocrinology, 2008, 156:285-297.
[8]Fujioka K. Survival, growth and sex ratios of gynogenetic diploid honmoroko[J]. Journal of Fish Biology,1998, 52:430-442.
[9]Arai K. Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan[J]. Aquaculture, 2001, 197:205-228.
[10]Tabata K, Gorie S, Nakamura K. Induction of gynogenetic diploid in hirameParalichthys olivaceus[J]. Nippon Suisan Gakkaishi, 1986, 52(11):1 901-1 904.
[11]Komen J, Bongers A B J, Richter C J J, et al. Gynogenesis in common carp (Cyprinus carpio):Ⅱ. The production of homozygous gynogenetic clones and F1 hybrids[J]. Aquaculture, 1991, 92:127-142.
[12]Suzuki R, Oshiro T, Nakanishi T. Survival, growth and fertility of gynogenetic diploids induced in the cyprinid loach,Misgurnus anguillicaudatus[J]. Aquaculture,1985, 48:45-55.
[13]Na-Nakorn U. Comparison of cold and heat shocks to induce diploid gynogenesis in thai walking catfish(Clarias macrocephalus) and performances of gynogens[J]. Aquat Living Resour, 1995, 8:333-341.
[14]Felip A, Piferrer F, Zanuy S, et al. Comparative growth performance of diploid and triploid European sea bass over the first four spawning seasons[J]. Journal of Fish Biology, 2001, 58:76-88.
[15]Rougeot C, Krim A, Mandiki S N M, et al. Sex steroid dynamics during embryogenesis and sexual differentiation in Eurasian perch,Perca fluviatilis[J]. Theriogenology, 2007, 67:1 046-1 052.
[16]Rothbard S, Yaron Z. Changes in steroids concentrations during sexual ontogenesis in tilapia[J]. Aquaculture, 1987, 61:59-74.
[17]Fitzpatrick M S, Pereira C B, Schreck C B. In vitro steroid secretion during early development of mono-sex rainbow trout:sex differences, onset of pituitary control,and effects of dietary steroid treatment[J]. General and Comparative Endocrinology, 1993, 91:199-215.
[18]Estay F, Diaz A, Pedrazza R, et al. Oogenesis and plasma levels of sex steroids in cultured females of Brown Trout (Salmo truttaLinnaeus, 1758) in Chile[J]. Journal of Experimental Zoology, 2003,298A:60-66.
[19]赵会宏, 刘晓春, 刘付永忠, 等. 斜带石斑鱼雌鱼卵巢发育与血清性类固醇激素的生殖周期变化[J]. 中山大学学报(自然科学版), 2003, 42(6):56-59.
[20]李广丽, 刘晓春, 林浩然. 17-甲基睾酮对赤点石斑鱼性逆转的影响[J]. 水产学报, 2006, 30(2):145-150.
Comparison of the levels of T and E2 in normal and gynogeneticParalichthys olivaceus
SUN Peng1,2, YOU Feng1, LI Jun1, SONG Zong-cheng3, ZHANG Pei-jun1
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences,Qingdao 266071, China; 2. Key and Open Laboratory of Marine and Estuarine Fisheries Resources and Ecology,East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;3. Shenghang Science and Technology Co., Ltd, Weihai 264200, China)
Nov., 3, 2010
Paralichthys olivaceus; gynogenesis; ovary; T; E2
Levels of serum T and E2 were analyzed by radioimmunoassay (RIA) in gynogenetic and control diploid individuals ofParalichthys olivaceus. Gynogenetic individuals had higher T levels and lower E2 levels than those control diploid individuals. In addition, higher T level and lower E2 level are observed in individuals with abnormal ovary when compared with gynogenetic and control diploid flounders. We suggested that there might be difference in serum T and E2 levels between gynogenetic and control diploidP. olivaceus, and also between gynogenetic individuals with normal and abnormal ovary development. These differences probably resulted in the abnormal ovary development of some gynogenetic individuals. The results will provide information to study ovary development and endocrinology of normal and gynogenetic flounders.
Q418 文献标识码:A 文章编号:1000-3096(2011)12-0010-05
2010-11-03;
2010-12-08
中央级公益性科研院所基本科研业务费项目(东2009M05);公益性行业(农业)科研专项经费项目(200903046); 国家“863”计划资助项目(2006AA10A404); 鲆鲽类产业技术体系(nycytx-50); 山东省自然科学基金资助项目(ZR2010CM007)
孙鹏(1980-), 博士, 助理研究员, 主要从事海水鱼类遗传与发育学研究, E-mail:sunpeng1128@163.com; 尤锋, 通信作者, E-mail:youfeng@qdio.ac.cn
谭雪静)

