L-缬氨酸产生菌的原生质体融合及抗高糖融合株的筛选
袁丹丹, 张伟国
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
L-缬氨酸产生菌的原生质体融合及抗高糖融合株的筛选
袁丹丹, 张伟国*
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
通过原生质体融合技术选育出一株抗高糖的融合株。以黄色短杆菌(B revibacterium flavum)NV 128和黄色短杆菌(B.f lavum)JV 16(Leu-Ile-M et-)为亲本菌株,通过单灭活原生质体融合、高糖梯度平板筛选及进一步的硫酸二乙酯(DES)诱变,获得了一株L-缬氨酸高产菌NJ-237。同时研究了影响原生质体形成、再生的3种重要条件(青霉素、酶和渗透压稳定剂),并确定了其最佳处理浓度和时间。该融合株经7 L发酵罐培养72 h L-缬氨酸达到46.8 g/L,糖酸转化率为27.7%,比两亲株都有显著提高。
L-缬氨酸;原生质体融合;高糖抗性
支链氨基酸包括L-缬氨酸、L-亮氨酸和L-异亮氨酸,都属于人体必需氨基酸,因其特殊的结构和功能在人类生命代谢中占有非常重要的地位。L-缬氨酸应用范围广阔,在医药、食品和饲料等方面有着其它营养物质不可替代的作用,尤其是在医药方面,如配制氨基酸输液和其它治疗药物,近年来研究发现,L-缬氨酸是一种治疗高血压特效药——缬沙坦的原料,其需求量猛增[1]。
原生质体融合(p rotop last fusion)是一种重要的基因组重组方法[2]。黄色短杆菌NV 128,α-氨基丁酸(α-AB)和γ-氨基丁酸 (γ-AB)抗性 ,培养条件粗放,可积累一定量的 L-缬氨酸;黄色短杆菌JV 16,培养条件较苛刻,但缬氨酸产量比NV 128要高。通过原生质体融合可能达到优势互补,筛选到培养条件粗放但产酸水平又高的理想融合子,为缬氨酸产生菌育种开辟一条新途径。
1 材料与方法
1.1 实验材料
1.1.1 菌种 黄色短杆菌(B revibacterium f lavum)NV 128,作者所在实验室筛选;黄色短杆菌(B revibacterium flavum)JV 16(Leu-Ile-M et-),作者所在实验室保藏。
1.1.2 完全培养基(g/L) 葡萄糖5,牛肉膏 10,蛋白胨 10,NaCl 5,琼脂 20。
1.1.3 基本培养基(g/L) 葡萄糖 20,(N H4)2SO41.5,KH2PO41,K2HPO4·3H2O 3,M gSO4·7H2O 0.1,M nSO4·4H2O 0.01,FeSO4·7H2O 0.01,VH 30μg/L,VB1100μg/L,尿素1.5,琼脂 20。
1.1.4 种子培养基(g/L) 葡萄糖 25,(NH4)2SO45,KH2PO41,M gSO4·7H2O 0.5,玉米浆35,CaCO310。
1.1.5 NV 128发酵培养基(g/L) 葡萄糖 125,(NH4)2SO440,KH2PO41,M gSO4·7H2O 0.5,玉米浆 12,V H 50μg/L,VB1100μg/L,CaCO330。1.1.6 JV 16发酵培养基(g/L) 葡萄糖 125,(N H4)2SO440,KH2PO41,M gSO4·7H2O 0.5,玉米浆12,L-Ile 0.2,L-Leu 0.2,L-M et 0.2,V H 50 μg/L,VB1100μg/L,CaCO330。
1.1.7 高糖平板 基本培养基中加入适量葡萄糖。1.1.8 原生质体再生培养基(mol/L) 完全培养基中加入NaCl 0.6,M gCl20.02,p H 7.0。
1.1.9 原生质体再生液体培养基 不加琼脂的原生质体再生培养基。
1.1.10 高渗液(mol/L) NaCl 0.55,丁二酸钠0.2,M gCl20.02,p H 7.0。
1.1.11 PEG溶液 PEG-6000质量分数 35%,NaCl 0.3 mol/L,M gCl20.02 mol/L,p H 7.0。
1.1.12 蛋清溶菌酶溶液 高渗液配制的10 g/L的蛋清溶菌酶,用0.22μm细菌过滤器过滤除菌,现配现用。
1.1.13 青霉素溶液 将青霉素钠(160万单位)用生理盐水配成50 U/m L备用,现配现用。完全、基础和种子培养基均以质量分数20%NaOH调p H至7.2,0.1 M Pa压力下灭菌20 min。发酵培养基以质量分数20%NaOH调至p H7.2,0.07 M Pa压力下灭菌8 min。
1.2 实验方法
1.2.1 抗结构类似物融合亲株NV 128的筛选将黄色短杆菌NV 12经紫外线和DES逐级诱变,筛选出抗α-AB和γ-AB的融合亲株NV 128。
1.2.2 原生质体的制备与再生 参考文献[3]进行。
1.2.3 原生质体的灭活 将上述NV 128原生质体悬浮液放入60 ℃水浴锅中维持 5、10、15、20、25、30 m in,分别取0.1 m L经过适当稀释后涂布于再生完全培养基平板上,30℃培养2~3 d,观察原生质体灭活效果[4]。
1.2.4 原生质体融合 取两亲株原生质体悬浮液各2 m L加入10 mL离心管中,离心洗涤两次,加入4 m L质量分数35%PEG溶液,再加入一定量CaCl2溶液使其终浓度达到0.01 mol/L,水浴保温10 min,离心洗涤两次弃上清,用等体积的高渗液悬浮,即为原生质体融合细胞悬浮液。
1.2.5 融合株高糖梯度平板的筛选[5]取1 m L原生质体融合细胞悬浮液加入到20 m L液体再生完全培养基中,32℃摇瓶培养6 h,取菌液经适当稀释涂布在高糖梯度平板上,培养2~5 d,观察菌体生长情况,挑取在菌落稀少及几乎空白区域所长出的少数菌落,经过初筛和复筛,选出高产融合株。然后再对融合株进行DES诱变,高糖梯度平板筛选,挑出高产株。
1.3 分析方法
1.3.1 p H的测定 采用精密p H试纸以及 PHS-3C精密p H计测定。
1.3.2 菌体生长 吸取菌液0.2 m L到5 mL浓度为0.25 mol/L HCl中,摇匀后测定A562nm值。
1.3.3 葡萄糖 采用SBA-40C多功能谷氨酸—葡萄糖生物传感分析仪测定。
1.3.4 L-缬氨酸 纸上层析法、比色定量法[6]和氨基酸分析仪测定。
2 结果与讨论
原生质体的制备和再生受很多因素的影响,如菌体生理状态、酶解前的预处理、酶的浓度与处理时间、渗透压、酶解温度、p H和再生培养基成分等,首先在实验前测定细胞的再生率,否则就很难确定不能融合或融合率低是由于双亲原生质体本来就无活性,还是由于融合条件不适合所致[7]。
2.1 青霉素处理浓度和时间的确定
2.1.1 青霉素处理浓度的确定 在溶菌酶处理前,加入一定量的青霉素进行前处理,青霉素能干扰细菌细胞壁的合成,致使细胞壁疏松,便于溶菌酶处理,从而缩短酶解时间,提高原生质体的存活率[8]。图1为青霉素浓度与亲株对溶菌酶敏感性的关系,作用时间为2 h。

图1 青霉素浓度与亲株对溶菌酶敏感性的关系Fig.1 Effect of penicillin concentration on the sensitivity of parent strains to lysozyme
实验结果表明,随着青霉素浓度的增加,两亲株对溶菌酶的敏感性逐渐提高。经过青霉素处理后的NV 128吸光度变化大,说明对溶菌酶敏感性比JV 16较高。对于菌体NV 128和JV 16,当青霉素浓度分别在0.5、1.0 U/m L时,对菌体生长没有抑制作用且能提高菌体对溶菌酶的敏感性。
2.1.2 青霉素处理时间的确定 在确定青霉素浓度的条件下,测定了其处理时间与亲株对溶菌酶的敏感性,由图2可以看出,随着青霉素处理时间的延长,亲株NV 128从1.5 h开始吸光度无明显变化,JV 16从2h开始吸光度也无明显变化,说明其在1.5和2.0 h时两亲株对溶菌酶的敏感性已达最大,所以分别选取1.5、2.0 h为 NV 128和JV 16的最佳处理时间。
2.2 溶菌酶浓度和时间对原生质体形成和再生的影响
2.2.1 溶菌酶浓度对原生质体形成与再生的影响
溶菌酶的用量关系到原生质体的形成率与再生率,低质量浓度的溶菌酶不利于原生质体的形成,而高浓度的原生质体会使细胞壁破坏太彻底,不利于原生质体的再生,更高的质量浓度还会使细胞膜系统受到破坏,细胞彻底溶解,适量的溶菌酶浓度对后续工作非常重要[9]。溶菌酶质量浓度对原生质体形成率与再生率的关系如图3所示。
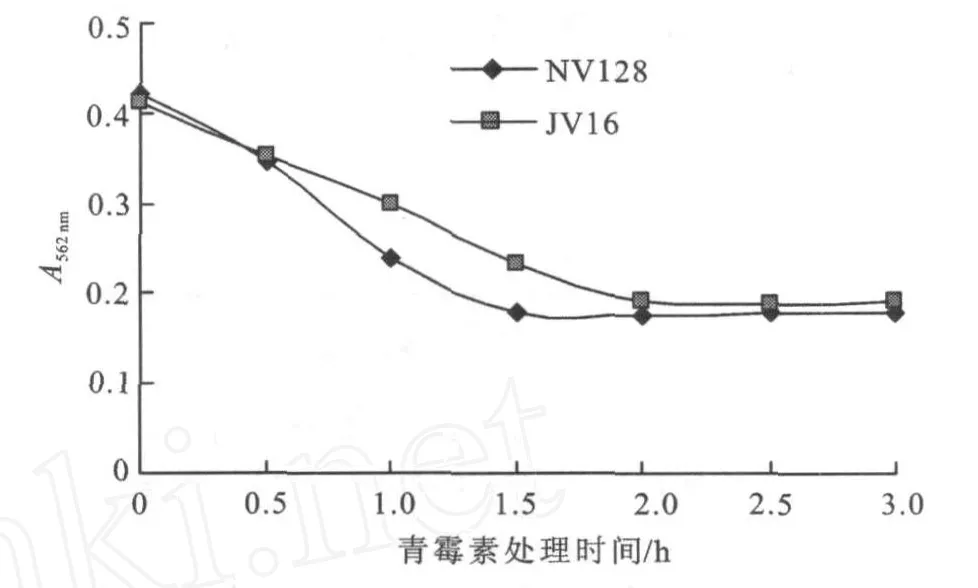
图2 青霉素处理时间与亲株对溶菌酶敏感性的关系Fig.2 Effect of penicillin treatment time on the sensitivity of parent strains to lysozyme
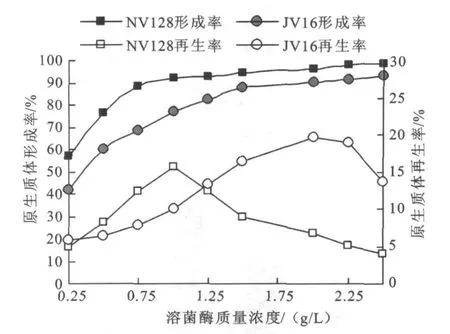
图3 溶菌酶质量浓度与原生质体形成率和再生率的关系Fig.3 Effect of lysozyme concentration on the rate of protoplast formation and regeneration
由图3可知,随着蛋清溶菌酶量的增加,原生质体的形成率逐渐提高,继续增加蛋清溶菌酶,原生质体增加不明显。在溶菌酶质量浓度低时,原生质体的形成率不足再生率较低;而在原生质体增加不明显时再生率达到最大。NV 128和JV 16溶菌酶处理最适浓度分别为1 g/L和2 g/L时,原生质体再生率达到最大。
2.2.2 溶菌酶处理时间对原生质体再生的影响确定适当的酶解时间,有利于原生质体的再生。当形成的原生质体到一定数量时,没必要再增加时间,时间的延长会降低原生质体的活性,再生率下降。实验结果(图4)表明,NV 128和JV 16酶解时间分别为6 h和8 h时,原生质体再生率达到最大。
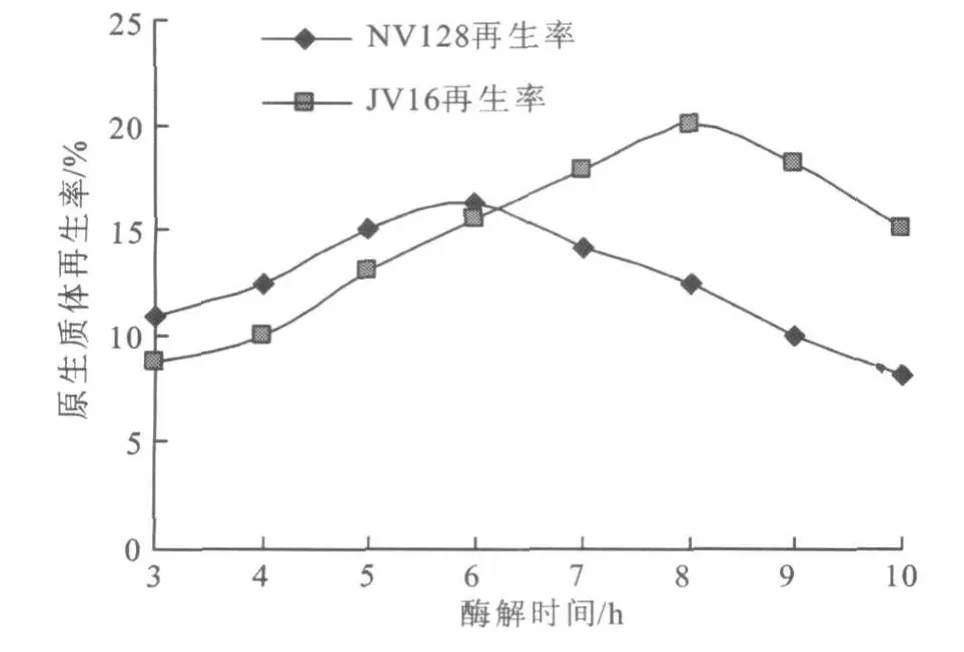
图4 酶解时间与原生质体再生率的关系Fig.4 Effect of enzymolysis time on the protoplast regeneration rate
2.3 原生质体再生完全培养基中渗透压稳定剂NaCl浓度的确定
由于去除细胞壁的原生质体对渗透压非常敏感,只有处于高渗环境中才能避免吸水膨胀而破碎,所以整个操作过程都要保持高渗环境,而渗透压过高也会使原生质体收缩,使其活性降低。渗透压稳定剂NaCl浓度的确定也为再生液体培养基的培养提供了条件。以NV 128为例,确定了再生完全培养基中NaCl的浓度,如图5所示,当 NaCl浓度为0.6 mol/L时,原生质体再生率最高。
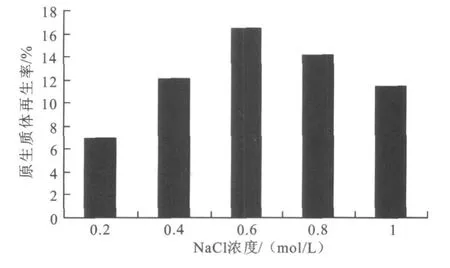
图5 渗透压稳定剂浓度与原生质体再生率的关系Fig.5 Effect of osmotic stabilizer concentration on the protoplast regeneration rate
2.4 原生质体灭活时间的确定
按1.2.3的方法灭活NV 128原生质体,涂布平板。当水浴处理10 m in时,原生质体恰好彻底灭活,所以选取10 min为最佳灭活时间。
2.5 抗高糖菌株的检出
2.5.1 两亲株葡萄糖抗性临界浓度的确定 融合子检出前,首先对两亲株的葡萄糖抗性临界浓度进行了测定。按葡萄糖浓度梯度制备一系列平板,从活化平板上刮取一环菌于生理盐水中,制成菌悬液,涂布在高糖平板上,显示NV 128和JV 16的糖抗性临界浓度分别为200 g/L和180 g/L。
2.5.2 抗高糖融合子的检出 按照1.2.5的方法首先挑取经过原生质体融合后在高糖梯度平板上长出的融合子,经过初筛、复筛,筛选出一株缬氨酸高产融合株NJ-2;以此融合株为出发菌株经过DES诱变筛选,筛选出一株缬氨酸高产菌NJ-237,葡萄糖抗性临界浓度提高到240 g/L,其摇瓶产酸达到45.6 g/L。筛选结果如表1所示。
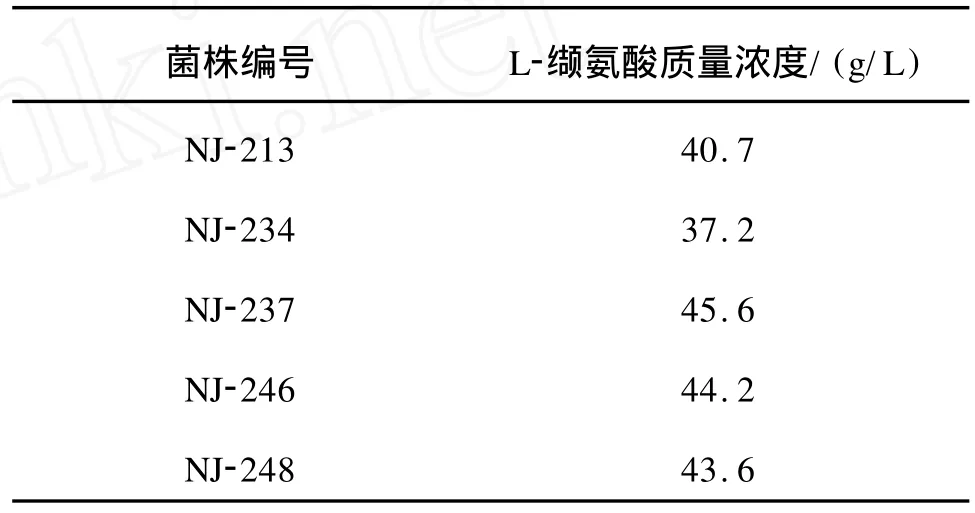
表1 融合株NJ-2经DES诱变后融合株摇瓶产酸结果Tab.1 The yields of L-valine of several fusants derived from NJ-2 by DES treatment
2.5.3 亲株及融合株7L发酵罐发酵试验 采用初糖125 g/L和硫酸铵12 g/L,连续流加葡萄糖的方式对两亲株及融合株进行7 L发酵罐发酵试验。在发酵过程中,根据残糖浓度,补加浓葡萄糖溶液,维持残糖15~30 g/L;根据溶氧(DO)调整搅拌转速,以满足菌体在各个阶段的溶氧需求;自动流加浓氨水,使p H在发酵前期维持在6.8~7.0,中后期维持在7.1~7.2。两亲株和融合株所产总酸量和糖酸转化率见表2,菌体生长与缬氨酸产酸水平见图6。
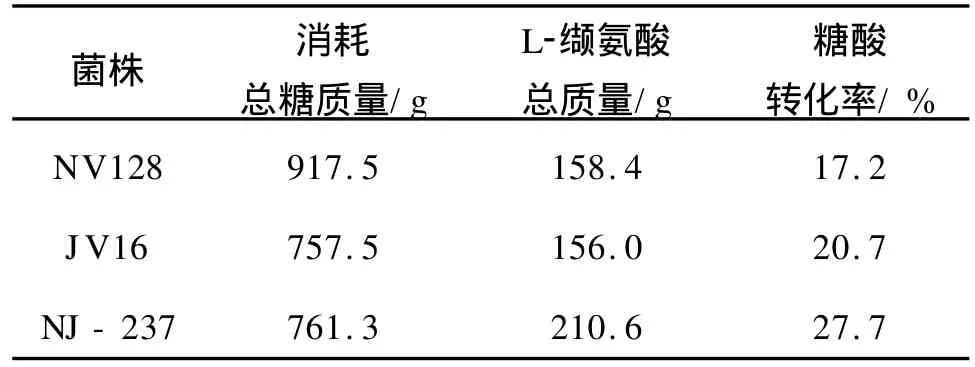
表2 7 L发酵罐亲株及融合株L-缬氨酸发酵糖酸转化情况Tab.2 Glucose/valine conversion efficiency of parent strains and fusant in 7L fermenter
从表4和图6的发酵结果可知,亲株NV 128、JV 16和融合株NJ-237的产酸水平分别为34.2g/L、36.2 g/L和46.8 g/L;其糖酸转化率分别为17.2%、20.7%和27.7%,融合株NJ-237的产酸水平和糖酸转化率与亲株相比均有较大幅度的提高,这说明本试验所进行的原生质融合育种是成功的。

图6 亲株及融合株的7 L罐发酵过程曲线Fig.6 Fermentation time courses of parent strains and fusant in 7 L fermenter
3 结 语
实验中渗透压稳定剂没有采用传统的蔗糖和丁二酸钠等有机物而采用NaCl,主要是因为有机物粘度大,不利于收集原生质体,且较高浓度的有机物容易抑制菌体的生长。
通过实验发现青霉素的前处理明显缩短了酶处理的时间,再生培养基中M g2+的加入促进了菌落的生长速度,但没有明显增加再生率,其对再生率的影响需要进一步验证。
单灭活原生质体融合的频率较高,介于双灭活与全活之间[10]。融合株集中了两亲株的优良性状,具有α-AB和γ-AB高抗性而不带缺陷型标记,产酸水平和糖酸转化率有了明显提高而培养条件粗放。
(References):
[1]贾庆忠,马桂林,黎文志.抗高血压药缬沙坦的合成[J].中国医药工业杂志,2001,32(9):385-387.
JIA Qing-zhong,MA Gui-lin,LI Wen-zhi.Synthesis of antihypertensive drug valsartan[J].Chinese Journal of pharmaceuticals,2001,32(9):385-387.(in Chinese)
[2]诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994,460.
[3]赵丽丽.L-缬氨酸高产菌的选育及其发酵条件研究[D].天津:天津科技大学,2003.
[4]郭成金,赵润,朱文碧.冬虫夏草与蛹虫草原生质体融合初探[J].食品科学,2010,31(1):165-171.
GUO Chengjin,ZHAO Run,ZHU Wenbi.Protoplast Fusion betweenCordyceps sinensisandCordyceps militaris[J].Food Science,2010,31(1):165-171.(in Chinese)
[5]YU Lei,PEIXiaolin,LEITing et al.Genome shuffling enhanced L-lactic acid production by imp roving glucose tolerance of Lactobacillus rhamnosus[J].Journal of Biotechnology,2008,134:154-159.
[6]潘家秀.蛋白质化学研究技术[M].北京:科学出版社,1962.
[7]张慧.缬氨酸产生菌的原生质体融合育种及发酵条件研究[D].天津:天津科技大学,2005.
[8]诸葛健,李华钟.微生物学[M].北京:科学出版社,2004.
[9]莫静燕,陈献忠,王正祥.地衣芽孢杆菌原生质体的制备、再生及转化研究[J].生物技术,2009,19(5):75-77.
MO Jing-yan,CHEN Xian-zhong,WANG Zhengxiang.Preparation,regeneration and genetic transformation ofBacillus licheniform isprotop lasts[J].Biotechnology,2009,19(5):75-77.(in Chinese)
[10]宋安东,谢慧,王风芹,等.双灭活原生质体融合构建纤维燃料乙醇全糖发酵高产菌株研究[J].林产化学与工业.2009,29(6)21-24.
SONG An-dong,XIE Hui,WANG Feng-qin,et al.Construction of strain capable of co-fermenting pentose and hexose by diinactivated protoplast fusion for producing fuel ethanol from cellulose[J].Chemistry and Industry of Forest Products,2009,29(6)21-24.(in Chinese)
Protoplast Fusion of L-Valine Producer and Screening of Fusants by Improving High-Glucose Tolerance
YUAN Dan-dan, ZHANG Wei-guo*
(Key Lab of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
A fusant which could be resistant to high concentration of glucose was screened by fusing protoplasts in this study. The L-valine overproducing fusant was derived from B revibacterium flavum NV 128 and JV 16(Leu-Ile-M et-),and was screened on high-glucose gradient plates by means of fusing the single inactivated protoplasts and diethylsulfate(DES)treatment.A t the same time,three different conditions(penicillin,lysozyme and osmotic stabilizer)affecting the formation and regeneration of protoplasts were studied and the optimum conditions were determined.Under the optimum conditions,the titer of L-valine achieved at 46.8g/L after 72h culture,and the yield of L-valine on glucose was 27.7%.
L-valine,protoplasm fusion,imp roving high-glucose tolerance
TQ 922
A
1673-1689(2011)04-0597-05
2010-06-30
国家863计划项目(2008AA 02Z212)。
*
张伟国 (1963-),男,江苏张家港人,工学博士,教授,博士研究生导师,主要从事氨基酸生产菌种选育与发酵工艺研究。Email:zhangw g@126.com

