华溪蟹主要组织蛋白质双向电泳技术体系的建立
武阳,马文丽,王兰
(山西大学 生命科学学院,山西 太原 030006)
华溪蟹主要组织蛋白质双向电泳技术体系的建立
武阳,马文丽,王兰*
(山西大学 生命科学学院,山西 太原 030006)
为深入研究重金属胁迫下华溪蟹主要组织蛋白质的差异表达,对华溪蟹心脏及鳃总蛋白质的双向电泳技术体系进行了初步探讨.通过对样品处理方法、上样量大小以及双向电泳实验条件的比较选择,初步建立了适用于华溪蟹组织蛋白质组分析的双向电泳技术体系.结果表明:选取p H 3~10的24 cmIPG胶条,上样量1.0 mg,得到了较为理想的华溪蟹心脏及鳃双向电泳图谱;分离到的心脏蛋白质多集中于p H 5.5~9,而鳃蛋白质多集中于p H 4~7.
蛋白质组;华溪蟹;双向电泳;心脏;鳃
蟹类是低等指示生物在水体环境中代表性的物种,生活于水体基底层,直接面对沉积于水体中的金属离子,适于作为检测水体重金属污染的指示生物[1].河南华溪蟹(Sinopotamon henanense)是我国特有的淡水蟹种类,分布广泛,易采易养,是一种较好的模式生物.
进入后基因组时代,蛋白质组学的研究成为生命科学领域关注的热点[2].利用蛋白质组学可以大规模研究一种组织乃至生物的蛋白质特征,研究蛋白质的翻译、修饰、表达机理及蛋白质和蛋白质之间的相互作用[3],而它的发展却受到技术条件的限制,在实际研究过程中,蛋白质组学的研究技术难于基因组学的研究技术,需要通过大量实验来摸索.
双向电泳技术是蛋白质组学研究中最为基本和重要的技术[4-5].GE Healthcare公司的 Multiphor II双向电泳系统是目前使用最广泛、发展最成熟的蛋白质组学研究平台.本实验采用此套双向电泳系统,对华溪蟹心脏及鳃组织的蛋白质双向电泳技术进行了摸索,初步建立了适用于华溪蟹组织蛋白质组分析的双向电泳技术体系,为华溪蟹不同组织蛋白质组学的进一步研究奠定了基础.
1 材料与方法
1.1 实验材料
河南华溪蟹购自太原市五龙口水产市场,置实验室水族缸(130 cm×50 cm×60 cm)中暂养两周后进行实验.暂养期间每隔2 d喂食1次.实验时用镊子将溪蟹从缸中取出,用去离子水冲洗干净,电子天平称重后在解剖盘中解剖,小心取出心脏及鳃等组织备用.
1.2 仪器与试剂
1.2.1 主要仪器
Multiphor II双向电泳系统,包括Ettan IPGphor 3等电聚焦系统、Ettan DALT six大规模垂直电泳系统及Image Scanner扫描仪(GE Healthcare);台式冷冻高速离心机(德国Eppendorf).
1.2.2 主要试剂
24 cm、p H 3~10 IPG预制胶条、矿物油、Pharmalyte p H 3~10载体两性电解质、CHAPS、二硫苏糖醇(DTT)、尿素、硫脲、碘乙酰胺均购自GE公司;丙烯酰胺、甲叉双丙烯酰胺、SDS、低熔点琼脂糖购自Sigma公司;硝酸银、甲醇、甲醛、碳酸钠、过硫酸铵、三羟甲基氨基甲烷(Tris)、四甲基乙二胺(TEMED)、蔗糖、甘油、甘氨酸、溴酚蓝为国产分析纯试剂;牛血清白蛋白(BSA)为国产生物技术纯试剂.
1.2.3 主要溶液
裂解液:4.985 g尿素,1.52 g硫脲,0.1 g DTT(临用加入),0.2 g CHAPS,200μL IPG buffer(3-10),加入超纯水至总体积10 m L.
水化液:8.41 g尿素,3.04 g硫脲,0.046 g DTT(临用加入),0.4 g CHAPS,100μL IPG buffer(3-10),加入超纯水至总体积20 m L.
平衡缓冲液:72 g尿素,47.54 m L甘油,4 gSDS,6.68 m L分离胶缓冲液,0.004 g溴酚蓝,加入超纯水至总体积200 m L.
平衡液Ⅰ:使用前每10 m L平衡缓冲液中加入100 mgDTT(临用时配制).平衡液Ⅱ:使用前每10 m L平衡缓冲液加入400 mg碘乙酰胺(临用时配制).
1.3 方法
1.3.1 样品制备与蛋白定量
取新鲜组织(心脏、鳃)1 g,加入5 m L裂解液,匀浆器匀浆,4℃,12 000 r/min离心20 min.取上清液,加入2倍体积的丙酮(内含0.07%(V/V)的β-巯基乙醇,-20℃预冷),放置30 min,4℃,15 000 r/min离心20 min.弃上清,用-20℃预冷丙酮洗涤沉淀,室温干燥,最后用水化液1 m L溶解沉淀,4℃,12 000 r/min离心20 min,上清液即为样品溶液.操作过程中应尽量保持低温,以防止蛋白质降解.取部分样品,用Bradford法测定蛋白浓度.
1.3.2 水化上样与第一向等电聚焦电泳
实验采用24 cm的IPG胶条.在胶条槽中加入水化液450μL,按总蛋白量1.0 mg加入样品溶液,加入适量溴酚蓝染液.取出胶条从酸性端(标“+”端)剥去IPG保护膜,胶面朝下,将胶条阳极放入胶条槽对应位置,使其接触水化液,继续放下胶条,使水化液全部浸润整个胶条并保证胶条的两端与槽两端的电极接触良好.放好胶条后,用胶头滴管覆盖足量的覆盖油.盖好胶条盖,放入Ettan IPGphor 3中进行第一向等电聚焦电泳.第一向的等电聚焦条件:(1)60 V,10 h(2)200 V,2 h(3)500 V,1 h(4)1 000 V,2 h(5)5 000 V,1 h(6)10 000 V,3 h(7)10 000 V,55 000 Vh(8)1 000 V,10 h.胶条限流为:50μA/条,电泳大约24 h.
1.3.3 IPG 胶条的平衡
第一向电泳完成后,用镊子取出胶条放入塑料管中进行平衡.倒入适量平衡液Ⅰ(漫过胶面一些距离即可),放在脱色摇床上振荡15 min.倒掉平衡缓冲液I,加入适量平衡缓冲液II,继续振荡15 min,取出胶条,做下一步使用.
第一步平衡在平衡液中加入DTT,是为了使变性的非烷基化的蛋白质处于还原状态;第二步平衡中加入碘乙酰胺,是为了使蛋白质巯烷基化,防止它们在电泳过程中重新氧化,碘乙酰胺还能使残留的DTT烷基化.
1.3.4 第二向SDS-PAGE电泳
配制10%的均一分离胶,在Ettan DALT six垂直电泳系统中灌胶并加水覆盖,将平衡后的IPG胶条在电泳缓冲液中润湿后,直接转移至分离胶顶端.胶条支持膜一侧贴玻璃面,排出胶条与玻璃面之间的气泡.用0.15%琼脂糖封闭凝胶.电泳槽中灌注电泳缓冲液,4℃电泳.电泳参数为80 V,1 h;240 V,4 h.当溴酚蓝指示剂迁移到凝胶底部时结束电泳.
1.3.5 染色
采用银染法对凝胶进行染色.按照GE仪器操作手册中银染法配制固定液、敏化液、银染液、显色液、终止液,染色步骤同样按操作手册进行.
1.3.6 凝胶扫描及分析
用Image Scanner扫描仪对染色后的凝胶进行扫描,并利用Image Master 2D Platinum 6.0软件对图像进行处理和分析.
2 结果与分析
通过对样品处理方法、上样量大小以及双向电泳实验条件的摸索,选取p H 3~10的24 cm IPG胶条,上样量1.0 mg(以总蛋白量计),得到了较为理想的华溪蟹心脏双向电泳图谱(图1).分离出的心脏蛋白质斑点数量丰富,边界清晰,大部分蛋白点集中于p H 5.5~9,在酸性端检测到的蛋白质较少.电泳图谱基本上没有纵向拖尾,但呈现轻微的横向纹理,应该是第一向聚焦不完全所致,还需在等电聚焦实验流程方面进一步优化改进.
图2为获得的华溪蟹鳃蛋白质双向电泳图谱.结果显示,与心脏蛋白质分布范围明显不同,分离到的华溪蟹鳃蛋白质多集中在p H 4~7,碱性端检测到的很少.在p H 5~7内的蛋白质斑点边界清晰,没有横纹与拖尾,而在偏酸性端p H 4~5范围内,蛋白质分布十分紧密,有明显的纵向拖尾现象,还需在蛋白质样品的提取及处理方面继续摸索优化.
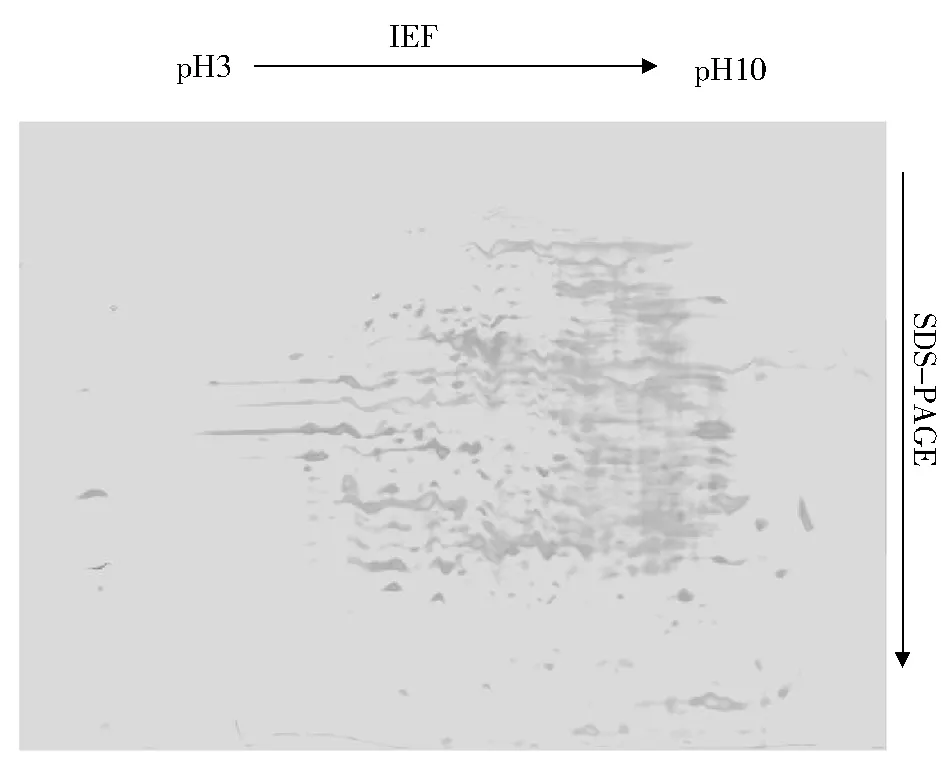
图1 华溪蟹心脏蛋白质双向电泳图谱Fig.1 2DE-PAGE patterns of proteins extracted from heart of S.henanense
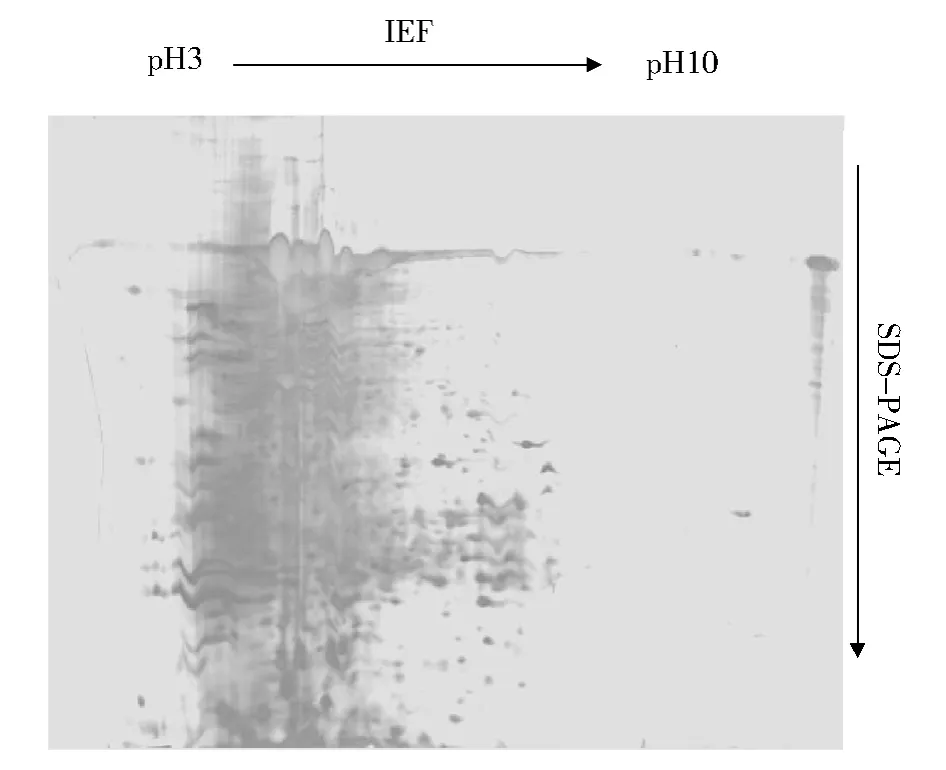
图2 华溪蟹鳃蛋白质双向电泳图谱Fig.2 2DE-PAGE patterns of proteins extracted from gill of S.henanense
3 讨论
3.1 上样量的选择
上样量在双向电泳中起着相当关键的作用,它的大小取决于胶条的长度、p H范围以及染色方法等.使用较大上样量会使产生的蛋白斑点不易分离,点显得杂乱;而上样量太小,会遗失很多低丰度蛋白,从而使电泳图像中的点很少[6].要得到一个比较好的结果,需要在实验中不断摸索,找到最适合的上样量.
实验中对上样量进行了摸索.第一次使用了GE手册推荐的上样量200μg总蛋白进行了实验,银染后发现在图谱上按预期出现了一些较清晰的点,但出现的点很少,达不到蛋白质组的要求.因此,又使用更大的上样量1 mg总蛋白,获得了较为理想的蛋白质斑点丰富清晰的华溪蟹心脏蛋白质双向电泳图谱.而鳃因成分更复杂,在偏酸性的p H 4~5内,电泳图谱不尽理想,还需进一步改进样品处理方法及摸索更适合的上样量.因此我们认为对于银染法而言,GE仪器手册推荐的200μg的上样量是偏低的,应该在600μg~1 mg.
3.2 样品处理
样品处理是双向电泳的关键步骤,它直接关系到双向电泳的准确性和灵敏性.双向电泳对实验中样品蛋白质纯度的要求相当高.因此选择一种较先进的方法对样品进行提纯处理,得到除蛋白质外基本不含其他物质的样品,是决定双向电泳是否成功的很关键的一步[7].
本实验我们采用了一种较常规的方式进行样品处理.首先采用玻璃匀浆器对组织进行了匀浆破碎,然后用冰丙酮对蛋白质进行了多次沉淀洗涤.结果显示,这种处理方法对心脏十分适宜,获得了斑点丰富清晰的华溪蟹心脏蛋白质双向电泳图谱.而对于鳃而言,因富含酸性蛋白质,还需进一步优化样品处理方法.
3.3 等电聚焦程序
合理的等电聚焦程序也是获得高分辨率图谱的基础,对凝胶图谱上的横纹有直接的影响[8].我们选择了GE仪器手册推荐的常规程序:(1)60 V,10 h(2)200 V,2 h(3)500 V,1 h(4)1 000 V,2 h(5)5 000 V,1 h(6)10 000 V,3 h(7)10 000 V,55 000 Vh(8)1 000 V,10 h,结果在24 h内顺利达到电流为0的聚焦效果.但我们观察到,在整个聚焦电泳过程中,电泳电压并未完全按照我们所设定的步骤工作,电压的走势是线性的,有利于达到更好的电泳效果.实验结果显示,华溪蟹心脏蛋白质双向电泳图谱有轻微的横纹现象,可以通过适当延长除盐时间来改善.
3.4 染色方法
目前双向电泳主要使用银染和考马斯亮蓝染色两种方法.就分辨率而言,银染是考染的100倍,灵敏度明显优于考染;银染上样量只需几百微克,考染需要毫克级,但在操作上银染复杂得多[9-10].由于很高的灵敏度,整个染色过程要保证所有染色器皿、染色试剂绝对干净,稍有不慎即会造成染色背景过深,影响电泳图谱质量.另外,银染中显色步骤也很关键,显色时间不足会造成蛋白质斑点丢失,而显色过度会导致胶面变黑,图谱背景过深,不易观察.
3.5 双向电泳中的试剂
双向电泳因为灵敏度高,对试剂的要求特别高,要求达到优级纯.实验过程中使用的水必须是超纯水,所有溶液必须进行0.22微米微孔滤膜过滤[9-10].由于实验条件所限,银染过程中一些试剂如硝酸银、碳酸钠、甲醛、甲醇我们使用了国产分析纯药品,对图谱产生了背景过深的影响.
[1] Ma W L,Yan T,He Y J,etal.Tissue-specific Cadmium and Metallothionein Levels in Freshwater CrabSinopotamon henanenseDuring Acute Exposure to Waterborne Cadmium[J].EnvironmentalToxicology,2008,23(3):393-400.
[2] 贺福初.蛋白质组(proteome)研究—后基因组时代的生力军[J].科学通报,1999,44(2):113-122.
[3] 刘金凤,王京兰,钱小红,等.翻译后修饰蛋白质组学研究的技术策略[J].中国生物化学与分子生物学报,2007,23(2):93-100.
[4] Graves P R,Haystead T A J.Molecular Biologist’s Guide to Proteomics[J].MicrobiologyandMolecularBiologyReviews,2002,66(1):39-63.
[5] Gygi S P,Corthals G L,Zhang Y,etal.Evaluation of Two-dimensional Gel Electrophoresis Based Proteome Analysis Technology[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2000,97(17):9390-9395.
[6] 李明云,冀德伟,吴海庆,等.大黄鱼肝脏蛋白质组双向电泳技术的建立及优化[J].水产科学,2010,29(1):27-30.
[7] 毛立明,林健荣,赵峰,等.家蚕蛹期雌雄生殖腺蛋白质双向电泳比较分析[J].昆虫学报,2007,50(6):628-633.
[8] 李春梅,杨守萍,盖钧镒,等.野生大豆与栽培大豆种子差异蛋白质组学研究术[J].生物化学与生物物理进展,2007,34(12):1296-1302.
[9] 夏其昌.蛋白质化学与蛋白质组学[M].北京:科学出版社,2004.
[10] Simpson R J.蛋白质与蛋白质组学实验指南[M].北京:科学出版社,2003.
Establishment of 2-DE Technique in Heart and Gill Proteome ofSinopotamonhenanense
WU Yang,MA Wen-li,WANG Lan
(SchoolofLifeScience,ShanxiUniversity,Taiyuan030006,China)
In order to research the differential expression of proteome in tissues of freshwater crabSinopotamonhenanenseinduced by heavy metals,the 2-DE(two-dimensional electrophoresis)related techniques for heart and gill proteome ofS.henanensewere studied.By comparative tests between different extraction methods,sample volume and isoelectric focusing programs,a tentative 2-DE method which suited for the separation of tissue proteome ofS.henanensewas established.The results showed that with 24 cm,p H 3~10 IPG strips and 1.0mg sample protein,relatively ideal 2-DE patterns in heart and gill proteome ofS.henanensewere successfully separated,heart proteins mainly distributed in the p H 5.5~9 range,whereas gill proteins mainly distributed in the p H 4~7 range.This study will set up the foundation for further research on proteomics ofS.henanense.
proteome;Sinopotamonhenanense;two-dimensional gel electrophoresis;heart;gills
Q-503
A
0253-2395(2011)S2-0108-04
2011-09-12
国家自然科学基金(30970361);山西省自然科学基金(2010011043-2)
武阳(1986-),男,山西太原人,硕士研究生,主要研究华溪蟹金属硫蛋白的表达及生物功能.E-mail:wus611@gmail.com.*通讯作者,E-mail:lanwang@sxu.edu.cn

