长江口极微型和微微型浮游生物的垂向变化与周日波动
李 云, 李道季, 张利华, 孔定江, 方 涛
(1. 中国水产科学研究院 东海水产研究所, 上海 200090; 2. 华东师范大学 河口海岸学国家重点实验室, 上海 200062)
长江口极微型和微微型浮游生物的垂向变化与周日波动
李 云1,2, 李道季2, 张利华2, 孔定江2, 方 涛2
(1. 中国水产科学研究院 东海水产研究所, 上海 200090; 2. 华东师范大学 河口海岸学国家重点实验室, 上海 200062)
2006年6月12日至22日“东方红2号”考察船夏季航次期间, 在长江口3个连续观测站位进行了水样采集, 应用流式细胞仪分析了水样中的极微型浮游生物(Femtoplankton)和微微型浮游生物(Picoplankton)。结果显示, 原绿球藻(Prochlorococcus)在所有样品中均未检测到; 检测到的聚球藻(Synechococcus)和微微型真核浮游植物(Picoeukaryotes)平均丰度达数量级 105~106个/L, 异养细菌(Heterotrophic bacteria)和病毒(Viruses)平均丰度达数量级108~ 109个/L。在浑浊的长江口水域, 极微型和微微型浮游生物的垂向分布特征不同, 主要与各站位特有的水动力条件密切相关; 浊度是调控微微型真核浮游植物、异养细菌和病毒周日变化的关键因子之一; 微微型真核浮游植物成为微微型浮游植物中最重要的组成部分, 与异养细菌具有显著的正相关关系。
聚球藻(Synechococcus); 微微型真核浮游植物; 异养细菌; 病毒; 长江口
由于海洋微生物观测和实验技术的迅速发展,海洋微型浮游生物生态学研究自 20世纪70年代末开始相继出现了一系列的重要发现。其中, 聚球藻(Synechococcus)、原绿球藻(Prochlorococcus)和古菌(Archaea)的发现被 Fuhrman[1]称为近期海洋生态学研究的三大里程碑。海洋微型生物生态过程作为生命系统和无机环境之间相互联系的基础环节, 是海洋生态系统中最基本、最重要的生态过程[2]。这方面的研究将使人们对海洋生态系统的结构和功能有更深刻的认识, 从而为评价海洋生物资源以及海洋生态系统在全球环境和气候变化中的作用提供更全面、准确的参数。
按照粒径谱的划分, 粒径在0.02 ~ 0.2 µm和0.2 ~2 µm之间的浮游生物被定义为极微型浮游生物和微微型浮游生物[3]。而本文所研究的生物类群包括微微型的聚球藻、原绿球藻、微微型真核浮游植物、异养细菌和极微型的病毒。虽然, 在过去的20年里, 长江口微型浮游生物的类群组成、丰度、生物量的时空分布及其环境影响机制等已经进行了广泛研究[4-10], 但由于长江口水动力条件复杂, 观测站位受潮流影响较大, 有关微型浮游生物的周日连续观测数据缺乏, 因此, 本文旨在通过分析长江口极微型和微微型浮游生物随潮汐的垂向变化与周日波动特征, 讨论环境因子对其波动的影响, 为长江口生态系统动力学研究提供基础参数。
1 方法
2006年6月12日至22日“东方红2号”考察船夏季航次期间, 在长江口3个连续观测站位(图1)进行了现场采样与样品处理。16号测站连续观测25 h, 17号和18号测站连续观测13 h, 每2 h采样1次,每次依据实测水深统一采取表(水面下0.5 m)、中(1/2水深)、底(海床底以上0.5 m)3层水样。水样由附于CTD(Conductivity–Temperature–Depth)上的Niskin采水器采集, 同时, 在所有可取样的深度, 获得温度、盐度和浊度剖面数据。每层水样采取3 mL于冻存管中, 加入终质量分数为 1%的多聚甲醛(Paraformaldehyde), 避光固定样品15 min后置于液氮罐中保存, 1个月以内流式细胞仪(型号: FACScan)测定, 方法见文献[11-13]。

图1 采样站位Fig. 1 Location of sampling stations
2 结果
2.1 水环境参数
观测期间, 由于受到淡水径流和潮汐的影响程度不同, 在不同测站和同一测站的不同水层, 温度、盐度和浊度的日波动特征不同(表1)。温度日波动范围最小, 垂向变化不大; 受淡水径流影响较大的 18号和17号测站, 以及16号测站的表层水盐度日波动明显, 16号测站的底层水始终由入侵海水控制, 盐度无明显变化; 表层水浊度相对较小, 变化显著, 而底层水浊度较大, 变化较小或几乎无变化。
2.2 极微型和微微型浮游生物
原绿球藻在所有的样品中均未检测到, 聚球藻在18号测站也未检测到。检测到的4个类群中, 异养细菌和病毒平均丰度约达108~109个/L, 高出微微型真核浮游植物和聚球藻约2 ~ 3个数量级。由表2可知, 不同类群的细胞丰度波动范围都很大, 周日变化显著。其中, 异养细菌丰度日变化相对最小。
在长江口, 潮流属正规半日潮类型, 每日两涨两落, 而所检测到的生物类群, 细胞丰度均无明显的随潮汐变化的特征(图 2)。在 16号测站的大部分时间中, 垂向上细胞丰度基本呈递降趋势(图 2a ~d)。在水深相对较浅、水体混合相对均匀的18号测站, 垂向上细胞丰度差异较小(图2i ~ k)。至于17号测站, 病毒丰度的垂向变化与其他类群显著不同(图2e ~ h)。
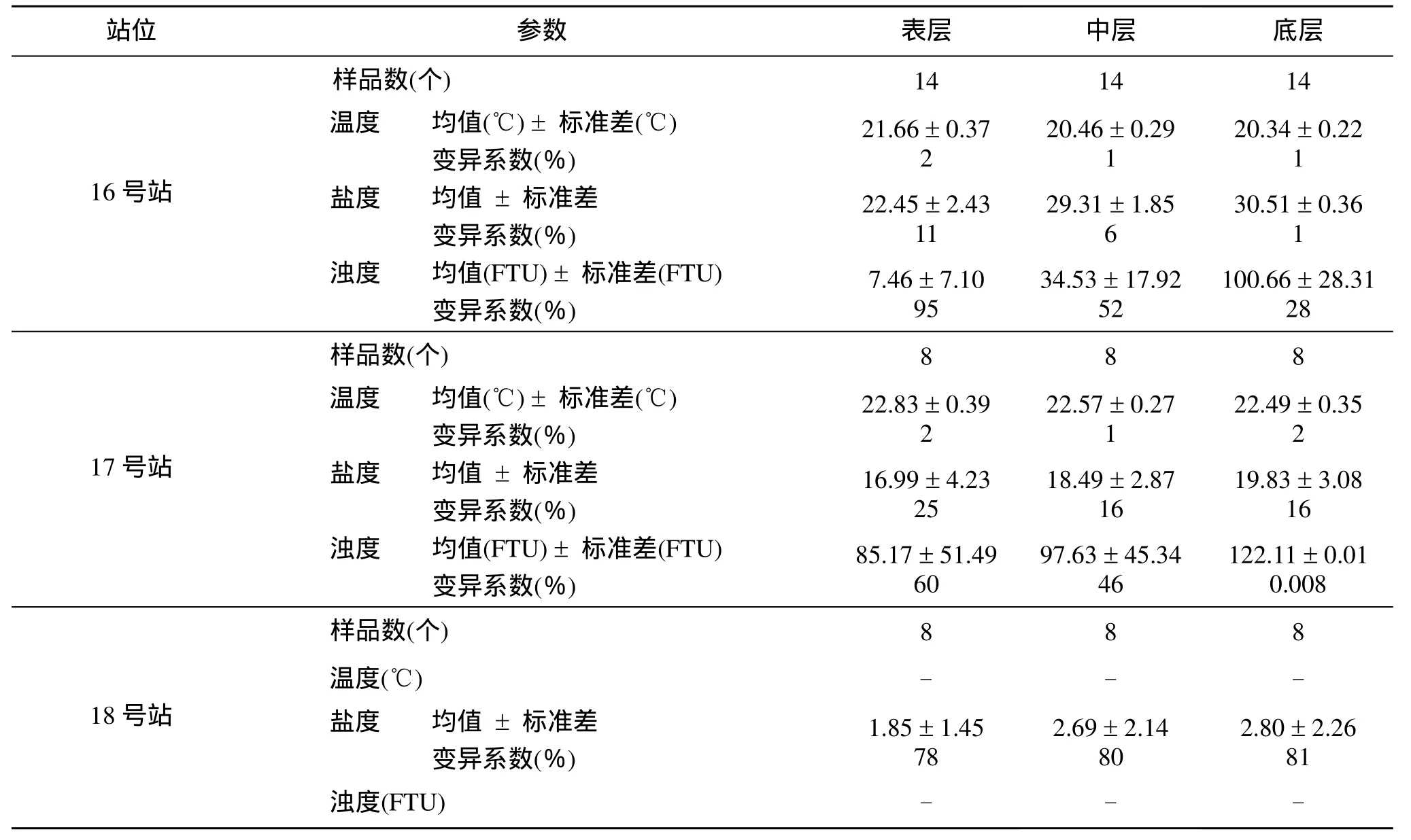
表1 长江口水环境参数监测结果Tab. 1 Summary of environmental parameters monitored at the Changjiang Estuary
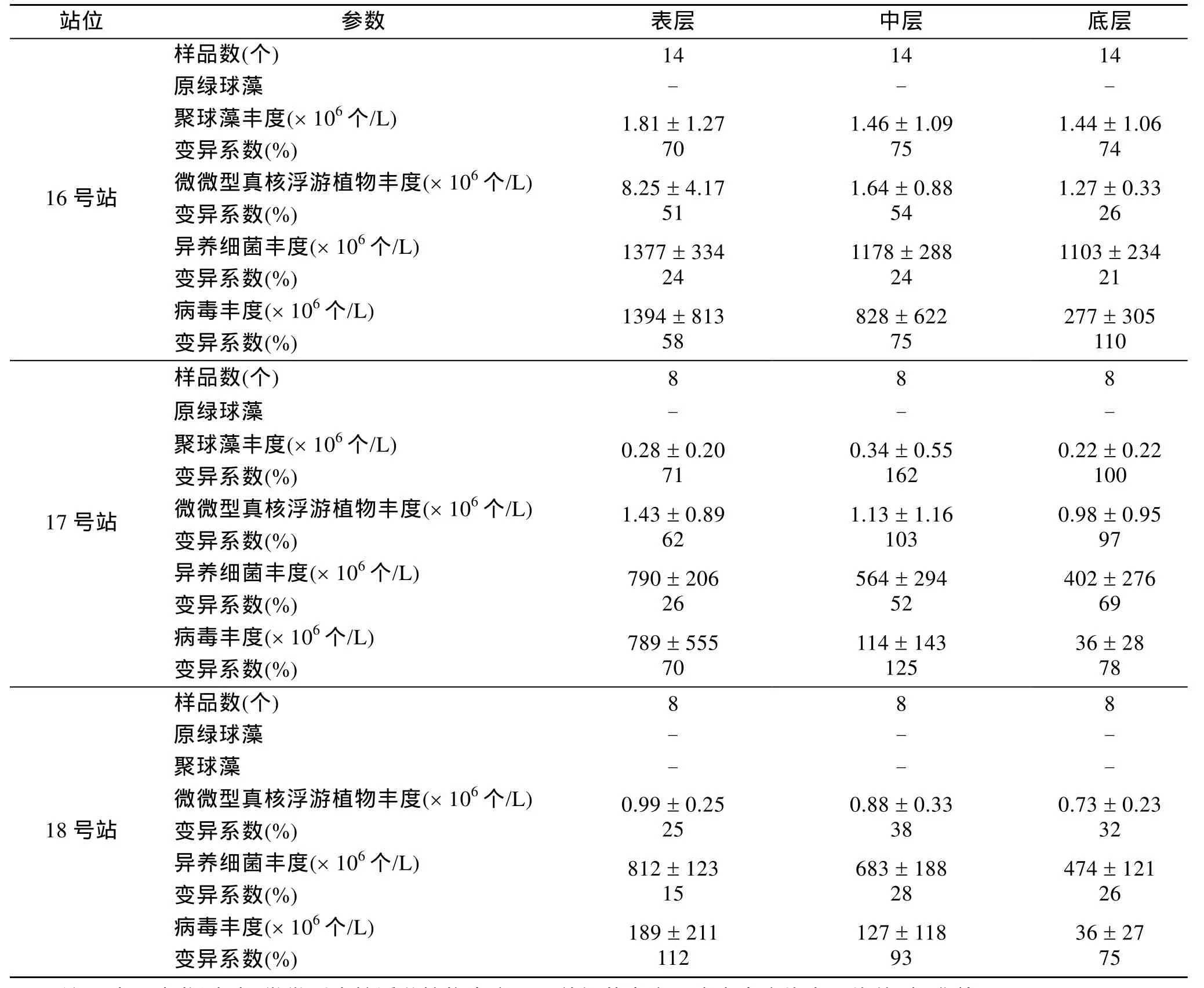
表2 长江口极微型和微微型浮游生物监测结果Tab. 2 Summary of femtoplankton and picoplankton monitored at the Changjiang Estuary
3 讨论
长江口是中等潮汐强度的三角洲河口, 口门区域平均潮差为2.76 m, 平均潮汐流速是1.2 m/s, 水停留时间短, 沉降过程和再悬浮过程强烈[14]。位于长江口的 3个测站, 所检测到的生物类群细胞丰度的垂向分布各有特征, 主要与各站位特有的水动力条件密切相关。现场水环境参数监测显示, 16号测站表层水主要受淡水径流控制, 而底层水受入侵海水控制, 水体层化现象的出现导致了细胞丰度分布的不均匀性, 而18号测站水深较浅, 水体混合相对均匀,细胞丰度垂向上无明显变化。
检测到的 4个类群, 细胞丰度的周日变化十分复杂, 不同测站和同一测站的不同水层存在差异。分析其与环境因子的关系表明, 除聚球藻外, 其余3个类群的细胞丰度波动与浊度变化具有明显的负相关关系(图3), 与温度、盐度无显著相关性。由此可见,浊度是调节这 3个类群细胞丰度周日变化的关键因子之一。
在高浑浊的长江口区域, 微微型真核浮游植物丰度高于聚球藻丰度(表 2), 成为了微微型浮游植物(Picophytoplankton)中最重要的组成部分。在海洋生态系统中, 微微型浮游植物以溶解方式释放的溶解有机物是细菌维持生命活动、进行生长繁殖的营养来源, 对细菌生产力起着决定性的作用[15-16]。本研究结果表明, 异养细菌的周日变化与微微型真核浮游植物之间存在显著的正相关关系(图 4), 进一步证实了微微型浮游植物与浮游细菌之间的密切关系。
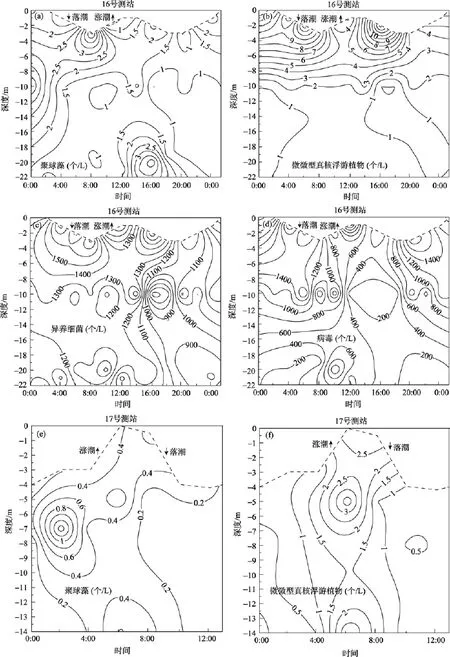
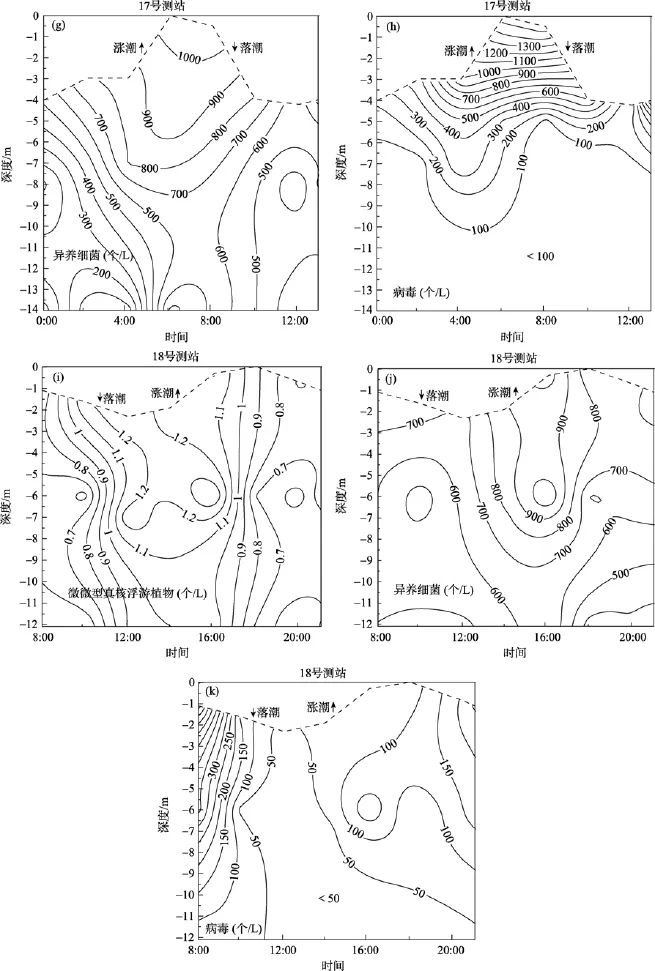
图2 细胞丰度的垂向变化与周日波动Fig. 2 Vertical characteristics and diel variation of cell abundance
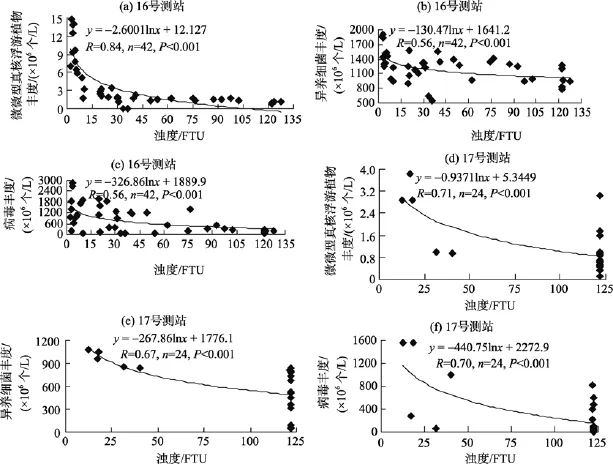
图3 细胞丰度与浊度之间的关系Fig. 3 Relationship between cell abundance and turbidity

图4 异养细菌与微微型真核浮游植物之间的关系Fig. 4 Relationship between heterotrophic bacteria and picoeukaryotes
本研究中, 在3个站位均未检测到原绿球藻。焦念志等[8]在研究长江口邻近海域微微型浮游植物的空间分布时发现, 夏季原绿球藻主要分布于温度 >26℃、盐度 > 30的表层混合水中, 或温度 > 16℃、盐度 > 33.4的深层混合水中。在寡营养的外海水域,原绿球藻丰度远远高于富营养的河口区域[17-18]。
4 结论
(1)由于地理环境和水动力条件不同, 长江口极微型和微微型浮游生物的垂向分布特征不同, 主要与各站位特有的水动力条件密切相关。
(2)在长江口区域, 浊度是调控微微型真核浮游植物、异养细菌和病毒周日变化的关键因子之一。
(3)在浑浊的长江口水域, 微微型真核浮游植物成为了微微型浮游植物中最重要的组成部分, 与异养细菌具有显著的正相关关系。
[1]Fuhrman J A. Only 10% of the marine biota are known as indicated by the new findings in microbes [R]//The 8thInternational Symposium on Microbial Ecology,Halifax, Canada: 1998: 18.
[2]焦念志, 杨燕辉. 四类海洋超微型浮游生物的同步监测[J]. 海洋与湖沼, 1999, 30(5): 506-511.
[3]宁修仁. 海洋微型和超微型浮游生物 [J]. 东海海洋,1997, 15(3): 60-64.
[4]Vaulot D, Ning X R. Abundance and cellular characteristics of marineSynechococcusspp. in the dilution zone of Changjiang (Yangtze River, China) [J]. Cont Shelf Res, 1988, 8: 1171-1186.
[5]宁修仁, 沃洛 D. 长江口及其毗邻东海水域蓝细菌的分布和细胞特征及其环境调节 [J]. 海洋学报,1991, 13(4): 552-559.
[6]孙晓庆, 董树刚. 微微型浮游植物的生态学研究进展[J]. 海洋科学, 2008, 32(5): 67-72.
[7]焦念志, 杨燕辉. 中国海原绿球藻研究 [J]. 科学通报, 2002, 47(7): 485-491.
[8]Jiao N Z, Yang Y H, Koshikawa H, et al.Influence of hydrographic conditions on picoplankton distribution in the East China Sea [J]. Aquat Microb Ecol, 2002, 30: 37-48.
[9]潘洛安. 东海陆架及南海北部锋区微生物群落结构初探 [D]. 上海: 华东师范大学, 2005: 85-96.
[10]Pan L A, Zhang L H, Zhang J, et al.On-board flow cytometric observation of picoplankton community structure in the East China Sea during the fall of different years [J].FEMS Microbiol Ecol, 2005, 52: 243-253.
[11]张利华, 张经, 晁敏. 流式细胞术对微微型浮游植物识别初探 [J]. 海洋科学, 2002, 26(3): 60-64.
[12]潘洛安, 张利华, 张经. 应用流式细胞术测定水体异养细菌 [J]. 海洋环境科学, 2005, 24(1): 54-58.
[13]潘洛安, 张利华, 张经. 应用流式细胞术测定水体病毒 [J]. 海洋环境科学, 2006, 25(3): 78-85.
[14]苏纪兰, 袁业立. 中国近海水文 [M]. 北京: 海洋出版社, 2005: 245-249.
[15]Liu H, Imai K, Suzuki K, et al.Seasonal variability of picophytoplankton ana bacteria in the western subarctic Pacific Ocean at Station KNOT [J]. Deep-Sea Res II,2002, 49: 5409-5420.
[16]Liu H, Dagg M, Campell L, et al.Picophytoplankton and bacterioplankton in the Mississippi river plume and its adjacent waters [J]. Estuaries, 2004, 27: 147-156.
[17]Campbell L, Nolla H A, Vaulot D. The importance ofProchlorococcusto community structure in the central North Pacific Ocean [J]. Limnol Oceanogr, 1994, 39:954-961.
[18]Partensky F, Hess W R, Vauot D.Prochlorococcus, a marine phytosynthetic prokaryote of global significance[J]. Microbiol Mol Boil Rev, 1999, 63: 106-127.
Vertical characteristics and diel variations of femtoplankton and picoplankton at the Changjiang Estuary
LI Yun1,2, LI Dao-ji2, ZHANG Li-hua2, KONG Ding-jiang2, FANG Tao2
(1. East China Sea Fisheries Research Institute, Chinese Academy of Fisheries Sciences, Shanghai 200090, China; 2.State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China)
May, 11, 2010
Synechococcus; picoeukaryotes; heterotrophic bacteria; viruses; Changjiang Esruary
The cruise was conducted from June 12 to 22, 2006, on board R/V Dong Fang Hong 2 at the Changjiang Estuary. Water samples were collected at three anchor stations. Femtoplankton and picoplankton were simultaneously determined by flow cytometery.Prochlorococcuswas undetectable in all samples. Average abundances ofSynechococcusand picoeukaryotes were at the order of 105~ 106cells/L, but heterotrophic bacteria and viruses at the order of 108~ 109cells/L. In the turbid Changjiang Estuary, vertical characteristics of femtoplankton and picoplankton were different. Turbidity was a key factor regulating diel variations of picoeukaryotes, heterotrophic bacteria, and viruses. Picoeukaryotes became the most important contributor among the picophytoplankton in turbid estuarine area. As a result, diel variation of picoeukaryotes showed a positive correlation with that of heterotrophic bacteria.
Q178.53
A
1000-3096(2011)09-0024-07
2010-05-11;
2010-07-10
国家重点基础研究发展规划(973)项目(2002CB412405);中央级公益性科研院所基本科研业务费专项资金(中国水产科学研究院东海水产研究所)资助项目(2008M13)
李云(1979-), 男, 云南昆明人, 博士研究生, 主要从事海洋微生物学方面的研究, E-mail: salixly@yahoo.com.cn
张培新)

