原子荧光光度法测定天然水体中的Sb(V)和Sb(III)
万玉霞, 任景玲
(中国海洋大学 化学化工学院, 山东 青岛266100)
原子荧光光度法测定天然水体中的Sb(V)和Sb(III)
万玉霞, 任景玲
(中国海洋大学 化学化工学院, 山东 青岛266100)
采用氢化物-原子荧光光度法(HG-AFS), 测定天然水体中的总溶解态无机锑(Sb(Ⅴ+III))和三价锑(Sb(III))。选择的最佳仪器条件为: 灯电流60 mA, 负高压-260 V, 原子化器的温度190 ℃和氩气的载气流量600 mL/min。Sb(Ⅴ+III)在1 mol/L HCl介质中进行测定, 检出限为0.024 µg/L, 线性范围为0~14 µg/L。对浓度 0.3 µg/L和 0.03 µg/L的样品分析精密度分别为 2.0% 和 1.9%(n=9), 方法的回收率93.7 %~105%。Sb(III)是在柠檬酸和柠檬酸钠缓冲溶液中(pH 为4.0~4.5), 辅以100 mL/min的氢气进行测定,测得检出限为0.0013 µg/L, 对浓度0.04 µg/L 和0.01 µg/L的样品分析精密度分别为3.8% 和5.5 %(n=9), 方法的回收率91.1%~104%。二者在不同介质中工作曲线的斜率变动范围均小于5%。Sb(Ⅴ)的含量由总溶解态无机锑与三价锑的含量差减得到。
原子荧光光度法; Sb(V); Sb(III); 天然水体
锑(Antimony)位于元素周期表中第五主族, 在地壳中含量约为5×10-5%[1], 世界土壤中锑的含量范围为0.2~10 mg/kg[2]。对大西洋和太平洋的研究结果表明, 锑的浓度约为 1.15 nmol/L±0.25 nmol/L[3-4]。而在波罗的海和黑海中, 锑的浓度约为0.7 nmol/L[5]和1.2 nmol/L[6]。锑能够以多种氧化形态存在(-3, 0, 3, 5), 其中负三价锑在自然界中极不稳定, 在生物和环境样品中主要以3价和5价形态存在。锑不是人体所必需的元素, 它是环境中微量但普遍存在的有毒元素, 首次引起公众的注意是在 20世纪 90年代[7]。与其他元素一样, 锑及毒性取决于锑的氧化态, 不同价态无机锑化合物的毒性大小顺序为: Sb(0)>Sb(Ⅲ)>Sb(Ⅴ)[8]。由于自然因素和人类活动, 如: 矿山开发、金属的冶炼、含锑燃料的燃烧等, 使锑对环境的污染越来越严重, 有研究表明在冶炼厂周围表层土壤中锑的含量大于160 mg/kg[9]。
目前比较常用的锑的分析方法主要有氢化物发生-原子吸收光谱法(HG-AAS)[10]、氢化物发生原子荧光光度法(HG-AFS)[11]、电感耦合等离子体质谱联用技术(HPLC-ICP-MS)[12]和电感耦合等离子体原子发射光谱法(ICP-AES)[13]等, 本文对氢化物原子荧光光度法测定锑的实验条件进行了优化选择, 测定无机锑的不同存在形态。
1 实验部分
1.1 仪器和试剂
XGY-1011A型原子荧光光度计, 地矿部物探化研究所工厂(河北廊坊)。
Sb(Ⅴ)标准储备液: 称取优级纯焦锑酸钾(K2H2Sb2O7·4H2O) 2.085 2 g 溶于 Milli-Q 水中, 用25%的HCl稀释至1L, 得到1 g/L的Sb(Ⅴ)的标准储备液, 保存时间为1a。
使用液: 移取1.0 mL的锑标准储备液(1 g/L)于100 mL容量瓶中, Milli-Q水稀释至刻度, 得到 10 mg/L的使用液Ⅰ, 再取0.75 mL此溶液于100 mL容量瓶中, Milli-Q水稀释至刻度, 得到75 µg/L的使用液Ⅱ。使用液现用现配。
Sb(Ⅲ)标准储备液: 称取优级纯三氯化锑(SbCl3)1.8737 g 溶于Milli-Q水中, 用25%的HCl稀释至1 L, 得到1.0 g/L的Sb(Ⅲ)的标准储备液。
使用液: 移取0.3 mL的锑标准储备液(1 g/L)于100 mL容量瓶中, Milli-Q水稀释至刻度, 得到3 mg/L的使用液Ⅰ, 再取0.5 mL此溶液于100 mL容量瓶中, Milli-Q水稀释至刻度, 得到15 µg/L的使用液Ⅱ。使用液现用现配。
KBH4溶液(0.5%, 质量分数): 称取 15 g固体KBH4,溶于1 000 mL已配好的1.5%的NaOH溶液中,然后加入5 g优级纯BaCl2, 震荡, 放置2 h后, 过滤,滤液置于冰箱中保存, 可保存1周, 使用时稀释3倍即可。
还原剂: 5%硫脲+3%抗坏血酸(Vc), 称取5 g硫脲和3 g Vc分别加入到100 mL已称好的Milli-Q水中, 摇匀, 冷藏可保存1周。
缓冲溶液: 分别配制0.1 mol/L的柠檬酸和柠檬酸钠溶液, 配制 200 mL缓冲试剂时, 移取 120 mL 0.1mol/L的柠檬酸溶液和80 mL 0.1 mol/L的柠檬酸钠溶液混匀, 冷藏可保存1周。
1.2 Sb(V)标准系列的配制
取60 mL聚乙烯瓶7个, 移取24 mL Milli-Q水,加入3 mL重蒸过的HCl, 加入Sb(Ⅴ)标准溶液, 使锑标准溶液的浓度分别为0、0.03、0.06、0.09、0.12、0.15、0.18 µg/L, 再加入 3 mL 的还原剂, 摇匀, 反应90 min。
1.3 Sb(III)标准系列的配制
取60 mL聚乙烯瓶7个, 移取27 mL Milli-Q水,加入3 mL缓冲试剂, 再加入Sb(Ⅲ)标准溶液, 使锑标准溶液的浓度分别为0、0.01、0.02、0.03、0.04、0.05、0.06 µg/L, 摇匀。
1.4 水样的测定
对于总无机锑浓度的测定, 准确移取 24 mL水样于60 mL聚乙烯瓶中, 然后加入3 mL重蒸过的盐酸和 3 mL还原剂, 摇匀, 使其充分反应, 以制作标准曲线相同的方法用原子荧光光度计进行测定。对于Sb(Ⅲ)浓度的测定, 准确移取27 mL水样于60 mL聚乙烯瓶中, 然后加入 3 mL缓冲溶液调至 pH为4.0~4.5, 以制作标准曲线相同的方法用原子荧光光度计进行测定。Sb(V)的含量通过差减法计算得到,即Sb(Ⅴ+Ⅲ)的含量减去Sb(III)的含量。
2 结果与讨论
2.1 Sb(Ⅴ+Ⅲ)的分析方法
2.1.1 仪器条件的选择
2.1.1.1 灯电流的选择
随着灯电流的增加, 荧光强度会增大(图 1)。信噪比也随灯电流的增大而增大, 在60 mA时信噪比达到最大值, 由于灯电流过高会影响到灯的使用寿命, 故本实验选择灯电流为60 mA。
2.1.1.2 负高压的选择
在-200 ~-300 V范围内, 信号值随着负高压的增大而增大(图2), 但在负高压为-280 V以上时, 仪器的噪声过高, 导致仪器无法调零, 测量的精密度也不好, 故本实验选择负高压为-260 V。
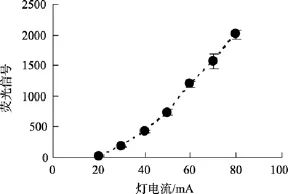
图1 灯电流的影响Fig. 1 The effect of electric current on the intensity of fluorescence
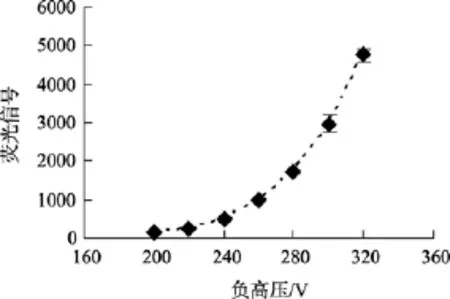
图2 负高压的影响Fig. 2 The effect of voltage on the intensity of fluorescence
2.1.1.3 原子化器温度的选择
炉温对测定灵敏度、线性范围、消除记忆效应都有较显著的影响。当炉温较高时, 自吸现象比较明显, 随着炉温的升高, 信号值先增大, 后减小, 在190 ℃时信号值高且稳定(图 3)。因此, 本实验选择190 ℃为最佳炉温。
2.1.1.4 载气流量
信号值会随着载气流量的增大先增大后减小,这是因为载气流量过小不能将生成的氢化物及时输送到石英管产生火焰并原子化, 载气流量过大时,会稀释火焰中基态原子的浓度和缩短待测物质在火焰中的时间, 从而降低灵敏度, 根据净信号值和信噪比随着气流量的变化, 最终选定气流量为 600 mL/min。
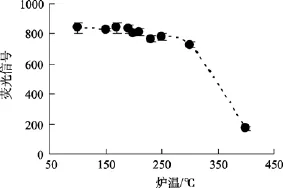
图3 炉温的影响Fig. 3 The effect of temperature on the intensity of fluorescence
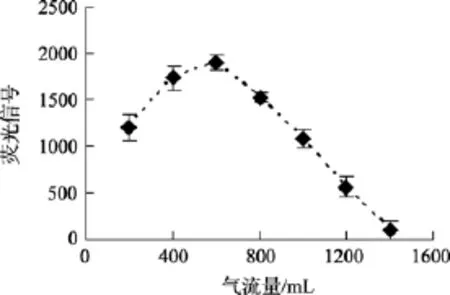
图4 Ar流量的影响Fig. 4 The effect of Ar flux on the intensity of fluorescence
2.1.2 实验条件的选择
2.1.2.1 还原剂用量的选择
在10 µg/L的Sb(Ⅴ)溶液中加入不同量的还原剂(5%硫脲+3%Vc), 结果如图5所示, 还原剂用量大于2 mL以后, 信号值基本保持不变。为避免还原剂加入量过高引入的沾污, 本实验选择还原剂的加入量为3 mL。
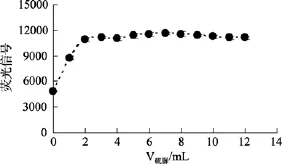
图5 Sb(Ⅴ+Ⅲ)还原剂用量的选择Fig. 5 The effect of flux of reducing agent on the intensity of fluorescence
2.1.2.2 还原时间的选择
于 10 µg/L的 Sb(Ⅴ)溶液中分别加入 3 mL的HCl和3 mL的还原剂, 分别在反应不同的时间测定,结果表明(图6), 当反应时间超过1h时, 信号时间为90 min。值趋向于稳定, 故本实验选择最佳反应时间为90 min。
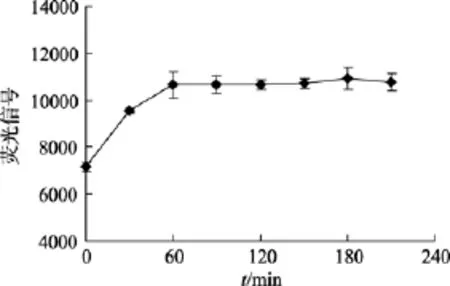
图6 Sb(Ⅴ+Ⅲ)反应时间的选择Fig. 6 The reaction time of Sb(Ⅴ+Ⅲ)on the intensity offluorescence
2.1.2.3 酸度的选择
在不同酸度下, 在 1 µg/LSb(Ⅴ)溶液中分别加入3 mLHCl和3 mL还原剂90 min后进行测定, 由结果可知(图 7)在强酸度下, 信号值比较稳定, 酸度越弱, 依靠氢化物发生反应生成的氢化物不足以点燃火焰, 酸度高, 则空白高, 故本实验选择在盐酸浓度为1 mol/L时进行测定。
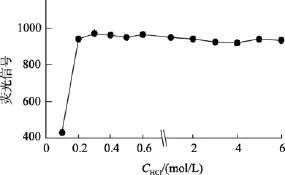
图7 酸度的影响Fig. 7 The effect of acid concentration on the intensity of fluorescence
2.1.2.4 线性范围
图8是原子荧光光度法测定Sb(V+III)的工作曲线(进样量为2 mL)。由图8可见当Sb(V+III)含量大于14 µg/L时工作曲线的斜率开始偏离, 即在选定条件下, 方法的线性范围为 0~14 µg/L。天然水体Sb(V+III)含量一般为 1µg/L,为验证本方法在低浓度范围分析的可靠性, 在 0~0.18 µg/L范围内做工作曲线(图9), 斜率为1 258.5, 不同天斜率的重现性基本一致, 说明本方法可以分析低浓度天然水样品。
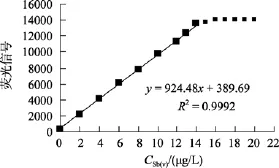
图8 Sb(Ⅴ)的线性范围Fig. 8 The linearity range of Sb(Ⅴ)
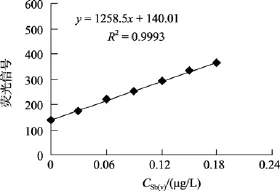
图9 Sb(Ⅴ)的低浓度工作曲线Fig. 9 The standard curve for Sb(Ⅴ) detection
2.1.2.5 不同介质对Sb(V+III) 测定的影响
为了验证 Sb(V+III)的测定有无基质效应, 取黄河水和南海水按不同比例混合以模拟不同盐度的水体, 并以此为介质做 Sb(V+III)的标准曲线, 各种介质中的斜率如表1所示。由表1可知, 不同介质中工作曲线的斜率与以Milli-Q为介质的斜率相比, 均在5% 范围内变动, 因此, 用 Milli-Q 水做工作曲线对复杂的天然水样品是可行的。
2.1.2.6 天然水体中一些离子的干扰
水体中无机离子的干扰通常属于液相干扰, 即发生在水体中溶解态锑被还原成挥发性的SbH3前的干扰, 在本实验中, 考虑了9种无机离子, 包括Fe2+,Zn2+, Pb2+, Mn2+, Ni2+, Cd2+, As3+, Se2+, Al3+等金属离子对Sb测定的干扰情况。实验中在1 µg/L的Sb(V)的溶液中分别加入10倍于海水中各金属离子的含量,进行测定, 如表2所示, 加入干扰离子后测得的荧光信号值与未加干扰离子的荧光信号之比均小于 5%,这一偏差在痕量分析所允许的误差范围内, 因此可认为它们对锑的原子荧光分析都不存在显著的干扰。
2.1.2.7 方法的回收率精密度与检出限
用原子荧光光度法对不同盐度的天然水体进行回收率实验, 结果如表3所示。对不同盐度的海水及河水测定的回收率在 93.7%~105%之内, 说明氢化物发生-原子荧光光度法对 Sb(Ⅴ+III)的测定有较好的结果。对质量浓度0.3 µg/L和0.03 µg/L的样品分析精密度分别为 2.0% 和 1.9%(n=9), 对空白平行进行 11次测定, 得到本方法的检出限(3σ)为 0.024µg/L。

表1 不同介质中工作曲线的斜率Tab. 1 The slope of Sb(Ⅴ+III) in different medium
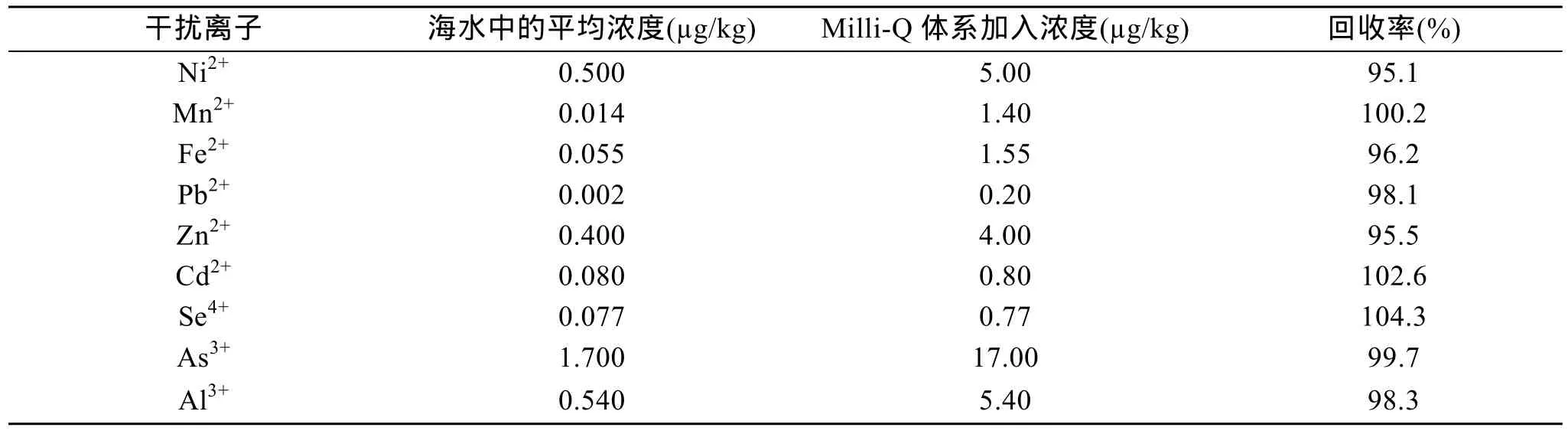
表2 天然水体中一些无机离子对锑测定的影响Tab. 2 The effect of various inorganic ions on the measurement of antimony
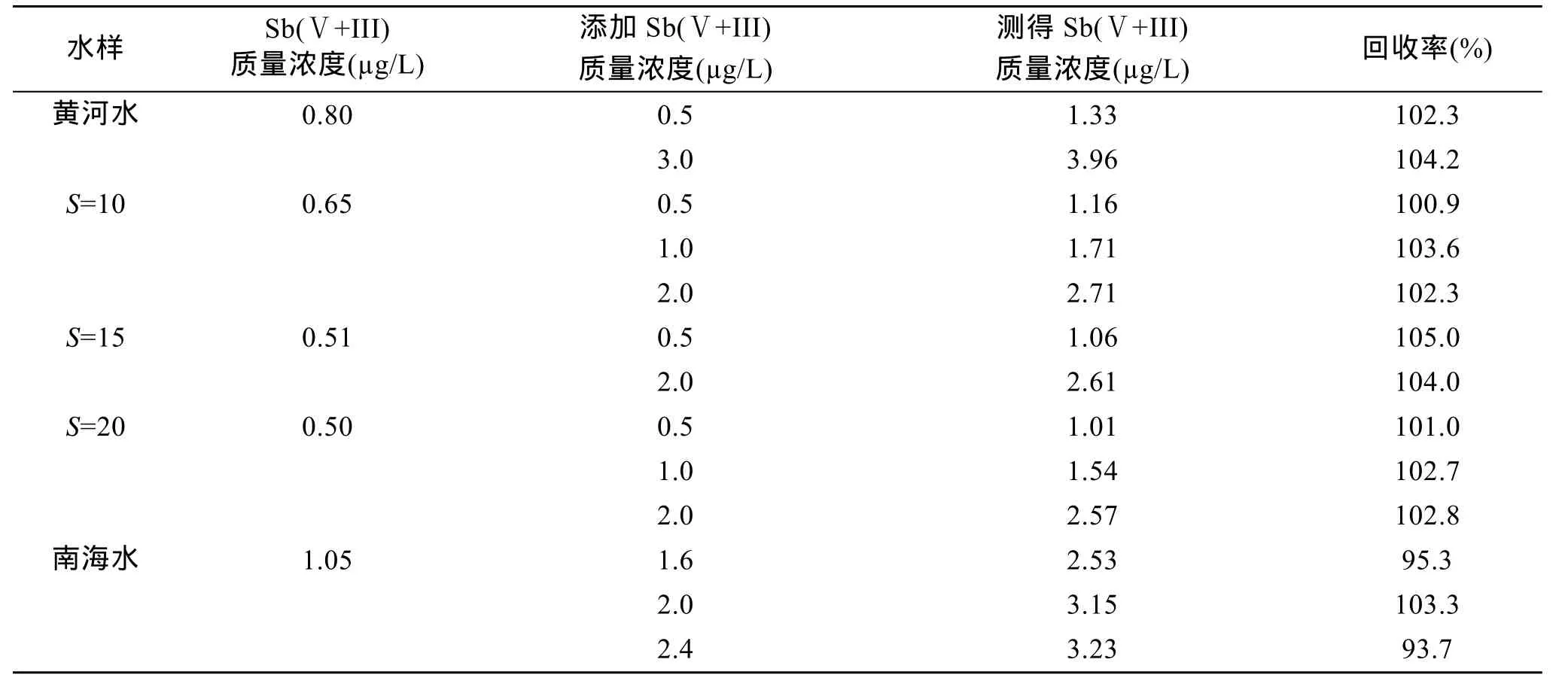
表3 Sb(Ⅴ+III)的回收率实验Tab. 3 The recovery of Sb(V+III)
2.2 Sb(III)的测定
2.2.1 酸度的选择
不同的酸度条件下, Sb(III)和Sb(Ⅴ)的反应信号不同, 利用缓冲体系调节溶液的 pH, 使得在一定的酸度体系范围内, 将 Sb(Ⅴ)和 Sb(III)有效地分离开来。如图10所示, 当pH >3时,Sb(Ⅴ)的信号值极低, 能够和Sb(III)有效分离。考虑到柠檬酸钠的缓冲能力, 本实验选择在pH为4.0~4.5时测定Sb(III)。
2.2.2 辅助氢气流量的选择
当pH>1时, 由于酸度过低, 依靠氢化物发生反应生成的氢化物无法点燃火焰, 所以需加氢气辅助点火(图11)。当辅助氢气流量过大时, 由于稀释了氢化物, 使得信号值下降, 而当氢气流量<100 mL/min,信号值低, 这是因为氢气流量低, 原子化不完全。因此本实验的选定的氢气流量为100 mL/min。
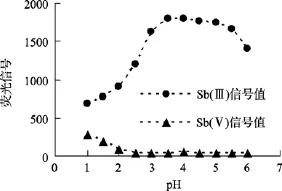
图10 酸度的影响Fig. 10 The effect of acid concentration on the intensity of fluorescence
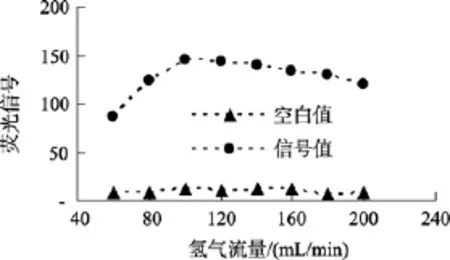
图11 氢气流量的变化Fig. 11 The effect of flux of H2 on the intensity of fluorescence
2.2.3 Sb(III)分析的精密度、回收率和检出限
用原子荧光光度法对不同盐度的天然水体进行准确性回收率实验, 结果如表 4所示。对不同盐度的海水及河水测定的回收率在 91.1%~104% 之内。说明氢化物发生-原子荧光光度法对Sb(III)的测定有较好的结果。对浓度0.04 µg/L 和0.01 µg/L的样品分析精密度3.8% 和5.5%(n=9), 对空白平行进行 11次测定, 得到本方法的检出限(3σ)为 0.001 3µg/L。
3 结论
建立了天然水中Sb(Ⅴ+III)和Sb(III)的原子荧光光谱测定方法。方法的精密度良好。本实验采用差减法测定 Sb(Ⅴ)。选择的最佳仪器条件为: 灯电流60 mA, 负高压-260 V, 原子化器的温度190 ℃和氩气的载气流量600 mL/min。Sb(Ⅴ+III)在1 mol/L HCl介质中进行测定, 检出限为0.024 µg/L, 线性范围为0~14 µg/L, 对浓度 0.3 µg/L 和 0.03 µg/L 的样品分析精密度分别为 2.0% 和 1.9%(n=9), 方法的回收率93.7%~105%。Sb(III)是在柠檬酸和柠檬酸钠缓冲溶液中(pH 为4.0~4.5), 辅以100 mL/min的氢气进行测定, 测得检出限为0.0013 µg/L, 对浓度0.04 µg/L和0.01 µg/L的样品分析精密度3.8% 和5.5%(n=9),方法的回收率 91.1%~104%。二者在不同介质中工作曲线的斜率变动范围均小于5%。该方法适合于天然水体中Sb(Ⅴ+III)和Sb(III)的测定。
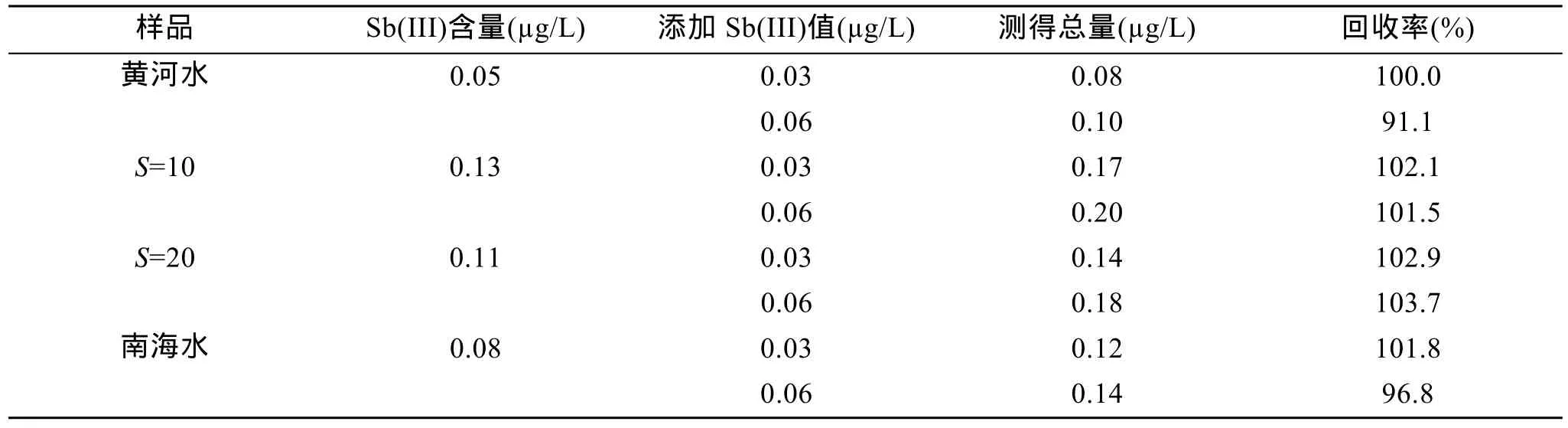
表4 Sb(III)在不同基体中的回收率Tab. 4 The recovery of Sb(III)
[1]客绍英, 石洪凌, 刘冬莲. 锑的污染及其毒性效应和生物有效性[J].化学世界, 2005, 46(6): 382-384.
[2]何孟常, 万红艳.环境中锑的分布、存在形态及毒性和生物有效性[J].化学进展, 2004, 16(1): 131-135.
[3]Cutter G, Cutter L.Behavior of dissolved antimony,arsenic, and selenium in the Atlantic Ocean[J].Marine Chemistry, 1995, 49(4): 295-306.
[4]Cutter G, Cutter L. Metalloids in the high latitude North Atlantic Ocean: Sources and internal cycling[J]. Marine Chemistry, 1998, 61(1-2): 25-36.
[5]Andreae M, Froelich P. Arsenic, antimony, and germanium biogeochemistry in the Baltic Sea[J].Tellus.Series B, Chemical and physical meteorology, 1984,36(2): 101-117.
[6]Cutter G. Dissolved arsenic and antimony in the Black Sea.Deep-sea research. Part A[J]. Oceanographic research papers, 1991, 38(2): 825-843.
[7]Filella M. Williams P.Belzile N. Antimony in the environment: knowns and unknowns[J].Environ Chem,2009, 6: 95-105.
[8]Filella M, Belzile N, Chen Y. Antimony in the environment: a review focused on natural waters I. Occurrence[J]. Earth Science Reviews, 2002, 57(1-2):125-176.
[9]Ainsworth N, Cooke J.. Johnson M. Distribution of antimony in contaminated grassland: 1—Vegetation and soils[J].Environmental Pollution (Barking, Essex:1987), 1990, 65(1): 65.
[10]Krachler M. Emons H. Potential of high performance liquid chromatography coupled to flow injection hydride generation atomic absorption spectrometry for the speciation of inorganic and organic antimony compounds[J]. Journal of Analytical Atomic Spectrometry, 2000, 15(3): 281-285.
[11]Miravet R, López-Sánchez J, Rubio R. New considerations about the separation and quantification of antimony s species by ion chromatography-hydride generation atomic fluorescence spectrometry[J].Journal of Chromatography A, 2004, 1052(1-2):307-312.
[12]Müller K. Simultaneous determination of inorganic and organic antimony species by using anion exchange phases for HPLC-ICP-MS and their application to plant extracts of Pteris vittata[J].Talanta, 2009, 78(3):820-826.
[13]Cabon J, Louis Madec C. Determination of major antimony species in seawater by continuous flow injection hydride generation atomic absorption spectrometry[J]. Analytica Chimica Acta, 2004, 504(2):209-215.
Determination of major antimony species (Sb(V) and Sb(III))in natural water by hydride generation atomic fluorescence spectrometry
WAN Yu-xia, REN Jing-ling
(College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China)
Feb., 9, 2010
Atomic fluorescence spectrometry; Sb(V); Sb(III); natural water
A method for the determination of Sb (Ⅴ+III) and Sb (III) by atomic fluorescence spectrometry (AFS) in natural water was established in this study. The optimal instrumental parameters were electric current, 60 mA;voltage, -260 V; temperature, 190 ℃; and Ar flux, 600 mL/min. The method was based on the behavior of total antimony (Sb(V+III)) and antimony (III) under different acidic conditions. Total antimony was determined at 1 mol/L HCl; and antimony (III) was determined at pH =4.0~4.5. Under optimized conditions, the detection limit (3σ)for Sb (V+III) and Sb(III) were 0.024 µg/L and 0.0013 µg/L, respectively. For total antimony, the precision for the sample of 0.3 µg/L or 0.03 µg/L was 1.95% or 1.92%, respectively (n= 9). The linearity was 0~14 µg/L. For antimony (III), the precision for the sample of 0.04 µg/L or 0.01 µg/L are 3.8% or 5.5%, respectively (n= 9). The recoveries for Sb(Ⅴ+III) and Sb(III) are 93.7%~105% and 91.1%~104%, respectively. The method can be used directly to the determination of Sb (V+III) and Sb (III) in natural water.
P734.4
A
1000-3096(2011)04-0037-07
2010-02-09;
2010-05-20
国家重点基础研究发展规划项目(2006CB400601); 国家自然科学青年基金项目(40606028)
万玉霞(1983-), 女, 山东青岛人, 硕士研究生, 主要从事海洋生物地球化学研究, E-mail: yuxiawan@yeah.net; 任景玲, 通信作者, 电话: 13573866779, E-mail: renjingl@ouc.edu.cn
康亦兼)

