光质对海带配子体生长发育影响的研究
隋晓伟,任 伟,闫文华,刘升平,杨 宁
(1.青岛农业大学 动物科技学院,山东 青岛266109;2.山东威海高绿集团有限公司,山东 荣成 264318)
海带是重要的经济海藻之一,应用价值较高[1]:其产品在医药、食品、化工等方面有广泛应用;海带是海洋生态系统的重要组成部分,对于维持海洋生态平衡,增加海洋渔业资源,海洋富营养化等的生态修复等发挥了重要作用[2]。
海带的生活史具有明显的孢子体和配子体的世代交替现象[3],配子体阶段尽管在生活史中时间短、个体小,但生物学意义重大,尤其是配子体克隆技术的应用为育种、种质保存等发挥了巨大的作用。
光是影响植物光合作用、光形态建成、不适情况下造成光损伤的重要的环境因子。光质、光强能够调节光合作用不同类型叶绿体蛋白质复合物的形成以及光系统Ⅱ和光系统I间的电子传递。Shi等[4]研究发现海带胚孢子的萌发不依赖于光质与光强,而配子体的生长速度随着红蓝光光强的增高而加快,蓝光的刺激效应比红光强;配子体的受精依赖于蓝光,而且只有蓝光照射强度达到一定程度才能产生诱导效应。自然光下的海带代谢活动主要是受到白光调控,但是单色光对海带生长发育以及一些酶的影响越来越受到关注。
作者于2009年至2010年先后通过3次实验,研究了蓝、绿、红3种主要波段的单色光,在不同光强下对海带配子体的生长、发育的影响。
1 材料与方法
1.1 材料
1.1.1 实验材料
本实验所用海带(Laminaria japonicaAresch)于2009年8月取自山东荣成俚岛湾。
1.1.2 培养液
培养液按自然海水加NaNO3-N:2×10-6g/L;KH2PO4-P:0.2×10-6g/L;煮沸消毒后使用。
1.1.3 光源
白光由荧光灯提供,蓝光、绿光、红光由 LED灯提供,其波长分别为蓝光 450~480 nm,绿光480~550 nm,红光 640~750 nm。
1.2 实验方法
取有成熟孢子囊的海带,洗刷消毒后,阴干刺激2 h,于10℃消毒海水中放散游孢子,游孢子的密度达到每100 X视野下约10~15游孢子时结束放散;以载玻片做附着基,当100 X视野下附着约15~20个胚孢子时收集载玻片,进入实验阶段。不同光质分别设定了不同的光照强度,每种光强重复实验3次,具体光强设定如下:
蓝光(lx):2000、1100、800、600、350、200、100、50;
绿光(lx):3200、1600、800、400、200、100;
红光(lx):2700、1500、750、500、250、100;
以白光(1000 lx)下培养作为对照。
各组实验的光照周期12L:12D,培养温度10 ℃,每天更换培养液1次。
1.3 数据处理
光镜下观察配子体的生长发育情况,每天用显微镜和LY-WN-HP SUPER CCD万能视频成像装置测量配子体的长度变化,排卵之后记录排卵数,以排卵率来表示。
配子体平均生长速度N=(Xn-X0)/(tn-t0),式中N为平均生长速度;Xn、X0当天和初始的配子体长短直径的平均长度;tn、t0分别为对应的培养天数。
配子体的排卵率=排卵细胞数/(配子体数+排卵数)×100%
产生无性繁殖时的排卵率=排卵细胞数/(配子体数+排卵数+未排卵的无性繁殖的细胞数)×100%
数据采用spss软件进行方差分析。
2 结果与分析
2.1 光质对配子体生长的影响
不同光质各光强梯度下配子体的生长速度(图1)表明,蓝光条件下配子体的生长速度相对较快。在50~2 000 lx的实验光强范围内,50 lx时,配子体的生长速度缓慢,随着光照强度的增加,配子体的生长速度逐渐增加,光强达到 800 lx以上时生长速度开始大于对照组,2 000 lx时达到最大。方差分析显示,在600~1 100 lx蓝光下与白光比较配子体生长差异不显著。而2 000 lx蓝光条件下配子体的生长具有明显的优势;但高光强的蓝光照射的配子体易发生无性繁殖形成丝状体,在初次排卵阶段800、1 100、2 000 lx实验组的配子体形成丝状体的比率分别为28%、35%、47%,呈现随着光强的增加而提高的趋势。
绿光在100~3 200 lx光照强度范围内,随着光强的增加,配子体的生长速度逐渐增加;方差分析显示:在1 600 lx以下,配子体的生长速度显著小于白光,3 200 lx时生长速度达到最大,与白光的生长速度相近;高光强的绿光照射下也容易形成丝状体,初次排卵时绿光1 600、3 200 lx的丝状体形成比率分别为31%、53%。
红光在100~2 700 lx的光强范围内,随着光强的增加,配子体的生长速度逐渐增加,但其生长速度显著低于白光的生长速度;与蓝光、绿光相似,高光强的红光也能诱导丝状体的发生,排卵阶段红光1 500、2 700 lx的丝状体形成比率分别为37%、38%。
2.2 光质对配子体发育的影响
实验结果显示,不同光质各光强梯度配子体初次排卵的时间及排卵率差别较大,见表1。
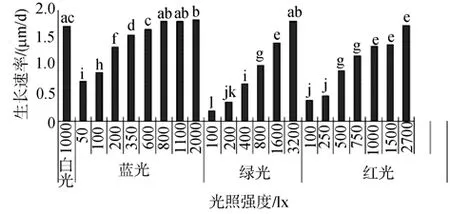
图1 不同光质、光强条件下配子体的平均生长速度及多重比较分析Fig.1 The average growth rates under lights with various wavelengths and intensities
2.2.1 不同光质对配子体初次排卵时间的影响
蓝光在 350 lx以上光强条件下,配子体的发育速度都达到或超过白光组;而绿光1 600 lx以下都达不到白光的发育速度,只有在3 200 lx的强光条件下才与白光接近;而红光在实验范围内的光强条件下排卵时间都远远超过白光对照,排卵量极低(表1)。
2.2.2 不同光质对配子体排卵率的影响
从排卵率的指标看,除了蓝光在 200~600 lx范围内,优于白光对照外,其他(包括其他波长光)实验组别都低于白光;绿光在1 600 lx时排卵率最高,但排卵时间推迟,排卵率大幅度低于白光;而红光在实验范围内只有个别排卵现象。
2.2.3 不同光条件下初次排卵时配子体细胞大小的差异
由表1可以看出,不同光条件下配子体排卵前的平均直径有较大差异,其中蓝光条件下排卵前的平均直径最小,在18.96~22.70 μm之间,小于白光的24.48 μm,而红光最大,尽管在只有个别排卵的情况下,配子体的平均直径已经达到 24.70~25.53 μm 之间。
3 讨论
3.1 光质与配子体生长的关系
海藻生活于海洋,自然光通过海水时,海水以及海水中的悬浮与溶解的物质对不同波长光的吸收与散射不同,导致不同海域不同水深的光谱结构不同,长期对环境的适应与进化的结果,形成了海藻色素的多样性,而陆地高等植物的光合色素相对稳定,因此对海藻进行光质方面的研究较陆生植物更有意义。单色光实验的目的不是为了选择某一波长的光为最佳生长、发育条件,而是判断某一海藻对各个波段光的需求,最终取得某种海藻在某一时期合理的光谱组合和剂量。摒弃无效和有害波段的光,最终获取海藻最适宜的光条件:满足光合作用和形态建成的需要,降低光损伤的程度。实验证明,促进海带配子体生长的,主要为蓝光和绿光,红光的作用较小,白光并非最佳条件。与Lüning[5]等提出的糖海带(L.saccharina)配子体的生长速度与光质无关不同,具体原因有待进一步研究。
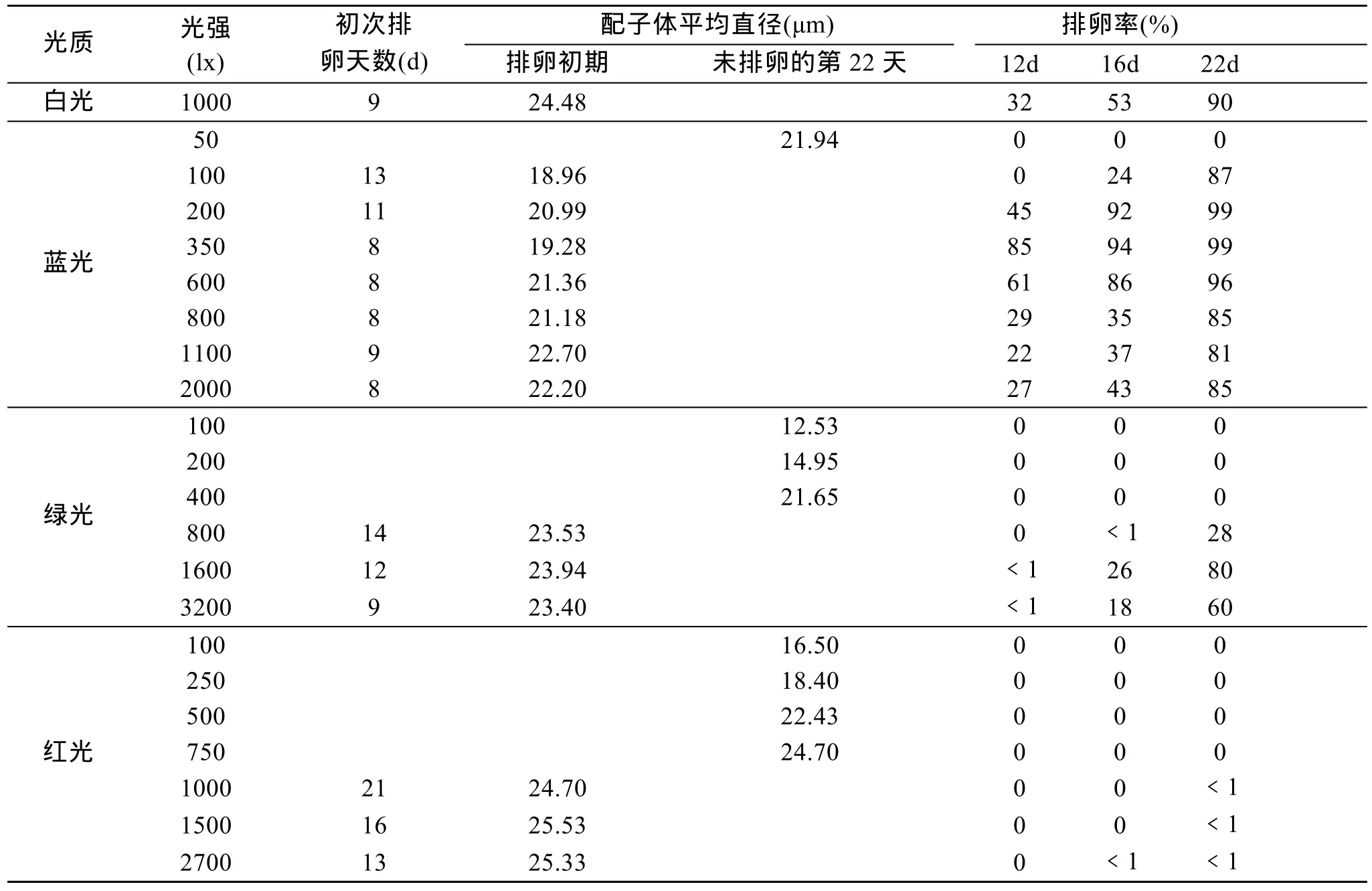
表1 不同光质、光强条件下配子体的发育Tab.1 The reproduction of the gametophytes in different light quality,light intensity conditions
3.2 不同波长光的光强变化与海带配子体生长的关系
目前大部分研究认为配子体的生长速度随着蓝光、红光光照强度的增加而增加,蓝光刺激效应最大[4-6]。单色光条件下,光照强度的变化对海带配子体的生长影响较大,在实验范围内,随着光强的增加而提高,但是高光强条件下易于诱导无性繁殖的发生,该点有较大的实践意义:在孢子水法海带育苗中,配子体发生无性繁殖,往往会推迟排卵,导致幼苗大小差异过大,同时,无性繁殖产生丝状体后再排卵,发生的孢子体的假根不发达、不牢固,育苗后期容易出现脱苗;而在海带配子体克隆技术中则需要配子体进行无性繁殖,因此光强的调控可以作为辅助条件控制发育及无性繁殖。
3.3 海带配子体发育与光质的关系
从排卵时间和排卵率两项指标分析,在三种单色光中蓝光对海带配子体的发育的促进作用最大,绿光其次,红光最差,这个结果与对配子体生长的关系有些类似。Lüning[6-7]等认为蓝光促进了配子体的发育,而红光则起抑制作用。当照射光的波长都大于512 nm时,海带配子体不能发育,对发育起作用的是400~512 nm的辐射能,与本研究相吻合。
而在各种光条件下呈现出随着光强的提高发育加快的趋势,但蓝光和绿光在高光强条件下出现反复,反复之后仍然有随光强的提高而加快的现象,究其原因,是无性繁殖所致,前文述及配子体的无性繁殖也是随着光强的提高而增大,高光强条件下,部分配子体先发生无性繁殖形成丝状体,丝状体的形成推迟了排卵,但随着时间的继续加长仍然是高光强条件下发育快。因此出现了随着光强的提高配子体的发育速度提高,当出现无性繁殖后发育速度减慢,但随后又开始上升的现象。
实践中,控制发育与无性繁殖有时是相互排斥的,如在孢子水育苗时我们不希望无性繁殖的发生,但在海带配子体克隆扩大培育时也不希望有排放精、卵现象的发生,那么在不同目的的实践操作中控制适宜的光强很有必要。因此,孢子水育苗时将蓝光控制在 350~600lx既可以保持配子体较快的生长速度,又可以有效预防无性繁殖的发生,同时能够缩短配子体发育及完成排卵所需的时间,保证苗种大小规格的统一。
海带的胚孢子萌发后形成的配子体首先要生长达到一定大小后才能排放精、卵,本实验中发现,光质条件不同发育速度不同,同时排放精卵前配子体的大小也有差别,发育快的配子体个体小,配子体的发育是一个过程,在这个过程中需要进行一些活性诱导物质的释放[8],不同光质照射可能影响了这些诱导物质的形成和释放,因此导致了配子体的大小、发育时间和排卵率的不同。但配子体排卵阶段个体的大小对将来的生长、发育的影响如何目前还不得而知,需要进一步的探讨。
4 结论
蓝光、绿光、红光对海带配子体的生长都有促进作用,其中蓝光最大、绿光其次、红光稍差于绿光。
对海带配子体发育影响的主要因素是蓝光,绿光也有一定作用。红光的作用极少。
在一定范围内,随着光强的提高海带配子体的生长、发育速度加快,但高光强容易诱导无性繁殖的发生,并由此推迟排放精、卵。
[1]刘涛,崔竞进,戴继勋,等.海带配子体克隆的培养与应用[J].青岛海洋大学学报,2000,30(2):203-206.
[2]金振辉,刘岩,张静,等.中国海带养殖现状与发展趋势[J].海洋湖沼通报,2009(1):141-150.
[3]吴超元,索如瑛,曾呈奎,等.海带养殖学[M].北京:科学出版社,1962:14-33.
[4]Shi H Z Bressan R.RNA extraction[J].Methods in Molecular Biology,2006,323:345- 348.
[5]Lüning K,Neushul M.Light and temperature demands for growth and reproduction of Laminarian gametophyte in southern and central[J].California Mar Biol,1978,45:297-309.
[6]Lüning K,Dring M J.Reproducing,growth and photosynthesis of gametophytes of Laminaria saccharina growth in blue and red light[J].Mar Biol,1975,29(1):195-200.
[7]Lüning K,Critical levels of light and temperature regulating the gametogenesis of three Laminariaspecies(Phaeophyceae) [J].J Phycol,1980,16(1):1-15.
[8]Lüning K,Dring M J.Reproducing,growth and photosynthesis of gametophytes of Laminaria saccharina growth in blue and red light[J].Mar Biol,1975,29(1):195-200.

