近10年鱼类细胞培养研究进展及应用展望
张 博, 陈松林
(1. 中国水产科学研究院 黄海水产研究所, 农业部海洋渔业可持续发展重点开放实验室, 山东 青岛 266071;2. 上海海洋大学 水产与生命学院, 上海 201300)
近10年鱼类细胞培养研究进展及应用展望
Decades of researching progresses of fish cell culture and its application prospects
张 博1,2, 陈松林1
(1. 中国水产科学研究院 黄海水产研究所, 农业部海洋渔业可持续发展重点开放实验室, 山东 青岛 266071;2. 上海海洋大学 水产与生命学院, 上海 201300)
鱼类细胞培养作为一种重要的研究手段, 广泛应用于病毒学、环境毒理学、细胞生物学、肿瘤学、基因组学、遗传学以及资源保护等方面的研究。鱼类细胞作为实验对象, 有着活体鱼无法比拟的优点:(1) 成本低, 细胞系的维护不需要大型的养殖设备和大量的换水与充气; (2)重复性好, 实验条件可以精确控制。因此, 对鱼类细胞系进行深入研究, 无论在理论研究方面, 还是在实际应用方面, 都具有深远意义。作者对鱼类细胞培养方法与技术、鱼类细胞培养研究进展、鱼类细胞系应用和前景展望进行全面系统的综述。
1 鱼类细胞培养方法
鱼类细胞的培养方法包括原代培养和传代培养。鱼类细胞原代培养的方法包括组织块培养法、机械分离法、络合剂分散法、消化分散法、悬浮细胞培养法、微载体细胞培养法等等。以上几种方法常常可以配合使用, 如机械分散法可以同时和酶消化法、络合剂分散法使用, 既使用机械分离又使用化学分离, 摸索一个既能有效地分离细胞又对细胞损伤最小的契合点。络合剂可以络合对消化酶有抑制作用的金属离子, 从而更好发挥酶的作用。悬浮培养主要用于培养如淋巴细胞、部分肿瘤细胞, 同时需要辅以摇床振荡或者搅拌, 以保持细胞均匀的分散在培养基中。微载体培养法需要借助微载体来提高细胞产量, 该技术需要生物反应设备, 适合自动化规模化生产[1]。鱼类细胞培养具有得天独厚的条件: 鱼类细胞培养对传代培养时间、培养温度范围、培养基的选择范围等条件都较哺乳类灵活, 取材更加广泛: 如胚胎组织和幼鱼的各种组织分化程度低, 分裂潜能大, 是原代培养的主要组织来源, 更有优势的是成体鱼的性腺、头肾、后肾、心脏、鳃、鳔、脾脏、鳍条、眼、尾干等组织以及成鱼的肿瘤组织也是常用材料, 并且并不会因为鱼类成年而降低细胞的分裂能力, 鱼类细胞平均传代 100代仍可以继续分裂, 比起哺乳类, 鱼类的有丝分裂极限要大得多, 并且鱼类细胞系每一代细胞的存活期均较长;人和哺乳动物离体培养的正常二倍体细胞株寿命均有限, 一般不超过50代。
2 鱼类细胞培养研究进展
2.1 国外鱼类细胞系建立状况
自20世纪60年代, Wolf等[2]建立了世界上第一个鱼类细胞系——虹鳟(Oncorhynchus mykiss)鱼生殖腺细胞系 RTG-2以来, 鱼类的细胞培养研究进展十分迅速。至2010年, 全世界已报道建立的鱼类细胞系约有 275类, 其中大多数来自淡水鱼或溯河产卵的海洋鱼类。淡水鱼类和溯河洄游性鱼类约175株,分别来源于 71个科的 89种鱼类的不同组织; 而海水鱼类及咸水鱼类的细胞系仅有约 100株, 分别来源于 23个科的 35种海水鱼类的不同组织[3]。国外鱼类细胞研究较国内要早很多, 尤其是研究较为领先的美国和北欧的国家。近10 年来, 国外鱼类细胞系的建立和应用研究很活跃。陆续建立了很多新的细胞系, 并且逐渐倾向于细胞系的应用(表1)。
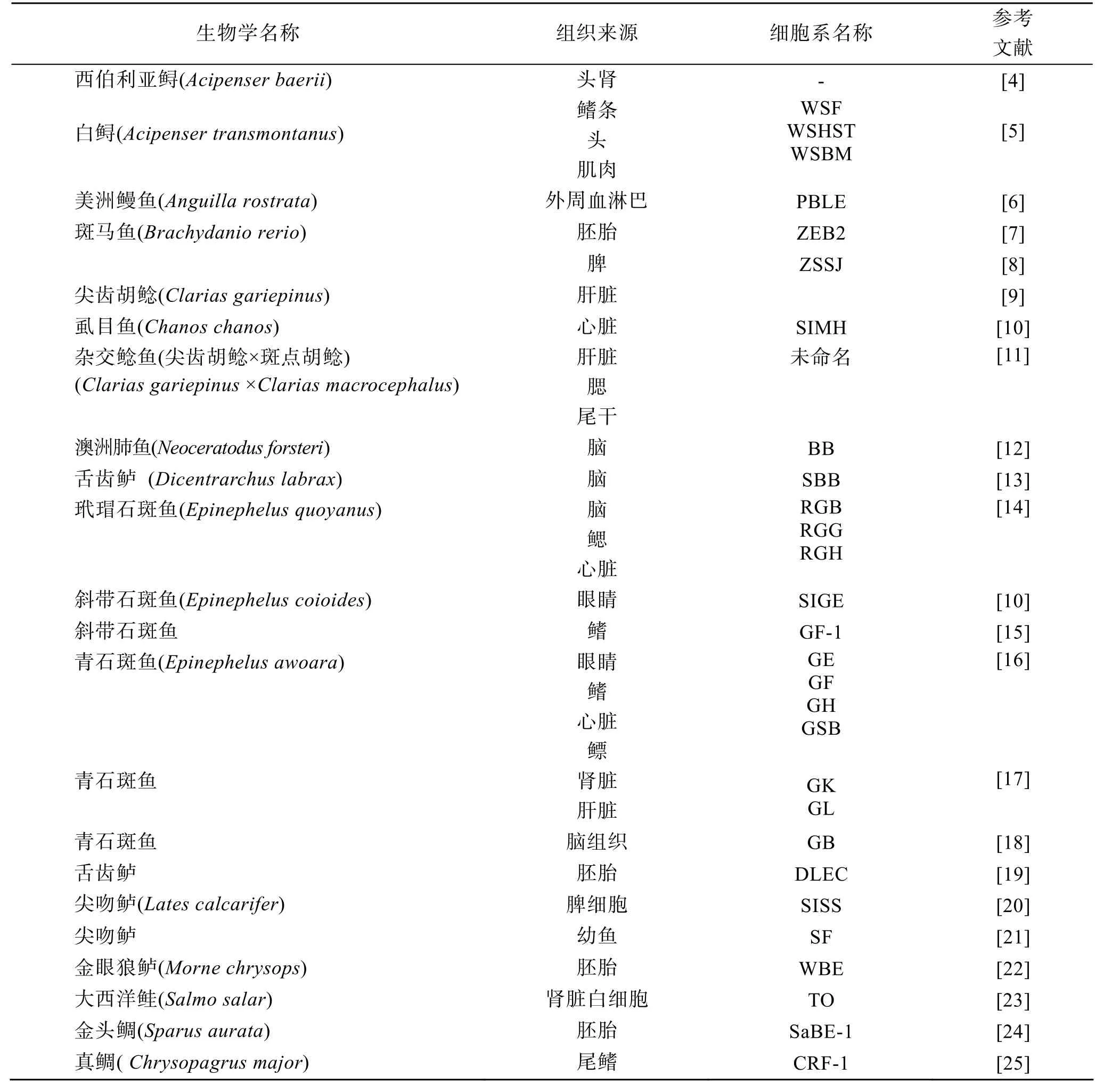
表1 近10年来国外鱼类细胞系建立一览表
2.2 国内鱼类细胞系建立状况
中国鱼类细胞培养的研究始于20世纪 70年代末, 随着海水鱼类养殖规模的发展壮大, 鱼类细胞系的建立和应用范围也越来越大, 截止到2010年上半年, 国内已经建立的鱼类细胞系约 70种, 主要来自40多种鱼类, 来源的组织有吻端、肾脏、卵巢、尾鳍、膘、性腺、肝脏、胚胎、囊胚、原肠胚、鳍条等(表 2)。
3 鱼类细胞系的主要应用
新世纪伊始, 鱼类细胞培养发展更为迅速, 并且日益发挥出它的作用, 具体表现在以下几个方面:(1) 建立的细胞系大量增加; (2) 涉及面拓宽、拓广,不仅表现在细胞系隶属鱼类的品种增加, 由淡水鱼扩展到海水鱼类, 由鱼类扩展到细胞培养的难点——甲壳类和海产贝类, 而且组织来源更广泛, 其中一些肿瘤细胞和癌细胞系的建立更受人关注; (3) 鱼类细胞系的应用更广泛, 已由单纯的病毒分离、免疫学、毒理学、致癌作用、遗传学研究逐步向近些年研究很集中的基因组学、DNA的复制与修饰、表观遗传学、基因敲除、RNAi以及最新的iPS等各个方面发展, 相信未来的一段时间, 细胞系这个重要平台和工具将发挥出更加重要的作用。

表2 近10年来国内鱼类细胞系建立一览表
3.1 鱼类病毒学的研究
鱼类病毒的分离在细胞系建立之前一直是困扰生物学家的难题。迄今已发现的近60种鱼类病毒中,有 9种病毒对渔业生产有严重的影响, 它们是: 双RNA病毒科(Birnaviridae)的传染性胰坏死病毒(Infectious pancreatic necrosis virus), 虹彩病毒科(Iridoviridae)的虹彩病毒(Iridovirus)、棒状病毒科(Baculoviridae)的双链DNA棒状病毒(ds DNA baculovirus)、呼肠病毒科(Reoviridae)的草鱼呼肠病毒(Grass carp reovirus), 野田病毒科(Nodaviridae)的野田病毒(Nodamura virus)、弹状病毒科(Rhabdoviridae)的鲤鱼春季病毒血症病毒(Rhabdovirus carpio)、弹状病毒科的病毒性出血性败血症病毒(Viral hemorrhagic septice-mia virus)、弹状病毒科的传染性造血器官坏死病毒(Infectious haematopoietic necrosis virus)和弹状病毒科的白斑狗鱼幼鱼弹状病毒(Pike fry rhabdovirus)。近些年来病毒的研究已经越来越趋向于成熟。Chang等[21]用建立了亚洲鲈鱼幼鱼细胞系分别感染虹彩病毒(iridovirus)、博尔纳病毒(Borna disease virus)、呼肠病毒科的呼肠病毒(Reovirus)、传染性胰坏死病毒、棒状病毒和野田病毒, 结果显示感染后均表现出明显的病理学效应, 且其中的呼肠病毒科的呼肠病毒、传染性胰坏死病毒、棒状病毒在细胞系中的复制效率最高, 可以用作病毒扩繁。Qin等[39]2005年建立了斜带石斑鱼脾脏细胞系, 并用已经建立的细胞系感染虹彩病毒和野天村病毒: 感染新加坡鲶鱼虹彩病毒和野天村病毒的细胞系表现出很好的病理学效应, 应用透射电子显微镜和免疫荧光显微镜观察显示细胞系对两种病毒都有着很高的敏感性, 暗示了这个细胞系可以作为这两种病毒的分离及繁殖的有力工具。Parameswaran等[10]建立了虱目鱼的心脏细胞系和斜带石斑鱼的眼细胞系, 并将建立的细胞系感染包括野田病毒、海洋伯尔纳病毒(Marine birnavirus)NC1和Y-6、3种双RNA病毒科的传染性胰坏死病毒((IPNV) (VR 299, SP和AB)、海勒姆棒状病毒(Hirame rhabdovirus)(CA 9703)从细胞病理学效应分析评价了该细胞系对于 7种不同病毒的敏感性。Wen等[39]建立了斜带石斑鱼的脑组织细胞系GBC1和GBC4并用于病毒敏感性实验, 发现前者对于神经坏死病毒(GNNV)高度敏感, 但对于花鲈虹彩病毒(GSIV)不敏感而后者的结果正好相反。Mx蛋白诱导的GNNV感染只发生在GBC4, 暗示了Mx蛋白可能抑制RNA的合成。beta野田科病毒过去一直被认为只能在鱼类细胞中增殖, 然而日本学者Takizawa等[52]发现红石斑鱼神经坏死病毒可以在大鼠的星细胞瘤细胞系中扩增繁殖, 这是首次发现beta野田科病毒在哺乳动物细胞系中的增殖, 这将有助于阐明beta野田科病毒宿主专一性的机制。Kim等[53]报道了对2005年肆虐韩国的褐牙鲆病鱼取样进行分析的研究结果。尽管没有分离出任何细菌病毒但用病鱼的组织滤除液感染FHM,CHSE-214以及FSP细胞系还是发现细胞病理学效应, 通过 PCR检测及核苷酸序列比对最终确定病原为滤过性病毒引起的出血性败血病。可见利用细胞系作为工具, 对于病原检测的重要意义。Ku等[14]建立了玳瑁石斑鱼脑、鳃、心脏3个细胞系, 进行了病毒及细胞毒素敏感性的实验, 发现 3种细胞系对于不同病毒和毒素的敏感性存在明显的差异, 同时转入了 pEGFP-C3基因进行了转基因效率的研究。
似乎细胞系的建立与病毒分离的研究已经很成熟, 但是这仅仅存在于鱼类中, 而对于对虾病毒的分离则一直是一个挑战性的题目, 迄今, 屡经尝试也尚未建立一个永久性的对虾细胞系, 如果能建立对虾的永久性细胞系用于对虾的白斑病毒的分离及相关的抗病毒药物筛选研究, 将会在很大程度上促进对虾病毒病的研究工作,而这将是未来一段时间一个焦点课题。
3.2 鱼类细胞疫苗制备
鱼类虽然是低级脊椎动物, 但它仍有较为完善的免疫系统, 研究表明, 鱼类的肾、脾、胸腺和消化道的淋巴组织, 以及血液、淋巴液都是产生免疫应答的主要器官和组织, 它和人类一样具有 T淋巴细胞和 B淋巴细胞, 这是免疫应答过程中起核心作用的淋巴细胞。传统的预防鱼类疾病的方式是利用化学药物和抗生素来控制病害的泛监, 但长期使用抗生素使病菌的抗药性越来越强, 并且大量的药物残留严重破坏了生态环境, 水生有益菌严重失调, 食用鱼的安全性也受到了影响, 探索新型、有效的鱼病免疫防治技术已迫在眉睫。口服疫苗是对受免疫动物引起最小应激的免疫途径, 研制草鱼转基因植物疫苗具有重要科学意义和应用价值。樊廷俊等[49]2007年建立大菱鲆鳍细胞系, 研究了胰蛋白酶、透明质酸酶和Ⅱ型胶原酶消化法启动大菱鲆鳍组织的原代培养的区别, 并通过培养液配方和培养条件的优化成功进行大菱鲆鳍细胞的继代培养。该细胞系的建立对于查清病毒对大菱鲆细胞的感染途径与感染机理等具有重要的理论意义, 对于病毒疫苗研制具有重要应用价值。
3.3 环境毒物和污染物检测
鱼类养殖业的快速发展与工农业污染对水质的破坏, 客观上要求鱼类毒理学的研究与发展的深入。利用体外培养鱼类细胞对环境毒物, 包括诱变剂、致癌物、环境激素和内分泌干扰素、重金属离子、工业废水中的有机污染物进行污染监测和安全性评价,是鱼类细胞培养的重要用途之一。近10年来这方面的应用有了新的发展。泰国的Pornsawan等[9]通过建立的杂交鲶鱼(尖齿胡鲶×斑点胡鲶)3种组织的细胞系进行了细胞毒理学实验, 对比了氢氧化三苯锡对杂交鲶鱼尾干、腮和肝脏细胞系的毒理学影响, 确定了相关的标准。Zhou等[54]利用培养的罗非鱼鳃上皮细胞来检测海水中甲状腺旁激素及二氧化物等污染物。实验显示该细胞对污染物表现出很好的敏感性,因此认为该细胞可以作为很好的环境检测工具。Davorena等[55]进行了河口沉积物对3种鱼类细胞系(CHSE, EPC and RTG-2)生态毒理学的评估, 分别从细胞毒素产生、细胞生存繁殖能力、主要细胞器(溶酶体、线粒体)的形态观察几个方面分析了沉积物中对细胞系的影响, 发现 RTG-2细胞对沉积物的反应最为敏感。韩国的Woo等[56]用慧星拖尾技术检测了海底沉积物和稠环芳烃对于牙鲆血细胞的影响, 研究发现沉积物提取物及稠环芳烃的量、血细胞暴露在二者中的时间与牙鲆血细胞单链DNA的破损程度成正相关。国内张士璀等近年来利用牙鲆细胞系在典型污染物毒性检测上做了大量的工作。Qin等[57]利用体外培养的牙鲆鳃细胞系探讨了壬基酚对牙鲆鳃细胞的毒性影响, 发现此类环境激素可以降低鳃细胞抗氧化酶活性, 使胞内的 O2-水平升高, 超微结构也发生了改变。Zhang等[58]、Su 等[59]和 Li等[60]利用中性红染色法、MTT细胞记数法和细胞蛋白检测法 3种方法检测了有机磷农药、有机锡化合物对牙鲆鳃细胞系(FG)的影响, 摸索到了最低毒害剂量,并从超微结构揭示了有机磷对细胞内典型细胞器的破坏作用。Na等[61]比较了一种杀螨剂对于牙鲆及其鳃细胞系(FG)毒性的影响, 实验发现二者都对杀螨剂的毒性效应比较敏感, 并且长时间的毒性作用与短时间作用对于二者都没有更显著的差异, 鳃和肝组织是对毒性最敏感的组织, 因此得出结论: FG细胞系能够在体外很好地评价杀螨剂对于牙鲆的毒性影响。可见以海水鱼类细胞系作为环境污染和毒物检测工具有广阔的应用前景, 对于环境评估和检测有重要意义。
3.4 基因筛选与功能分析
细胞系还是进行基因功能分析的理想材料, 而对鱼类免疫基因功能的发掘意义重大。鱼类是特异性免疫系统和非特异性系统并存的脊椎动物, 在鱼类对外界刺激及病原生物侵袭的防御反应中, 非特异性免疫起着重要作用。近年来有关鱼类非特异性相关功能基因组的克隆及免疫调节机理的研究已成为研究热点, 已知的非特异性免疫防病相关因子中,鱼类抗菌肽、白细胞介素、干扰素、干扰素调节因子(interferon regulatory factors, 简称IRF)、转化生长因子 β(transfomaing growth factor β, 简称 TGF-β)、肿瘤坏死因子α(tumor necrosis factor α, 简称TNF-α)、趋化因子(chemokine)、NK 细胞增强因子(NK cell enhancement factor, 简称 NKEF)主要组织相容性复合体(major histocompatibility complex, 简称 MHC)包括MHC I和Ⅱ等基因克隆的研究, 已经在斑马鱼(Brachydanio rerio)、鲤鱼(Cyprinus carpio)、草鱼(Ctenopharyngodon idella)、白鲈(Morone chrysops)、虹鳟(Oncorhynchus mykiss)、牙鲆(Paralichthys olivaceus)、大菱鲆(Scophthalmus maximus)等多种鱼类上报道过, 但是其免疫功能在鱼类细胞中的验证目前为止还鲜有报道。只有 Ryosuke等[62]将牙鲆的肿瘤坏死因子基因连锁GFP荧光蛋白表达基因导入经LPS孵育的牙鲆肾脏细胞(YO-K)和牙鲆胚胎细胞(HINAE)。结果显示在LPS的诱导1 h后GFP的表达在两种细胞中都增强, 而3~6 h后在YO-K中表达逐渐减弱, 而在HINAE中仍旧增强。实验结果表明肿瘤坏死因子的启动子受免疫系统的调控。
RNAi是由 dsRNA介导的由特定酶参与的特异性基因沉默现象, 它在转录水平、转录后水平和翻译水平上阻断基因的表达。已有研究表明RNAi能够在哺乳动物中灭活或降低特异性基因的表达, 产生类似基因敲除的效应, 这对于分析研究基因功能具有重要的应用价值。目前 RNAi在非脊椎动物如线虫,果蝇, 以及植物中的应用已经取得了很多重要的成果, 但是在鱼类的研究中还应用较少, 未来可能在鱼类相关基因筛选和功能分析方面会有广泛的应用。最近台湾学者 Wu等[63]通过在澳洲肺鱼的脑细胞系中应用RNAi技术研究了澳洲肺鱼Mx蛋白抵抗神经坏死病毒(NNV)的作用机制, 发现Mx蛋白是通过抑制 NVV的 RNA合成酶(RdRp)从而阻断病毒RNA的合成来实现其抗病毒作用的。这也是国内应用鱼类细胞系进行RNAi干扰的最新尝试。
3.5 鱼类肿瘤研究
培养鱼类的癌细胞是研究肿瘤发生、筛选抗肿瘤药物的重要途径之一。鱼类实验动物在实验肿瘤学, 尤其是其中的比较肿瘤学和从环境毒理学角度探索疑致癌物等研究中发挥着重要的作用。鱼类肿瘤细胞极度增生, 增生细胞常形成肿块, 且具异常结构与功能, 代谢和生长能力非常旺盛, 这些典型的肿瘤症状暗示了鱼类动物细胞是作为肿瘤研究的理想模型。鱼类细胞用于肿瘤学领域已经做了大量的工作并且也取得了一定的成绩。已经发现淡水鱼类机体的所有组织都会发生癌性病变, 而海水鱼则不尽然。例如我们熟知的鲨鱼就从未发现癌变。陈莉等[64]利用肿瘤细胞系研究了鲨鱼软骨的抗癌作用,实验证明: 鲨鱼软骨制剂确实对于肿瘤细胞具有抑制作用。于秋涛等[65]也曾将尝试建立鲨鱼的软骨细胞系, 目的也是为了更好地研究抗肿瘤的机制及帅选抗肿瘤药物。如果能够建立起鲨鱼的软骨细胞系,那么将在很大程度上促进肿瘤学的研究。
3.6 鱼类免疫调节机制研究
Shen等[66]从淡水鲶鱼中分离出第一个变温动物的细胞毒细胞系, 研究了 T淋巴细胞和自然杀伤细胞的作用机制。实验证明, 鲶鱼有一系列不同的细胞毒细胞。2003年 Chisato等[22]通过建立的狼鲈胚胎细胞系感染支原体来研究上皮样细胞表面病原和宿主的相互作用。2003年Meng等[67]以草鱼体外培养的头肾巨噬细胞为模型, 探讨了多种人工合成的寡核苷酸序列和两种不同细菌的基因组DNA对巨噬细胞活化的作用。实验发现含有CpG的寡脱氧核糖核苷酸序列(ODNs)和细菌 DNA都能引起巨噬细胞的活化, 说明CpG DNA在增强鱼类细胞介导的免疫反应方面有重要的作用。作为一种新型有效的免疫调节剂, 它能增强鱼体内细胞和体液介导的免疫应答,从而增强机体的抗病能力。挪威学者Eirin等[23]建立了一个取自大西洋鲑肾脏的吞噬细胞系(TO), 并且通过细胞酶学、单克隆抗体、特异免疫基因表达、real-time RT-PCR等技术鉴定了这个具有免疫功能的细胞系, 该细胞系对于研究鱼类细胞免疫功能具有重要意义。
3.7 鱼类组织工程
鱼类胚胎干细胞的研究主要集中在鱼类胚胎干细胞的培养、鱼类胚胎干细胞的体外分化能力、鱼类胚胎细胞的移植及嵌合体的制作和基因打靶技术等方面。鱼类胚胎干细胞和基因打靶技术的研究目前在中国乃至国际上还处于起步阶段。尽管已经获得了斑马鱼和青鳉(Oryzias latipes)的ES样细胞, 也获得了青鳉干细胞移植的嵌合体, 但是迄今还没有获得能够传递给后代的生殖系嵌合体, 这就需要对基因打靶技术进行深入的研究, Hong[68]和Chen等[69]率先开展了鱼类胚胎干细胞和基因打靶的研究, 建立了永久性花鲈胚胎干细胞系 LJESI,鳉构建了青P53和真鲷脂肪酶的基因打靶载体, 并进行了基因打靶实验[70]。基因打靶技术逐渐成为鱼类胚胎干细胞研究的热点, 可以预见, 胚胎干细胞研究和基因打靶技术将在鱼类发育生物学、鱼类基因工程育种及海洋生物技术等方面发挥很大的作用。随着海水鱼类养殖业的发展, 海水鱼类细胞培养的研究逐渐得到重视。从20世纪晚期开始, 中国启动了海洋863计划, 新世纪伊始, 将海水鱼类细胞培养和细胞系建立列为国家863课题。自此, 中国海水鱼类细胞培养的工作逐步开展起来。童裳亮等[71]于1997年建立了牙鲆鳃等4种永生细胞系, 这为研究牙鲆、鲈鱼和真鲷提供了研究材料。近 5 年多来在海水鲆鲽鱼类细胞培养和海水鱼类细胞库建立方面取得明显进展。Chen等[69]率先建立了花鲈(Lateolabrax japonicus)胚胎干细胞系, 这也是中国第一个鱼类胚胎干细胞系, 在体外将花鲈胚胎干细胞系诱导成肌肉细胞、神经细胞和黑色素细胞等不同细胞类型, 随后 Chen等[34]又建立了真鲷胚胎干细胞系, 并表明在体外具有分化成不同细胞的能力。Chen等[42]在鲈鱼和真鲷胚胎干细胞系的基础上, 将绿色荧光蛋白基因(GFP)转移到花鲈胚胎干细胞中, 建立了表达 GFP的花鲈胚胎干细胞株, 同时还建立了胚胎干细胞移植技术, 获得了GFP标记的胚胎干细胞移植的鲈鱼和斑马鱼胚胎和鱼苗。另外, 还构建了鲈鱼生长抑素基因的同源重组载体, 并建立了鱼类细胞基因打靶的正负选择策略和技术条件, 在国际上也占有一席之地。任国诚等[45]以漠斑牙鲆囊胚期胚胎为材料建立漠斑牙鲆胚胎细胞系, 传至 80 多代, 通过脂质体介导的方法将GFP 报告基因转入 SFEC中, 获得成功表达,转化率为 20%。最近任国诚等[35]建立的半滑舌鳎肝脏细胞系(HTLC), 该细胞系经过 200多天的培养, 已成功传代30多代, 检测了温度、胎牛血清浓度、成纤维生长因子对HTLC生长的影响, 将GFP报告基因通过脂质体介导的方法转入 HTLC中并成功地获得了表达。
4 鱼类细胞培养展望
鱼类细胞系的研究未来仍然有巨大的发展空间。作为一个良好的平台, 近些年逐步向研究很集中的热点学科如基因组学、DNA的复制与修饰、表观遗传学、基因敲除、RNAi以及最新的iPS技术等各个方面发展, 例如它可以结合RNAi技术研究基因功能, 通过 RNA干扰技术, 采用细胞模型可以分析基因的功能。RNAi技术在发掘和分析功能基因上无疑是有力的方法, 如果结合利用细胞系作为这项技术的实验平台, 将其应用到鱼类免疫学的研究中, 以中国重要的海水经济鱼类的细胞系作为实验材料,构建 RNA干扰表达载体, 沉默免疫功能基因, 再用外源病原(细菌、病毒)来感染细胞系, 观察、分析免疫基因沉默与否对细胞系的影响, 验证免疫因子的抗菌作用。这不仅可以节约大量的时间和精力, 而且在一定程度上降低了实验的复杂度, 从而使结果更加清晰, 得到更为理想的实验结果。此平台的建立,可以规模化的分析、研究基因功能, 大大加快抗病疫苗的研发。
海水鱼类细胞系在海洋环境检测方面的应用前景也很广泛。相对于生物个体, 细胞系对于海水中重金属离子、有机氮磷污染物、环境激素等毒物的反应更快、更加敏感, 相信利用海水鱼类细胞系作为海洋环境检测的工具会推动新的、更为安全的环境毒物排放标准的确立。
海水鱼类细胞系对于肿瘤学的研究价值也不可小觑。海洋生物肿瘤发病率低, 典型的如鲨鱼, 终身不会得肿瘤, 可能是鲨鱼软骨中有对肿瘤细胞具有抑制作用的成分。因此建立鲨鱼体细胞系, 进行肿瘤学的研究将有非常重要的实用意义。
海水鱼类非特异性相关功能基因的克隆及免疫调节机理的研究目前已是研究热点, 已知的非特异性免疫相关因子基因克隆的研究已经多有报道, 那么是否还存在其他的鱼类非特异性的免疫因子, 以及其在鱼类细胞中的功能分析和调控网络的研究,都将可能成为未来应用研究的热点。
[1]Freshney R I. Culture of animal cells: a manual of basic Technique (5th ed) [M]. UK: John Wiley & Sons, Inc.2005: 283-294.
[2]Wolf K, Quimby M C. Established eurythermicline of fish cells in vitro[J]. Science, 1962, 135(23): 1065-1066.
[3]Fryer J L, Lannan C N. Three decades offish cell cuhure: A currentlisting of celllines derived from fish [J].Journal of Tissue Culture Methods, 1994, 16(2): 87-94.
[4]Ciba P, Schicktanz S, Anders E, et al. Long-termculture of a cell population from Siberian sturgeon(Acipenser baerii)head kidney [J]. Fish Physiol Biochem, 2008,34(4): 367-372.
[5]Wang G, LaPatra S, Zeng L, et al. Establishment,growth, cryopreservation and species of origin identification of three cell lines from white sturgeon,Acipenser transmontanus[J]. Methods Cell Sci, 2003,25(3-4): 211-220.
[6]DeWitte-Orr S J, Lepic K, Bryson S P, et al. Development of a continuous cell line, PBLE, from an American eel peripheral blood leukocyte preparation [J]. In Vitro Cell Develop Biol-Anim, 2006, 42(8-9): 263-272.
[7]Xing G Y, Lee L E, Wael E S, et al. Initiation of a zebrafish blastula cell line on rainbow trout stromal cells and subsequent development under feeder-free conditions into a cell line, ZEB2 [J]. Zebrafish, 2008, 5(1):49-63.
[8]Xing G Y, Wael E S, Lee L E, et al. Development of a zebrafish spleen cell line, ZSSJ, and its growth arrest by gamma irradiation and capacity to act as feeder cells [J].In Vitro Cell Dev Biol Anim, 2009, 45(3-4): 163-174.
[9]Ghosh M C, Ghosh R, Ray A K, et al. Impact of copper on biomonitoring enzyme ethoxy resorufin-O-deethylase in cultured catfish hepatocytes [J]. Environ Res Sect, 2001, 86(2): 167-173.
[10]Parameswaran V P, Ishaq A, Ravi S, et al. Development and characterization of two new cell lines from milkfish (Chanos chanos) and grouper (Epinephelus coioides) for virus isolation [J]. Marine Biotechnology,2007, 9(2): 281-291.
[11]Pornsawan V, Chanwanna N, Panviroj N, et al. Application of cell culture from hybrid catfish(Clarias gariepinus×Clarias macrocephalus)in screening toxicity of chemicals [J]. Science Asia, 2001, 6(27):75-81.
[12]Wu Y C, Chi S C. Persistence of betanodavirus in Barramundi brain (BB) cell line involves the induction of interferon response [J]. Fish & Shellfish Immunology,2006, 21(5): 540-547.
[13]Arianna S, Bufalino M R, Nishikawa R, et al. Establishment of long term cultures of neural stem cells from adult sea bass,Dicentrarchus labrax[J]. Comparative Biochemistry and Physiology(Part A), 2009, 152(2):245-254.
[14]Ku C C, Teng Y C, Wang C S, et al. Establishment and characterization of three cell lines derived from the rockfish grouperEpinephelus quoyanus: Use for transgenic studies and cytotoxicity testing [J]. Aquaculture,2009, 294(1-2): 147-151.
[15]Chi S C, Hu W W, Lo B J. Establishment and characterization of a continuous cell line(GF-1) derived from grouper,Epinephelus Coioides: a cell line susceptible to grouper nervous necrosis virus (GNNV)[J]. Fish Disease, 1999, 22(3): 173-182.
[16]Lai Y S, John A C, Lin C H, et al. Establishment of cell lines from a tropical grouper,Epinephelus awoara(tem-minck and schlegel), and their susceptibility to grouper irido-and nodaviruses [J]. Fish Disease, 2003,26(4): 31-42.
[17]Lai Y S, Murali S, Ju H Y, et al. Two iridovirus-susceptible cell lines established from kidney and liver of grouper,Epinephelus awoara(temminck and schlegel), and partial characterization of grouper iri-dovirus[J]. Fish Disease, 2000, 23(6): 379-388.
[18]Lai Y S, Murali S, Chiu H C, et al. Propagation of yellow grouper nervous necrosis virus(YGNNV)in a new nodavirus-susceptible cell line from yellow grouper,Epinephelus awoara(temminck and schlegel), brain tissue[J]. Fish Disease, 2001, 24(5): 299-309.
[19]Francesco B, Libertini A, Prugnoli1 D, et al. Production and characterization of a continuous embryonic cell line from sea bass(Dicentrarchus labraxL.)[J].Marine Biotechnology, 2006, 8(1): 80-85.
[20]Parameswaran V, Shukla R, Bhonde R R, et al. Splenic cell line from sea bass,Lates calcarifer: establishment and characterization [J]. Aquaculture, 2006, 261(1):43-53.
[21]Chang S F, Ngoh G H, Kueh L F S. Development of a tropical marine fish cell line from Asian sea bassLates calcariferfor virus isolation[J]. Aquaculture, 2001,192(2-4): 133-145.
[22]Chisato S, Shike H. Characterization of a White bass(Morne chrysops)embryonic cell line with epithelial features[J]. In Vitro Celk Dev Biol-Animal January and February, 2003, 39(1-2): 29-37.
[23]Eirin F P, Ingerslev H C, Stavang V, et al. A highly phagocytic cell line TO from Atlantic salmon is CD83 positiveand M-CSFR negative, indicating a dendritic-like cell type [J]. Fish & Shellfish Immunology,2008, 25(6): 809-819.
[24]Julia B, Hong Y H, Alvarez C M, et al. An ES-like cell line from the marine fishSparus aurata: characterization and chimaera production [J]. Transgenic Research,2002, 11(3): 279-289.
[25]Imajoh M, Ikawa T, Oshima S I. Characterization of a new fibroblast cell line from a tail fin of red sea bream,Pagrus major, and phylogenetic relationships of a recent RSIV isolate in Japan[J]. Virus Research, 2007,126(1-2): 45-52.
[26]Zhou G Z, Gui L, Li Z Q, et al. Establishment of a Chinese sturgeonAcipenser sinensistail-fin cell line and its susceptibility to frog iridovirus[J]. Fish Biology,2008, 73: 2 058-2 067.
[27]孟凡华, 尹洪滨, 孙中武, 等. 鲤鱼细胞系的建立及其生物学特性分析[J]. 实验生物学报, 2005, 38(1):81-84.
[28]张铭, 陈荪红, 赵小立. 淡水白鲳细胞建系及其生长温度特性的研究[J]. 生物工程学报, 2001, 17(1):105-108.
[29]谭凤霞, 杨方星, 王卫民, 等. 稀有鲍鲫鳍细胞系的建立及其作为测定重金属毒性模型的探讨[J]. 水生生物学报, 2009, 33(4): 767-771.
[30]曾令兵, 李晓莉, 张林, 等. 斑点叉尾鲴肾脏组织细胞系的建立及其生物学特性[J]. 中国水产科学, 2009,16(1): 76-81.
[31]霍静, 洪锡钧. 南方鲇肾细胞系的建立及其细胞骨架的研究[J]. 西南大学学报(自然科学), 2007, 29(12):128-133.
[32]Dong C, Shao P, Shi X, et al. Development of a mandarin fishSiniperca chuatsifry cell line suitable for the study of infectious spleen and kidney necrosis virus(ISKNV)[J]. Virus Research, 2008, 135 (2): 273-281.
[33]Wen C M, Cheng Y H, Huang Y F, et al.Isolation and characterization of a neural progenitor cell line from tilapia brain[J]. Comparative Biochemistry and Physiology(Part A), 2008, 49(2): 167-180.
[34]Chen S L, Ye H Q, Sha Z X, et al. Derivation of a pluripotent embryonic cell line from red sea bream blastulas [J]. Journal of Fish Biology, 2003, 63(3):795-805.
[35]任国诚, 陈松林, 沙珍霞. 半滑舌鳎肝脏细胞系的建立与鉴定[J]. 高技术通讯, 2008, 18(6): 657-660.
[36]Wang X L, Wang N, Chen S L, et al. Establishment,characterization of a new cell line from heart of half-smooth tongue sole (Cynoglossus semilaevis) [J].Fish Physio Biochem, 2010, 36(4): 1181-1184.
[37]Huang X H, Huang Y H, Sun J J, et al.Characterization of two grouperEpinephelus akaaracell lines: application to studies of Singapore grouper iridovirus (SGIV)propagation and virus-host interaction[J]. Aquaculture,2009, 292(3-4): 172-179.
[38]Zhou G Z, Li Z Q, Yuan X P, et al. Establishment,characterization, and virus susceptibility of a new marine cell line from red spotted grouper (Epinephelus akaara)[J]. Marine Biotechnology(NY), 2007, 9(3):370-376.
[39]Qin Q W, Wu T H, Jia T L, et al. Development and characterization of a new tropical marine fish cell line from grouper,Epinephelus coioidessusceptible to iridovirus and nodavirus[J]. Journal of Virological Methods, 2006, 131(1): 58-64.
[40]Wen C M, Lee C W, Wang C S, et al. Development of two cell lines fromEpinephelus coioidesbrain tissue for characterization of betanodavirus and megalocytivirus infectivity and propagation [J]. Aquaculture, 2008,278(1-4): 14-21.
[41]Wei Y B, Fan T J, Jiang G J, et al. A novel heart-cell line from brown-marbled grouperEpinephelus fuscoguttatusand its susceptibility to iridovirus[J]. Journal of Fish Biology, 2010, 76(5): 1149-1158.
[42]Wei Y B, Fan T J, Jiang G J, et al. Establishment of a novel fin cell line from Brown-marbled grouper,Epinephelus fuscoguttatus(Forsskal), and evaluation of its viral susceptibility[J].Aquaculture Research, 2009, 40:1523-1531.
[43]Chen S L, Sha Z X, Ye H Q. Establishment of a pluripotent embryonic cell line from sea perch blastula embryo[J]. Aquaculture, 2003, 218(1-4): 141-151.
[44]Ye H Q, Chen S L, Sha Z X, et a1. Development and characterization of five cell lines from heart, liver,spleen and head kidney of sea perch (Lateolabrax japonicus)[J]. J Fish Biol, 2006, 69(Supplement A):115-126.
[45]任国诚, 陈松林, 沙珍霞. 漠斑牙鲆胚胎细胞系的建立与鉴定[J]. 中国水产科学, 2007, 14(4): 579-583.
[46]Wang N, Wang X L, Sha Z X, et al. Establishment,characterization and virus susceptibility of a kidney-derived cell line from southern flounder, Paralichthys lethostigma[J]. J Fish Dis, 2011, 34: 81-85.
[47]Chen S L, Ren G C, Sha Z X, et al. Establishment of a continuous embryonic line from flounder (Paralichthys olivaceus) for virus isolation[J]. Disease of Aquatic Organisms, 2004, 60(3): 241-246.
[48]Chen S L, Ren G C, Sha Z X. Development and characterization of a continuous embryonic cell line from turbot (Scophthalmus maximus)[J]. Aquaculture, 2005,249(1-4): 63-68.
[49]樊廷俊, 耿晓芬, 丛日山, 等. 大菱鲆鳍细胞系的建立[J]. 中国海洋大学学报, 2007, 37(5): 759-764.
[50]Wang N, Wang X L, Sha Z X, et al. Development and characterization of a new marine fish cell line from turbot (Scophthalmus maximus)[J]. Fish Physio Biochem, 2010, 36 (4): 1227-1230.
[51]Alberto J V. Applications and needs of fish and shellfish cell culture for disease control in aquaculture[J].Reviews in Fish Biology and Fisheries, 2003, 13 (1):111-140.
[52]Takizawa N K, Adachi K, Ichinose T, et al. Efficient propagation of betanodavirus in a murine astrocytoma cell line [J]. Virus Research, 2008, 136(1-2):206-210.
[53]Kim W S, Kim S R, Kim D, et al. An outbreak of VHSV (viral hemorrhagic septicemia virus) infection in farmed olive flounderParalichthys olivaceusin Korea[J]. Aquaculture, 2009, 296(2): 165-168.
[54]Zhou B S, Liu W H, Rudolf S S, et al. Cultured gill epithelial cells from tilapia(Oreochromis niloticus): a new in vitro assay for toxicants[J]. Aquatic Toxicology,2005, 71(1): 61-72.
[55]Davoren M, Ní S S, Hartl M G, et al. Assessing the potential of fish cell lines as tools for the cytotoxicity testing of estuarine sediment aqueous elutriates [J].Toxicology in Vitro, 2005, 19(3): 421-431.
[56]Woo S, Kim S J, Yum S S, et al. Comet assay for the detection of genotoxicity in blood cells of flounder(Paralichthys olivaceus)exposed to sediments and polycyclic aromatic hydrocarbons[J]. Marine Pollution Bulletin, 2006, 52(12): 1768-1775.
[57]Qin X, Zhang S C, Guo H R, et al. Nonylphenol causes decrease in antioxidant enzyme activities, increase in O(2)(-) content, and alteration in ultrastructures of FG cells, a flounder(Paralichthys olivaceus) gill cell line[J].Toxicol Mech Methods, 2007, 17(3): 127-134.
[58]Li H Y, Zhang S C. In vitro cytotoxicity of the organophosphorus pesticide parathion to FG-9307 cells[J].Toxicology In Vitro, 2001,15(6): 643-647.
[59]Li H Y, Zhang S C. In vitro cytotoxicity of the organophosphorus insecticide methylparathion to FG-9307, the gill cell line of flounder (Paralichthys olivaceus)[J]. Cell Biol Toxicology, 18 (4): 235-241.
[60]Su F, Zhang S, Li H, et al. 2005. In vitro cytotoxicity of the organotin compound bis-(tri-n-butyltin)oxide to FG cells[J]. Toxicol Mech Methods, 2005, 15 (3): 205-209.
[61]Na N, Guo H R, Zhang S C, et al. In vitro and in vivo acute toxicity of fenpyroximate to flounderParalichthys olivaceusand its gill cell line FG [J]. Aquatic Toxicology, 2009, 92(2): 76-85.
[62]Ryosuke Y, Hirono I K, Ohira T S, et al. Functional analysis of tumor necrosis factor gene promoter from Japanese flounder,Paralichthys olivaceus, using fish cell lines[J]. Developmental and Comparative Immunology, 2005, 29(1): 73-81.
[63]Wu Y C, Lu Y F, Chi S C. Anti-viral mechanism of barramundi Mx against betanodavirus involves the inhibition of viral RNA synthesis through the interference of RdRp[J]. Fish & Shellfish Immunology, 2010,28(3): 467-475.
[64]陈莉, 张敏, 买霞, 等. 鲨鱼软骨制剂对人不同细胞生长抑制作用及其机制的探讨[J]. 解剖科学进展,2002, 8(3): 211-214.
[65]于秋涛, 樊廷俊, 汪小锋, 等. 宽纹虎鲨软骨细胞体外培养的启动[J]. 海洋科学, 2005, 29(3): 33-37.
[66]Shen L, Stuge T B, Zhou H, et a1. Channel catfish cytotoxic cells: a mini-review[J]. Developmental and Comparative Immunology, 2001, 26: 141-149.
[67]Meng Z, Shao J Z, Xiang L X. CpG oligo deoxy nucleotides activate grass carp(Ctenopharyngodonidellus)macrophages [J]. Developmental & Comparative Immunology, 2003, 27(4): 313-321.
[68]Hong Y H, Chen S L, Gui J F, et al. Retention of the developmental pluriopotency in medaka embroyonic stem cells after gene transfer and long-term drug selection towards for gene targeting in fish [J]. Transgenic Research, 2004, 13(3): 41-50.
[69]Chen S L, Sha Z X, Ye H Q, et al. Pluripotency and chimera competence of an embryonic stem cell line from sea perch(Lateolabrax japonicus)[J]. Marine Biotech, 2007, 9(1): 82-91.
[70]陈松林, Hong Y H, Schartl M. 鳉青 p53基因克隆、结构分析及同源重组载体构建[J]. 动物学报, 2002,48(4): 519-526.
[71]童裳亮, 李宏. 牙鲆、鲈鱼和真鲷的四个永生性细胞系建立[J]. 生物工程进展, 1997, 17(3): 3-4.
Q2
A
1000-3096(2011)07-0113-09
2010-03-22;
2010-06-03
国家863项目(2006AA10A401); 山东省泰山学者工程专项经费资助项目
张博(1985-), 男, 内蒙古包头人, 硕士研究生, 主要从事分子细胞生物学研究, E-mail: zb611273@163.com; 陈松林, 通信作者,研究员, 博士生导师, 电话: 0532-85844606; E-mail: chensl@ysfri.ac.cn
谭雪静)

