离子交换法处理曝气后氯化亚铜的废水研究
李国平 薛娟琴 刘漫博 毕强 郭莹娟
(西安建筑科技大学冶金工程学院,西安,710055)
离子交换法处理曝气后氯化亚铜的废水研究
李国平 薛娟琴 刘漫博 毕强 郭莹娟
(西安建筑科技大学冶金工程学院,西安,710055)
通过预曝气的方法,氯化亚铜废水溶液中Cu(Ⅰ)被氧化为Cu(Ⅱ),并能简化氯化亚铜废水溶液的粒子结构,分别采用201×7 OH-型强碱性阴离子树脂和732 Na型强酸性阳离子树脂处理曝气后的氯化亚铜废水,进行了曝气时间、p H值和温度等因素对废水处理效果的研究,得到最佳的处理废水条件。曝气180 min后,在温度60℃,V溶液/V树脂=2/1,阳离子交换反应15 min时,可使废水溶液中铜粒子浓度达到国家废水一级排放标准。
离子交换法;曝气;氯化亚铜
1 前言
氯化亚铜是一种重要的化工产品,在石油化学工业中用作脱硫剂、脱臭剂、凝聚剂、脱离剂及脱色剂等[1-2],在油脂化工等有机合成工业中用作催化剂和还原剂,尤其以催化剂为著称[3]。在氯化亚铜的生产过程中会产生大量含铜2~3 g/L的废水,目前的处理方法不多,且存在各种问题[4]。
离子交换法克服了无机吸附剂在处理含铜废水时选择性差的缺点,对铜离子的选择性高,处理效率也得到提高,并不受废水中铜离子初始浓度的限制,使得废水中的有价成分能够充分富集回收,最终可达到富集铜离子、消除或降低废水中铜离子的目的,而且具有处理容量大、出水水质好等特点[5]。实验采用预曝气法,使得氯化亚铜废水溶液中CuⅠ被氧化为CuⅡ,并能简化氯化亚铜废水溶液的粒子结构,实验考察曝气时间、p H值和温度等因素对废水处理效果的影响规律,确定最佳的反应条件,为简化工艺流程及实现工业化应用提供基础数据。
2 实验部分
2.1 实验仪器与试剂
AA-6800/6650型原子吸收分光光度计(日本岛津),HH-4型数显恒温水浴锅(国华电器有限公司),HY-2型调速多用振荡器(上海嘉鹏仪器公司),PB-10型酸度计(Sarto rius),WM型无油气体压缩机(成都名驰仪器公司),DFH5-2.8型电热鼓室干燥箱(沈阳红旗试验设备厂),SHB-3型循环水多用真空泵(郑州杜甫仪器厂),JJ-1型大功率电动搅拌器(杭州仪表电器厂),Cp2245型电子天平(Sartorius)。
201×7 OH-型强碱性阴离子树脂,732 Na型强酸性阳离子树脂,氯化钠,铜粉,无水亚酸钠,氢氧化钠,硫酸铈铵,邻菲罗啉,硫酸,盐酸,硫酸铵,无水三氯化铁,无水硫酸铜,均为AR级。
2.2 氯化亚铜废水的制备
采用共同还原法[6]制得转化率为82%的氯化亚铜粉末,并得到总铜浓度约为2 g/L的废水。氯化亚铜废水溶液中的CuⅠ主要以阴离子形式存在,CuⅡ主要以阳离子及中性配合物形式存在,[Cu(I)]T和[Cu(II)]T分别为0.024 mol/L和0.0076 mol/L,废水溶液p H值为2.6。
2.3 离子交换法处理废水原理
对于离子交换处理溶液中CuⅠ、CuⅡ的研究均有报道[7-8]。溶液中[Cu(I)]T和[Cu(II)]T分别为0.024 mo l/L和0.0076 mol/L,所以实验分别选择201×7 OH-型强碱性阴离子树脂[9-10]和732 Na型强酸性阳离子树脂[11-12]进行离子交换实验。其交换反应式分别如下:
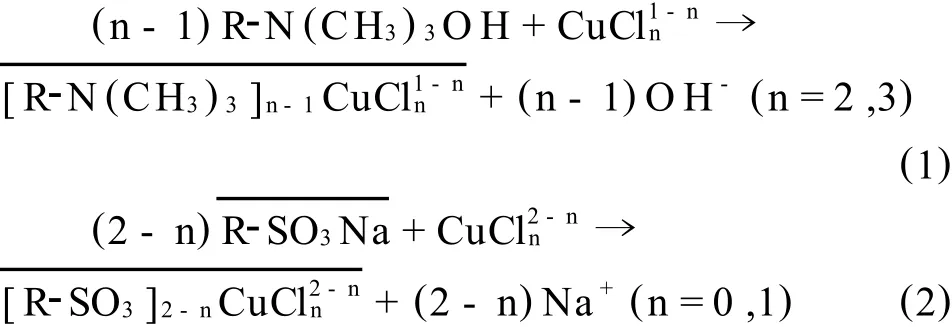
2.4 离子交换实验方法
(1)实验准备:首先将201×7 OH-型强碱性阴离子树脂和732 Na型强酸性阳离子树脂预处理后转为OH-型和Na型,然后对两种树脂进行饱和吸附量的测定实验[13-14],根据吸附反应的吸附量Q(μg/mL)和吸附率E(%)的计算公式及树脂用量公式可计算出201×7 OH-型强碱性阴离子树脂处理100 mL氯化亚铜废水需树脂55 mL,732 Na型强酸性阳离子树脂处理100 mL氯化亚铜废水需树脂42 mL。
(2)交换实验:分别用201×7 OH-型强碱性阴离子树脂和732 Na型强酸性阳离子树脂对氯化亚铜废水进行离子交换实验,并交替使用两种树脂进行多级交换实验,研究溶液p H值、温度、反应时间等对交换结果的影响。
2.5 溶液中各离子浓度的测定方法
(1)总Cu浓度的测定:溶液中总Cu的浓度均由原子吸收法[15]测得。
(2)CuⅠ浓度的测定[16]。
(3)溶液中CuⅡ的计算:由总Cu和CuⅠ的浓度,差量法得CuⅡ浓度。
(4)Cl-的浓度用AgNO3法[15]测定。
3 实验结果与讨论
3.1 曝气时间对溶液中CuⅠ浓度的影响
曝气可将CuⅠ氧化为CuⅡ,所以曝气时间直接影响溶液中CuⅠ氧化为CuⅡ的转化率。实验在25℃,空气压缩机排气压力为0.3 MPa条件下。向氯化亚铜废水中分别通入空气 10、30、120、180 m in,实验结果如图1所示。
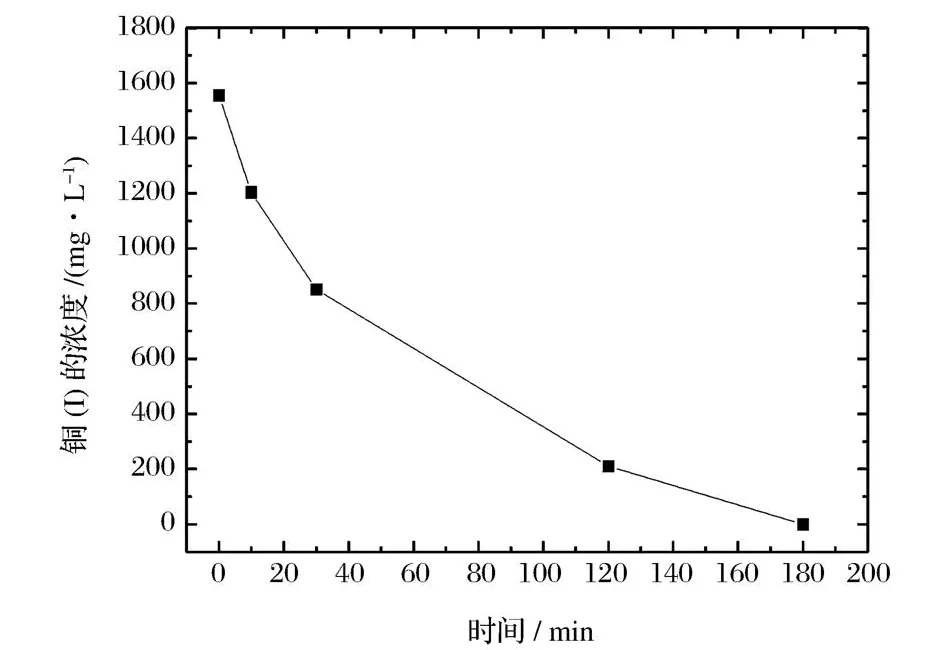
图1 曝气时间与铜含量的关系Figure 1.Relationship between the concentration of copper and aeration time.
从图1可知,随着曝气时间的延长溶液中CuⅠ的浓度明显下降,当曝气时间达到180 min时,滴定CuⅠ浓度时,看不到明显的变色点,可以说绝大部分的CuⅠ已被氧化为CuⅡ,因此确定曝气时间为180 min。此时溶液中铜的浓度降309.7 mg/L。
3.2 曝气时间对离子交换实验结果的影响
氯化亚铜废水经曝气不同时间后,分别对所得溶液进行离子交换实验。实验条件:①25℃条件下,V溶液/V树脂=2/1,进行阴离子交换反应,匀速振荡15 m in;②25℃条件下,V溶液/V树脂=2/1,进行阳离子交换反应,匀速振荡15 min,实验结果如图2所示。
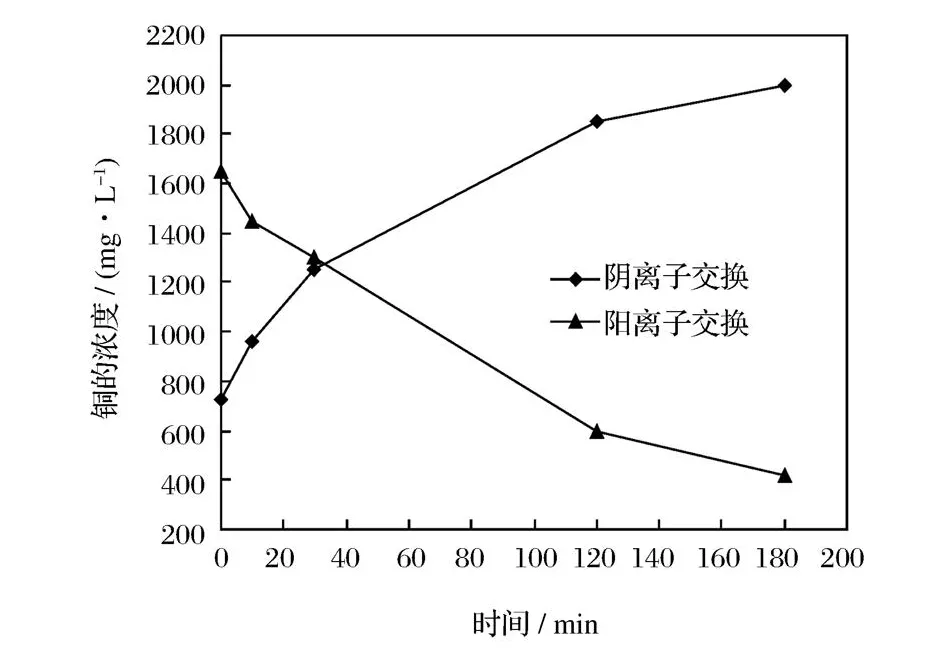
图2 曝气时间与铜含量的关系Figure 2.Relationship between the concen tration of copper and aeration time.
由图2可知,曝气时间越长越利于阳离子交换,而不利于阴离子交换。溶液中CuⅠ浓度的降低及CuⅡ的浓度的升高是造成此现象的主要原因。其中,对曝气180 min后溶液进行的阳离子交换实验可使溶液中Cu的浓度降到414.7 mg/L,一次吸附率为75.6%。
3.3 p H值对曝气后溶液离子交换及萃取实验结果的影响
曝气完全后,溶液p H值为1.6,导致溶液酸度变化主要有以下两方面原因:CuⅠ的氧化使得溶液酸度降低,如式(3)所示;CuⅡ浓度的增加使得溶液酸度升高,如式(4)、(5)所示。
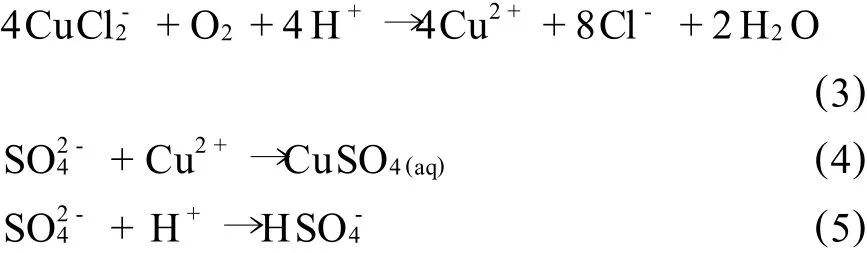
浓HCl及NaOH分别调节曝气后溶液p H值为0.5,1.0,1.2,1.6,2.0,V溶液/V树脂=2/1,进行阳离子交换反应15 min,实验结果如图3所示。
由图3可知,p H值降低有利于阳离子交换反应的发生。由式(3)、(4)可知,H+浓度增加,溶液中SO2-4浓度降低,溶液中游离的Cu2+增加,阳离子交换反应更容易发生。p H值在1.2~2.0可达到较好的处理效果。
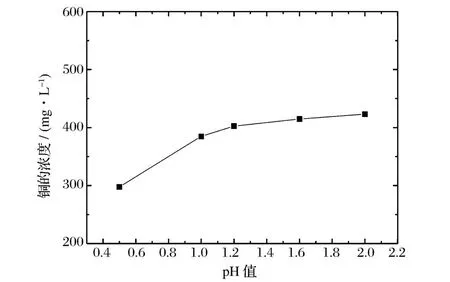
图3 pH与铜含量的关系Figure 3.Relationship between the concen tration of copper and pH.
3.4 温度对曝气后溶液离子交换及萃取实验结果的影响
分别在25、35、45、55、60℃条件下,V溶液/V树脂= 2/1,进行阳离子交换15 min,实验结果如图4所示。
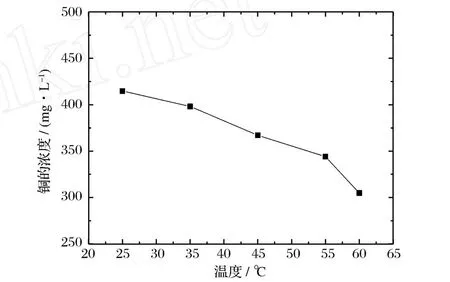
图4 温度与铜含量的关系Figure 4.Relationship between the concentration of copper and tem perature.
由图4可知,温度升高,有利于阳离子交换反应,温度升高,溶液离子活动加剧,离子交换反应更容易发生。在低耗能条件下,设置60℃较为合适。
4 结语
向氯化亚铜废水溶液中曝气180 min,可使溶液中的CuⅠ几乎完全被氧化为CuⅡ,并且溶液曝气后,对溶液中阳离子交换反应的效率明显提高, p H值的降低利于阳离子交换反应的发生,升高温度利于阳离子树脂交换。实验表明,曝气180 min后,在温度60℃,V溶液/V树脂=2/1,阳离子交换反应15 min时,可使废水溶液中铜粒子浓度达到国家废水一级排放标准。
[1]康文通,陈仲祥,李小云.低品位铜矿制备活性氯化亚铜[J].矿业研究与开发,2005,25(3):44-46.
[2]黄凌涛,刘定富,曾祥钦,等.从含铜废水制备氯化亚铜的研究[J].无机盐工业,2008,40(4):46-48.
[3]李晓光,赵宏伟,李岩.现代氯化亚铜合成工艺[J].吉林化工学院学报,2006,6(3):22-24.
[4]李博,刘述平.含铜废水的处理技术及研究进展[J].矿产综合利用,2008,5:33-37.
[5]Amanda Black,Dave Craw.A rsemic Copper and zinc occurrence at the Wangaba coal mine[J].International Journal of Coal Geology,2001,45:181-193.
[6]彭济时,范兴永.一种联合法生产氯化亚铜的工艺:中国专利,94105209.5[P].1998-12-20.
[7]Fo rster H U.Hatje Investigations on the solid-state ion exchange of and ions into zeolite Y using EXAFS techniques[J].Solid State Ionics,1997(101):425-430.
[8]A tsushi Itadani,Ryotaro Kumashiro,Yasushige Kuroda,et al.Calorimetric study of N2adsorption oncopperion-exchanged ZSM-5 zeolite[J].Thermochimica Acta, 2004(416):99-104.
[9]Fu Fenglian,Zeng Haiyan,Cai Qinhong,et al.Effective removal of coordinated copper from wastewater using a new dithiocarbamate-type sup ramolecular heavy metal precipitant[J].Chemosphere,In Press,Corrected Proof,Available online,2007(7):12.
[10]Xie J Z,Chang H L,Kilbane J J.Removal and recovery of metal ions from wastewater using bioso rbents and chemically modified biosorbents[J].Bioresource Technology,1996(57):127-136.
[11]Feng Xiao,Wu Zucheng,Chen Xuefen.Removal of metal ions from electroplating effluent by ED Ip rocess and recycle of purified water[J].Separation and Purification Technology,2007(57):257-263.
[12]Wang Ying,Wang Bo,Ma Hongzhu.Electrochemical catalytic treatment of wastewater by metal ion supported on cation exchange resin[J].Journal of Hazardous, Materials,2006(137):1853-1858.
[13]朱屯编.萃取与离子交换[M].北京:冶金工业出版社, 2005.
[14]邓勃.印迹技术在痕量金属分离和富集中的应用进展[J].中国无机分析化学,2011,1(1):1-6.
[15]武汉大学等编.分析化学(第四版)[M].北京:高等教育出版社,2000.
[16]陆为林,杨春生.氯化亚铜中亚铜及高价铜盐含量的示波滴定[J].分析化学,1998(1):17.
Disposal of Aerated Cuprous Chloride Wastewater Using Ion-Exchange Method
LIGuoping,XUE Juanqin,LIU Manbo,B IQiang,GUO Yingjuan
(School of Metallurgical Engineering,Xian University of A rchitecture and Technology,Xian,Shanxi710055,China)
Through aeration treatment for cup rous chlo ride w astew ater,the CuⅠw asoxidized to the CuⅡand the structure of particles in the wastewater was also simp lified.The aerated cup rous chloride w astew ater w as treated by 201×7 OH-strong-base anion exchange resin and 732 Na strong-acid cation exchange resin.The effects of aeration time,p H and temperature on wastewater treatment were studied. The best disposal condition wasobtained.After 180 mins’aeration,at 60℃,with Vsolution/Vresin=2/1,cation exchange reaction underwent for 15 min,then the concentration of copper particles met the national first-o rder standard for w astew ater disposal.
ion exchange resin;aeration;cup rous chloride
O658.1+3;X781
A
2095-1035(2011)03-0032-03
10.3969/j.issn.2095-1035.2011.03.0006
2011-06-12
2011-07-05
国家支撑计划项目(No.2009BAA 20B02);国家自然科学基金项目(No.50874087,No.50978212)
李国平,女,理学硕士。Email:61636654@qq.com

